
D – элемент: ХРОМ ( в рамках работы с одаренными детьми и подготовке к ЕГЭ )
Элемент № 24
Работу выполнила:
Учитель высшей квалификационной категории МБОУ СШ№19 им.И.П. Мытарева города Димитровграда
Абдулганиева С.С.

ПОЛОЖЕНИЕ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ
- химический элемент VI группы побочной подгруппы
- атомный номер 24
- атомная масса 51,996
- обозначается символом Cr
- Электронная формула: 24 Cr )2)8)13)1
1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1
+1; +4; +5; +2; +3; +6; - (наиболее устойчивы в соединениях хрома).

ЭТИМОЛОГИЯ НАЗВАНИЯ
Название элемент
получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.

НАХОЖДЕНИЕ В ПРИРОДЕ
Хром является довольно распространённым элементом. Основные соединения хрома — хромистый железняк(FeCr2O4)
Самые большие месторождения хрома находятся в ЮАР (1 место в мире) , Казахстане, России,
России, Зимбабве, Мадагаскаре.
Главные месторождения хромовых руд в РФ
известны на Урале.
хромит

ФИЗИЧЕСКИЕ СВОЙСТВА
Хром – голубовато-белый металл, с кубичес-
кой объемно-центрированной решеткой с металлическим типом химической связи.
T пл =1890°С, Т кип= 2680 °C, ρ= 7,19 г/см 3 . Чистый хром пластичен при обычных условиях, достаточно хорошо поддаётся механической обработке. Самый твердый из чистых металлов. На воздухе покрыт прочной пленкой оксида.
 600°С 4Cr + 3O 2 = 2Cr 2 O 3 2. Реагирует c фтором при 350°С, с хлором – при 300°С, с бромом – при температуре красного каления 2Cr + 3Cl 2 = 2CrCl 3 3. Реагирует с азотом при t1000°С 2Cr + N 2 = 2CrN или 4Cr + N 2 = 2Cr 2 N 4. С cерой при t 300°С образует сульфиды от CrS до Cr 5 S 8 , например: 2Cr + 3S = Cr 2 S 3 . 5. Реагирует с бором, углеродом и кремнием с образованием боридов, карбидов и силицидов: Cr + 2B = CrB 2 (возможно образование Cr 2 B, CrB, Cr 3 B 4 , CrB 4 ), 2Cr + 3C = Cr 2 C 3 (возможно образование Cr 23 C 6 , Cr 7 B 3 ), Cr + 2Si = CrSi 2 (возможно образование Cr 3 Si, Cr 5 Si 3 , CrSi). 6. С водородом непосредственно не взаимодействует. " width="640"
600°С 4Cr + 3O 2 = 2Cr 2 O 3 2. Реагирует c фтором при 350°С, с хлором – при 300°С, с бромом – при температуре красного каления 2Cr + 3Cl 2 = 2CrCl 3 3. Реагирует с азотом при t1000°С 2Cr + N 2 = 2CrN или 4Cr + N 2 = 2Cr 2 N 4. С cерой при t 300°С образует сульфиды от CrS до Cr 5 S 8 , например: 2Cr + 3S = Cr 2 S 3 . 5. Реагирует с бором, углеродом и кремнием с образованием боридов, карбидов и силицидов: Cr + 2B = CrB 2 (возможно образование Cr 2 B, CrB, Cr 3 B 4 , CrB 4 ), 2Cr + 3C = Cr 2 C 3 (возможно образование Cr 23 C 6 , Cr 7 B 3 ), Cr + 2Si = CrSi 2 (возможно образование Cr 3 Si, Cr 5 Si 3 , CrSi). 6. С водородом непосредственно не взаимодействует. " width="640"
ХИМИЧЕСКИЕ СВОЙСТВА
Cr при обычных условиях – инертный металл, при нагревании становится довольно активным.
- Взаимодействие с неметаллами
t 600°С
4Cr + 3O 2 = 2Cr 2 O 3
2. Реагирует c фтором при 350°С, с хлором – при 300°С, с бромом – при температуре красного каления
2Cr + 3Cl 2 = 2CrCl 3
3. Реагирует с азотом при t1000°С
2Cr + N 2 = 2CrN
или 4Cr + N 2 = 2Cr 2 N
4. С cерой при t 300°С образует сульфиды от CrS до Cr 5 S 8 , например:
2Cr + 3S = Cr 2 S 3 .
5. Реагирует с бором, углеродом и кремнием с образованием боридов, карбидов и силицидов:
Cr + 2B = CrB 2 (возможно образование Cr 2 B, CrB, Cr 3 B 4 , CrB 4 ),
2Cr + 3C = Cr 2 C 3 (возможно образование Cr 23 C 6 , Cr 7 B 3 ),
Cr + 2Si = CrSi 2 (возможно образование Cr 3 Si, Cr 5 Si 3 , CrSi).
6. С водородом непосредственно не взаимодействует.

ХИМИЧЕСКИЕ СВОЙСТВА
2. Взаимодействие с водой
В тонкоизмельченном раскаленном состоянии хром реагирует с водой
2Cr + 3H 2 O = Cr 2 O 3 + 3H 2
3. Взаимодействие с кислотами
1. В электрохимическом ряду напряжений металлов хром находится до водорода, он вытесняет водород из растворов неокисляющих кислот:
Cr + 2HCl = CrCl 2 + H 2 ;
Cr + H 2 SO 4 = CrSO 4 + H 2 .
2. В присутствии кислорода воздуха образуются соли хрома (III):
4Cr + 12HCl + 3O 2 = 4CrCl 3 + 6H 2 O.
3. Концентрированная азотная и серная кислоты пассивируют хром. Хром может растворяться в них лишь при сильном нагревании, образуются соли хрома (III) и продукты восстановления кислоты:
2Cr + 6H 2 SO 4 = Cr 2 (SO 4 ) 3 + 3SO 2 + 6H 2 O;
Cr + 6HNO 3 = Cr(NO 3 ) 3 + 3NO 2 + 3H 2 O.

ХИМИЧЕСКИЕ СВОЙСТВА
4. Взаимодействие с щелочными реагентами
1. В водных растворах щелочей хром не растворяется, медленно реагирует с расплавами щелочей с образованием хромитов и выделением водорода :
2Cr + 6KOH = 2KCrO 2 + 2K 2 O + 3H 2 .
2. Реагирует с щелочными расплавами окислителей, например хлоратом калия, при этом хром переходит в хромат калия:
Cr + KClO 3 + 2KOH = K 2 CrO 4 + KCl + H 2 O.
5. Восстановление металлов из оксидов и солей
Хром – активный металл, способен вытеснять металлы из растворов их солей:
2Cr + 3CuCl 2 = 2CrCl 3 + 3Cu.
![Химические свойства соединений хрома Степень окисления Оксид +2 +3 Гидроксид CrO (чёрный) +4 Cr 2 O 3 Cr(OH) 2 Характер (желтый) (зелёный) Cr(OH) 3 Основный Преобладающие формы в растворах CrO 2 +6 не существует Cr 2+ (соли голубого цвета) (серо-зеленый) Амфотерный Примечания CrO 3 Несолеобразующий Очень сильный восстановитель Cr 3+ (зеленые или лиловые соли) [Cr(OH) 4 ] - (зелёный) (красный) H 2 CrO 4 H 2 Cr 2 O 7 - Кислотный Встречается редко CrO 4 2- (хроматы, желтые) Cr 2 O 7 2- (дихроматы, оранжевые) Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит. наиболее устойчивая](https://fsd.multiurok.ru/html/2022/03/21/s_62388d6ed7e42/img8.jpg)
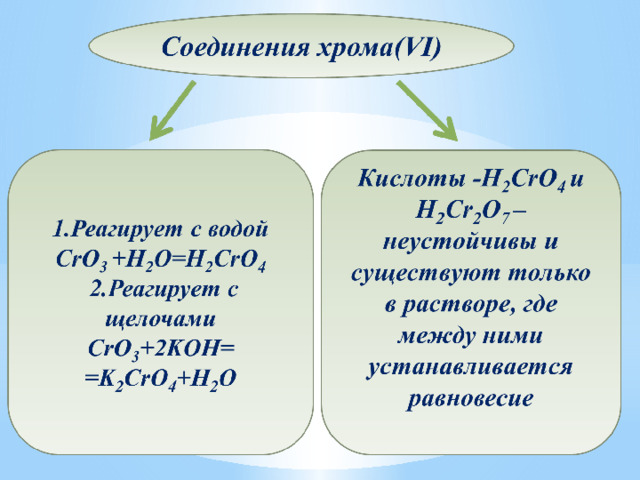
Химические свойства соединений хрома
Степень окисления
Оксид
+2
+3
Гидроксид
CrO (чёрный)
+4
Cr 2 O 3
Cr(OH) 2
Характер
(желтый)
(зелёный)
Cr(OH) 3
Основный
Преобладающие формы в растворах
CrO 2
+6
не существует
Cr 2+ (соли голубого цвета)
(серо-зеленый)
Амфотерный
Примечания
CrO 3
Несолеобразующий
Очень сильный восстановитель
Cr 3+ (зеленые или лиловые соли) [Cr(OH) 4 ] - (зелёный)
(красный)
H 2 CrO 4 H 2 Cr 2 O 7
-
Кислотный
Встречается редко
CrO 4 2- (хроматы, желтые) Cr 2 O 7 2- (дихроматы, оранжевые)
Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит.
наиболее
устойчивая



ПОЛУЧЕНИЕ
1)Пирометаллургический способ: FeO * Cr 2 O 3 +4C = 2Cr + Fe + 4CO
2)Алюминотермический способ: Cr 2 O 3 + 2Al = Al 2 O 3 + 2Cr
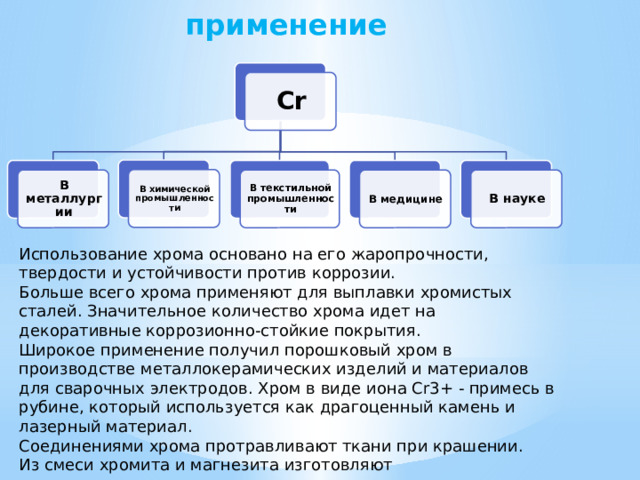
применение
Cr
В химической промышленности
В металлургии
В медицине
В текстильной промышленности
В науке
Использование хрома основано на его жаропрочности, твердости и устойчивости против коррозии.
Больше всего хрома применяют для выплавки хромистых сталей. Значительное количество хрома идет на декоративные коррозионно-стойкие покрытия.
Широкое применение получил порошковый хром в производстве металлокерамических изделий и материалов для сварочных электродов. Хром в виде иона Cr3+ - примесь в рубине, который используется как драгоценный камень и лазерный материал.
Соединениями хрома протравливают ткани при крашении.
Из смеси хромита и магнезита изготовляют хромомагнезитовые огнеупорные изделия

Роль хрома в живых организмах
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
В конце 1950-х гг. два исследователя, Шварц и Мерц, сообщили, что у крыс, которые были на рационе, дефицитном по хрому, развивалась непереносимость сахара; при добавлении же хрома в рацион их состояние нормализовалось. Это было первым подтверждением, что хром необходим животным для нормальной жизни. С тех пор исследователи поняли, что хром играет такую же роль и для здоровья человека.











 600°С 4Cr + 3O 2 = 2Cr 2 O 3 2. Реагирует c фтором при 350°С, с хлором – при 300°С, с бромом – при температуре красного каления 2Cr + 3Cl 2 = 2CrCl 3 3. Реагирует с азотом при t1000°С 2Cr + N 2 = 2CrN или 4Cr + N 2 = 2Cr 2 N 4. С cерой при t 300°С образует сульфиды от CrS до Cr 5 S 8 , например: 2Cr + 3S = Cr 2 S 3 . 5. Реагирует с бором, углеродом и кремнием с образованием боридов, карбидов и силицидов: Cr + 2B = CrB 2 (возможно образование Cr 2 B, CrB, Cr 3 B 4 , CrB 4 ), 2Cr + 3C = Cr 2 C 3 (возможно образование Cr 23 C 6 , Cr 7 B 3 ), Cr + 2Si = CrSi 2 (возможно образование Cr 3 Si, Cr 5 Si 3 , CrSi). 6. С водородом непосредственно не взаимодействует. " width="640"
600°С 4Cr + 3O 2 = 2Cr 2 O 3 2. Реагирует c фтором при 350°С, с хлором – при 300°С, с бромом – при температуре красного каления 2Cr + 3Cl 2 = 2CrCl 3 3. Реагирует с азотом при t1000°С 2Cr + N 2 = 2CrN или 4Cr + N 2 = 2Cr 2 N 4. С cерой при t 300°С образует сульфиды от CrS до Cr 5 S 8 , например: 2Cr + 3S = Cr 2 S 3 . 5. Реагирует с бором, углеродом и кремнием с образованием боридов, карбидов и силицидов: Cr + 2B = CrB 2 (возможно образование Cr 2 B, CrB, Cr 3 B 4 , CrB 4 ), 2Cr + 3C = Cr 2 C 3 (возможно образование Cr 23 C 6 , Cr 7 B 3 ), Cr + 2Si = CrSi 2 (возможно образование Cr 3 Si, Cr 5 Si 3 , CrSi). 6. С водородом непосредственно не взаимодействует. " width="640"


![Химические свойства соединений хрома Степень окисления Оксид +2 +3 Гидроксид CrO (чёрный) +4 Cr 2 O 3 Cr(OH) 2 Характер (желтый) (зелёный) Cr(OH) 3 Основный Преобладающие формы в растворах CrO 2 +6 не существует Cr 2+ (соли голубого цвета) (серо-зеленый) Амфотерный Примечания CrO 3 Несолеобразующий Очень сильный восстановитель Cr 3+ (зеленые или лиловые соли) [Cr(OH) 4 ] - (зелёный) (красный) H 2 CrO 4 H 2 Cr 2 O 7 - Кислотный Встречается редко CrO 4 2- (хроматы, желтые) Cr 2 O 7 2- (дихроматы, оранжевые) Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит. наиболее устойчивая](https://fsd.multiurok.ru/html/2022/03/21/s_62388d6ed7e42/img8.jpg)























