
D – элемент: Марганец ( в рамках работы с одаренными детьми и подготовке к ЕГЭ )
Работу выполнила:
Учитель высшей квалификационной категории МБОУ СШ№19 им.И.П. Мытарева города Димитровграда
Абдулганиева С.С.

Изучить все свойства марганца и как можно ближе познакомиться с этим металлом.
- Ознакомиться с самим металлом.
- Узнать о физических и химических свойствах Mn.
- Ознакомиться со всеми степенями окисления этого металла.
- Рассмотреть с чем взаимодействует Mn.
- А также узнать, как получают этот металл и где (в чем) он используется.
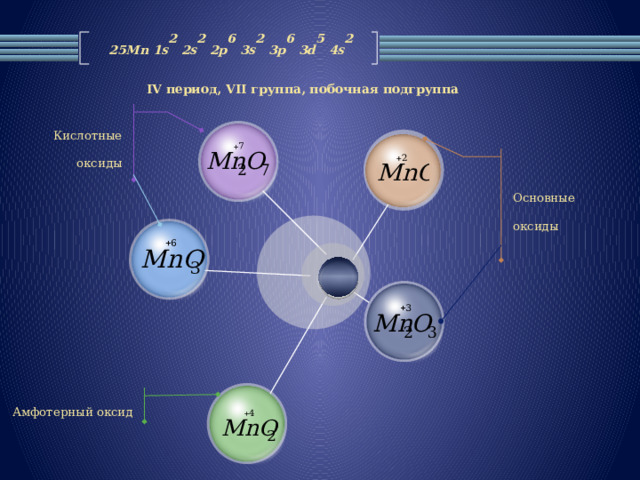
25Mn 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2
IV период, VII группа, побочная подгруппа
Кислотные оксиды
Основные оксиды
Амфотерный оксид

Распространение в природе
- Марганец — 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся в земной коре (0,03 % от общего числа атомов земной коры). Марганец, рассеянный в горных породах вымывается водой и уносится в Мировой океан.

Химические свойства
(и другие оксиды)
(медленно)
где X=NO, N2O, N2, NH3, NH4 в зависимости от концентрации
HNO3

Химические свойства
+ О 2 ; неметаллы
Mn
+ H 2 O
+ растворы HCl, H 2 SO 4
+ H 2 SO 4 (конц.); HNO 3
+ оксиды металлов
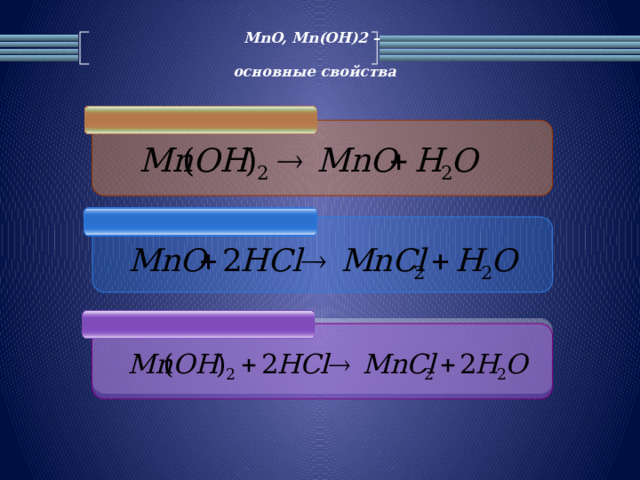
MnO, Мn(OH)2 –
основные свойства
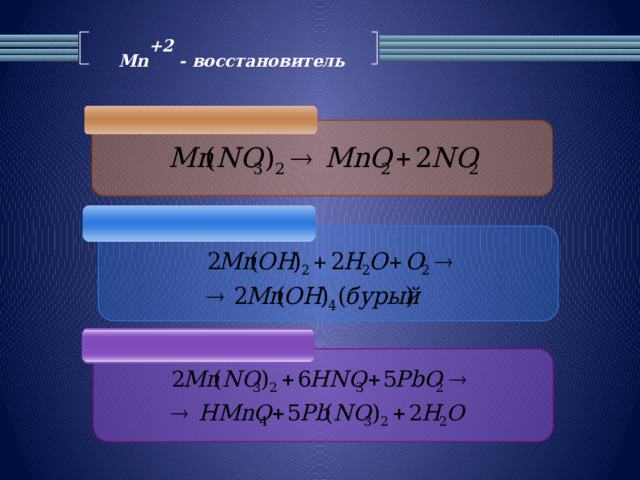
Mn +2 - восстановитель
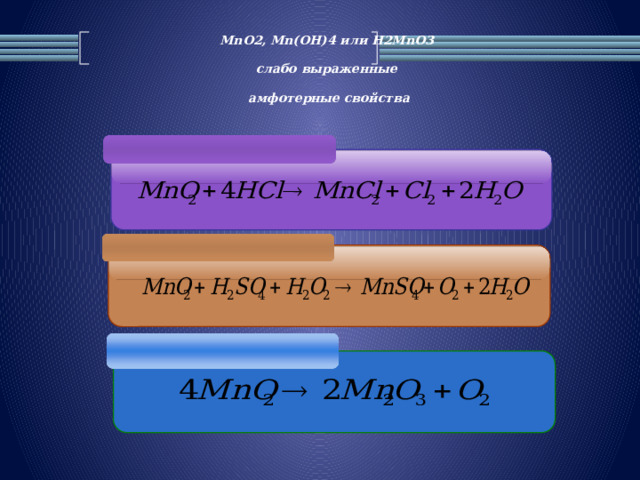
MnO2, Mn(OH)4 или H2MnO3 слабо выраженные амфотерные свойства

Mn2O7, HMnO4 – сильные окислители

Физические свойства
Марганец твёрдый, хрупкий металл светло-серого цвета
t плавления = 1247°С
t кипения = 2080°С
плотность = 7,2 г/см3
На воздухе марганец окисляется, в результате чего его поверхность покрывается плотной оксидной пленкой, которая предохраняет металл от дальнейшего окисления. При прокаливании на воздухе выше 800°C марганец покрывается окалиной, состоящей из внешнего слоя Mn3O4 и внутреннего слоя состава MnO.

Природные соединения
Элемент Mn по распространенности в земной коре среди тяжелых металлов следует за железом, но заметно уступает ему, – содержание Fe составляет около 5 %, а Mn – лишь около 0,1%.
У марганца более распространены оксидные и карбонатные и руды.
Наибольшее значение имеют минералы: пиролюзит MnO 2 и родохрозит MnCO 3 .
Кроме этих минералов для получения Mn используют гаусманит Mn 3 O 4 и гидратированный оксид псиломелан MnO 2 . xH 2 O. В марганцевых рудах всегда содержатся минералы Fe.

Соединения марганца (+2)
В водных растворах соединения Mn( +2 ) устойчивы в кислой среде.
Гидроксид Mn(OH) 2 выпадает в виде светло-бежевого осадка при добавлении щелочи к раствору соли Mn( +2 ).
Оксид и гидроксид Mn( +2 ) имеют основной характер, легко растворяются в кислотах с образованием гидратированного катиона Mn 2+.
На воздухе Mn(OH)2 окисляется с образованием гидратированного MnO 2 . При добавлении пероксида водорода к Mn(OH) 2 , он быстро окисляется по реакции:
Растворы солей марганца ( +2 ) практически бесцветны (имеют слегка розоватый оттенок).
Оксид MnO – серо-зеленое тугоплавкое кристаллическое соединение (температура плавления – 18420С). В воде MnO не растворяется.
Mn(OH) 2 + H2O 2 = MnO 2 + 2H 2 O

Соединения марганца (+4)
MnO 2 + 4HCl (конц.) = MnCl 2 + Cl 2 + 2H 2 O
Реакцию используют в лаборатории для получения Cl 2 .
В очень кислой среде MnO2 стремится перейти в катион Mn 2+.
С щелочами MnO 2 реагирует только в расплавах с образованием смешанных оксидов. В присутствии окислителя в щелочных расплавах образуются манганаты.
Оксид MnO 2 используют в промышленности в качестве дешевого окислителя.
Оксид MnO 2 – наиболее устойчивое соединение Mn .
Это черно-коричневое вещество с очень прочной кристаллической решеткой. По этой причине, он не реагирует с растворами щелочей и с разбавленными кислотами. Он растворяется в концентрированных кислотах.

Соединения марганца (+6)
Манганаты – соли с анионом MnO 4( 2–) , имеют яркий зеленый цвет.
Анион MnO 4( 2─) устойчив только в сильнощелочной среде.
Под действием воды и, особенно, кислоты манганаты диспропорционируют:
3MnO 4( 2– ) + 2H 2 O = MnO2 + 2MnO (4–) + 4OH (–)
По этой причине кислота Н 2 MnO 4 не существует.
Манганаты можно получить, сплавляя MnO 2 с щелочами или карбонатами в присутствии окислителя.
2MnO 2 (к) + 4KOH (ж) + О 2 = 2K 2 MnO 4 + 2H 2 O
Манганаты являются сильными окислителями, но если на них подействовать еще более сильным окислителем, то они переходят в перманганаты.
2K 2 MnO 4 + Cl 2 = 2KMnO 4 + 2KCl

Соединения марганца (+7)
Все соединения Mn(+7) проявляют сильные окислительные свойства.
При нагревании кристаллического перманганата он разлагается.
2KMnO 4 = K 2 MnO 4 + MnO 2 + O 2
По этой реакции в лаборатории можно получать O 2 .
При нагревании KMnO 4 с концентрированной соляной кислотой образуется газ Cl 2 .
2KMnO 4 (к) + 16HCl (конц.) = 2MnCl 2 + 5Cl 2 + 8H 2 O + 2KCl
По этой реакции в лаборатории можно получать Cl 2 .

При добавлении к кристаллам перманганата нескольких капель концентрированной серной кислоты образуется ангидрид марганцовой кислоты Mn 2 O 7 .
2KMnO 4 + H 2 SO 4 =Mn 2 O 7 + K 2 SO 4 + H 2 O
При растворении Mn2O7 в воде образуется марганцовая кислота.
Многие органические вещества окисляются под действием Mn 2 O 7 до СО 2 и Н 2 О.
HMnO 4 – это сильная кислота, существует только в водном растворе.
Кислота HMnO 4 разлагается с выделением O 2 и MnO 2 .

Взаимодействие марганца с неметаллами
Марганец при взаимодействии с неметаллами, дает продукты со степенью окисления +2.
Составьте уравнения реакций марганца с кислородом, серой, фосфором, азотом, хлором, кремнием:
2Mn + O 2 = 2MnO
также образуются Mn 2 O 3 и Mn 3 O 4
Mn + S = MnS
3Mn + 2P = Mn 3 P 2
3Mn + N 2 = Mn 3 N 2
2Mn + Si = Mn 2 Si

С концентрированной серной кислотой марганец реагирует при нагревании:
Mn + H 2 SO 4 (конц.) → MnSO 4 + SO 2 + H 2 O
С концентрированной азотной кислотой марганец реагирует
при обычных условиях:
Mn + HNO 3 (конц.) → Mn(NO 3 ) 2 + NO 2 + H 2 O
Марганец может восстанавливать оксиды многих металлов.
Это его свойство используется в металлургии при выплавке сталей:
Mn + Fe 2 O 3 → MnO + Fe

При нагревании марганец взаимодействует с водой
MnO + H 2 O → Mn(OH) 2 + H 2 O
MnO – 2e → Mn +2 1 восстановитель, окисление
2H +1 + 2e → H 2 O 1 окислитель, восстановление
Mn + 2H 2 O = Mn(OH) 2 + H 2
Взаимодействие марганца с оксидами металлов
Марганец восстанавливает металлы из их оксидов:
5Mn + Nb 2 O 5 = 5MnO + 2Nb

Получение марганца
1. Алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита:
4MnO 2 → 2Mn 2 O 3 + О 2
Mn 2 O 3 + 2Al → 2Mn + Al 2 O 3
2. Восстановлением железосодержащих оксидных руд марганца коксом. Этим способом в металлургии обычно получают ферромарганец (80 % Mn).
3. Чистый металлический марганец получают электролизом.
MnSO 4 + 2H 2 O Mn + H 2 + O 2 + H 2 SO 4
электролиз

Применение марганца
1. Черная металлургия
2. Легирование сталей
3. Использование в сплавах
4. Покрытия из марганца на металлических поверхностях
5. Производство ферритных материалов

Более 90% производимого марганца идет в черную металлургию. Марганец используют как добавку к сталям для их раскисления, десульфурации (при этом происходит удаление из стали нежелательных примесей — кислорода, серы и других).
Марганец используют для легирования сталей, т. е. улучшения их механических и коррозионных свойств.

Марганец применяется также в медных, алюминиевых и магниевых сплавах.
Покрытия из марганца на металлических поверхностях обеспечивают их антикоррозионную защиту. Для нанесения тонких покрытий из марганца используют легко летучий и термически нестабильный биядерный декакарбонил Mn 2 (CO) 10.
Ферромарганец является сплавом железа и марганца.

Влияние изменения степени окисления марганца на свойства его соединений.
- Кислотно-основные свойства оксидов и гидроксидов марганца зависят от степени окисления марганца.
MnO Mn 2 O 3 MnO 2 (MnO 3 ) Mn 2 O 7
Mn(OH) 2 Mn(OH) 3 Mn(OH) 4 (H 2 MnO 4 ) HMnO 4
кислотные
амфотерные
основные










































