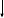Структура урока исследования
Формирование и развитие у учащихся умения самостоятельно добывать знания является одной из актуальных задач обучения. Решение этой задачи заключается, в приобщении учащихся к исследовательским приемам. Методика, способствующая формированию у учащихся умений самостоятельно проводить исследования, зависит от многих факторов, но прежде всего от особенностей содержания учебного материала. Характер содержания придает вариативность методу обучения, что, в свою очередь, отражается на структуре урока, включающего исследования учащихся.
Рассмотрим структуру одного урока, проводимой исследовательским методом в 8-ом классе. Учащиеся к этому времени приобретают достаточный запас знаний, позволяющий им прогнозировать свойства конкретных веществ и изучать теоретические вопросы с помощью самостоятельного исследования. Структура уроков, проводимых исследовательским методом, соответствует общей структуре исследования. Такие уроки характеризуется рядом общих признаков: созданием проблемной ситуации, применением учащимися научных методов исследования, самостоятельностью учащихся в приобретении новых знаний или при обобщении изученного материала. В зависимости от характерных особенностей рассматриваемых вопросов в структуре уроков появляются и существенные отличия. Исследование теоретического вопроса продолжается в течение ряда уроков, а исследование вещества начинается и заканчивается на одном уроке.
Рассмотрим структуру одного из уроков, на котором, изучается теоретический вопрос с помощью исследовательского метода.
Урок на тему «Механизм электролитической диссоциации»
Цель урока: раскрыть учащимися причины диссоциации электролитов в воде и в других полярных растворителях: объяснить механизм диссоциации электролитов; познакомить учащихся с новым понятием «гидратированный ион»; продолжить работу по формированию у них умений строить предположения на основе выявленных причин и следствий, умений проектировать опыт, необходимый для подтверждения высказанного предположения.
В начале урока предлагаю учащимся самостоятельную работу:
I вариант: Выпишите из предложенного перечня веществ электролиты и неэлектролиты. Сделайте вывод о влиянии характера связи веществ на его электропроводность: С6 Н6 – бензол, K2 SO4 -сульфат калия, CS2- дисульфид углерода, HF- фтороводород, HNO3 – азотная кислота, NaOH- гидроксид натрия, N2- азот.
II вариант: Укажите, какие из перечисленных веществ и смесей электропроводны: сжиженный О2 , расплавленный NaOH, газообразный HCl, раствор HI, кристаллы CuSO4 раствор NaNO3 раствор сахара, спиртовый раствор KOH.
Эта работа позволяет актуализировать необходимые знания учащихся для изучения нового материала. После обсуждения результатов работы подчеркиваем, что диссоциация электролитов происходит в воде или при расплавлении, а диссоциация электролитов не происходит в керосине, бензоле и других органических растворителях. Отмечаем, что исследователь не только фиксирует результаты эксперимента, но и дает им объяснение, находит причины наблюдаемых явлений.
Начиная исследование механизма электролитической диссоциации, в процессе беседы с учащимися четко определяем вопросы, позволяющие глубже раскрыть поведение электролитов в растворе, особое внимание при этом обращаю на те из них, которые требует теоретического обоснования экспериментальной проверки. По мере обсуждения нового материала учитель на доске, а учащиеся в тетрадях фиксируют ход исследования в виде схемы 1.
Выяснение механизма электролитической диссоциации
(
1 шаг
Структура урока, включающего исследование частной теоретической проблемы.
далее следует общий
Происходит в воде
Диссоциация электролитов

3.
шаг
2.
шаг
ход исследования)
Не происходит в ацетоне, бензоле




Связь в Н2О ковалентная полярная. Молекулы воды- диполи.
Связь в этих растворителях ковалентная неполярная

И в них возможна диссоциация электролитов

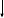
Имеются и другие полярные
растворители


Проверить экспериментально

Вывод из эксперимента
Заполнение её идет постепенно, по мере рассуждений. Например, почему при растворении электролитов в воде диссоциация происходит, а растворенный в бензоле электролит не диссоцирует? На схеме оформляется запись в виде первого шага.
Учащиеся рассуждают, что свойства вещества во многом определяется видом химической связи и что, возможно, различие свойств этих растворителей объясняется характером связи в них. Предлагаем им выяснить тип связи в молекулах воды и бензола, изобразить электронную схему строения молекулы воды. На доске и в тетрадях заполняется второй шаг исследования и формулируется вывод: процесс диссоциации происходит под действием полярных молекул воды.
Затем у учащихся возникает вопрос: не может ли происходить диссоциация в других полярных растворителях? На схеме появляется запись логических рассуждений (3 шаг), высказываются предположения о возможностях экспериментальной проверки поставленного вопроса. При обсуждении результатов опыта учащиеся приходят к выводу, что диссоциация возможна и в других полярных растворителях, например в аммиаке, но отмечают меньшую яркость свечения нити в лампочке прибора. Это наблюдение позволяет поставить частные проблемы при изучении количественной характеристики процесса диссоциации на последующих уроках.
Далее следует общий вывод, что диссоциация происходит при расплавлении электролитов или при их растворении в полярных растворителях. Такой вывод не дает ответа на следующие вопросы:
1. Почему диссоциация происходит именно в полярном растворителе?
2. Почему диссоциирует вещества только с ионной и ковалентной полярной связью?
3. Каков механизм взаимодействия воды и растворенного вещества?
4. Одинаков ли этот механизм для электролитов с различным характером связи?
Мы выделяем эти четыре вопроса среди других и предлагаем рассмотреть механизм диссоциации веществ с ионной связью – NaCl и вещества с ковалентной полярной связью - HCl. Рассматривая процесс перехода ионов в раствор, учащиеся отмечают, что при диссоциации электролитов с ковалентной полярной связью происходит более глубокие изменения. Затем обсуждается вопрос: будут ли ионы переходить в раствор свободными, или они химически связываются с молекулами воды?
Выполняя опыт: растворение СuSO4 в воде, учащиеся отмечают признаки реакции, делают вывод о том, что ионы, перешедшие в раствор, связаны с молекулами воды. Затем совместно с учащимися даем определение понятию «гидратированный ион» и продолжают оформление схемы .
В заключение урока учащиеся самостоятельно формулирует выводы на основании всего проведенного исследования.