МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 39 ПОС. ИМЕНИ ВОРОВСКОГО
Конкурс юный химик
«Вещества домашней аптечки»
Выполнили:
учащиеся 11 класса МБОУ СОШ № 39
Юдаев Евгений
Фадеева Соня
Малахов Александр
Под руководством
Учителя химии Козловской А. Е.
2019 -2020 учебный год
1.Сода
1.1. Питьевая сода - это гидрокарбонат натрия NaHCO3, двууглекислый натрий. В общем случае «сода» представляет собой техническое название натриевых солей угольной кислоты H2CO3. В зависимости от химического состава соединения различается питьевая сода (пищевая сода, бикарбонат натрия, двууглекислый натрий, гидрокарбонат натрия) - NaHCO3, кальцинированная сода (карбонат натрия, безводный углекислый натрий) - Na2CO3 и кристаллическая сода - Na2CO3•10H2O, Na2CO3•7H2O, Na2CO3•H2O. Искусственная пищевая сода (NaHCO3) - белый кристаллический порошок.
С овременные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Серлс в Калифорнии. В России из-за отсутствия крупных месторождений сода из минералов не добывается.
овременные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Серлс в Калифорнии. В России из-за отсутствия крупных месторождений сода из минералов не добывается.
1.2История использования.
Сода была известна человеку примерно за полторы-две тысячи лет до нашей эры, а может быть, и раньше. Ее добывали из содовых озер и извлекали из немногочисленных месторождений в виде минералов. Первые сведения о получении соды путем упаривания воды содовых озер относятся к 64 году нашей эры. Алхимикам всех стран вплоть до 18 века представлялась неким веществом, которое шипело с выделением какого-то газа при действии известных к тому времени кислот - уксусной и серной. Во времена римского врача Диоскорида Педания о составе соды никто не имел понятия. В 1736 году французский химик, врач и ботаник Анри Луи Дюамель де Монсо впервые смог получить из воды содовых озер очень чистую соду. Ему удалось установить, что сода содержит химический элемент «Натр». В России еще во времена Петра Первого соду называли «зодой» или «зудой» и вплоть до 1860 года ее ввозили из-за границы. В 1864 году в России появился первый содовый завод по технологии француза Леблана. Именно благодаря появлению своих заводов сода стала более доступной и начала свой победный путь в качестве химического, кулинарного и даже лекарственного средства.
В промышленности, торговле и в быту под названием сода встречаются несколько продуктов: кальцинированная сода - безводный углекислый натрий Na2СO3, двууглекислая сода - бикарбонат натрия NaНСO3, часто называемая также питьевой содой, кристаллическая сода Na2СO3•10Н2O и Nа2СO3•Н2O и каустическая сода, или едкий натр, NаОН. Обыкновенная сода, в зависимости от способа приготовления, бывает леблановская и аммиачная. Последняя представляет собой более чистый продукт. Кроме того сода бывает либо в виде кальцинированной (безводной, прокаленной), либо кристаллической. Эта сода содержит 10 частей воды.
1.3 Химические свойства.
Реакция с кислотами.
Гидрокарбонат натрия реагирует с кислотами, с образованием соли и угольной кислоты, которая тут же распадается на углекислый газ и воду:
NaHCO3 + HCl → NaCl + H2CO3
H2CO3 → H2O + CO2↑
в кулинарии чаще встречается такая реакция с уксусной кислотой, с образованием ацетата натрия:
NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
Сода хорошо растворяется в воде. Водный раствор питьевой соды имеет слабощелочную реакцию. Шипение соды - результат выделения углекислого газа CO2 в результате химических реакций.
Термическое разложение.
При температуре 60° C гидрокарбонат натрия распадается на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200° C):
2NaHCO3 → Na2CO3 + H2O + CO2↑
При дальнейшем нагревании до 1000° C (например при тушении пожара порошковыми системами) полученный карбонат натрия распадается на углекислый газ и оксид натрия
Na2CO3 → Na2O + CO2.
Физико-химические показатели.
Бикарбонат натрия представляет собой кристаллический порошок белого цвета со средним размером кристал лов 0,05 - 0,20 мм. Молекулярная масса соединения равна 84,01, плотность составляет 2200 кг/м³, насыпная плотность - 0,9 г/с.
Водный раствор бикарбоната натрия имеет слабо выраженный щелочной характер, в связи с чем на животные и растительные ткани он не действует. Растворимость гидрокарбоната натрия в воде невелика и с повышением температуры она несколько повышается
1.4. Применение.
Кулинария.
О сновное применение питьевой соды - кулинария, где она применяется, преимущественно, в качестве основного или дополнительного разрыхлителя при выпечке (так как при нагревании выделяет углекислый газ), изготовлении кондитерских изделий, производстве газированных напитков и искусственных минеральных вод, самостоятельно или в составе комплексных разрыхлителей (например, пекарского порошка, в смеси с карбонатом аммония), например, в бисквитном и песочном тесте. Это связано с легкостью ее разложения при 50-100° С.
сновное применение питьевой соды - кулинария, где она применяется, преимущественно, в качестве основного или дополнительного разрыхлителя при выпечке (так как при нагревании выделяет углекислый газ), изготовлении кондитерских изделий, производстве газированных напитков и искусственных минеральных вод, самостоятельно или в составе комплексных разрыхлителей (например, пекарского порошка, в смеси с карбонатом аммония), например, в бисквитном и песочном тесте. Это связано с легкостью ее разложения при 50-100° С.
Сода - необходимый повседневный помощник на кухне для мытья посуды, тары для косервирования, некоторых плодов и ягод перед сушкой. Она обладает свойством нейтрализовать и убивать запахи.
Ошибочно думать, что сода - специя только для кондитерского дела. Помимо кондитерского производства, сода применяется также для приготовления английских мармеладов, в мясные фарши для блюд молдавской, румынской и узбекской кухни (калийная сода) и при приготовлении напитков. Количества соды, вносимые во все перечисленные изделия, крайне малы - от "на кончике ножа" до щепотки и четверти чайной ложки. В напитках с содой доля ее гораздо выше - по половине и полной чайной ложке на литр жидкости. Для кондитерских и других целей соду кладут по предписанию рецептов, обычно это очень малые дозы. Хранят ее в герметичной таре, берут сухим предметом.
С оду в качестве мизерных добавок к любой пище в процессе приготовления, и именно во время тепловой обработки, добавляют во многих национальных кухнях, учитывая, что это дает в ряде случаев не только неожиданный вкусовой эффект, но и обычно очищает пищевое сырье и все блюдо от различных случайных побочных запахов и привкусов.
оду в качестве мизерных добавок к любой пище в процессе приготовления, и именно во время тепловой обработки, добавляют во многих национальных кухнях, учитывая, что это дает в ряде случаев не только неожиданный вкусовой эффект, но и обычно очищает пищевое сырье и все блюдо от различных случайных побочных запахов и привкусов.
Вообще роль соды на кухне, даже помимо кулинарного процесса, - весьма значительна. Ведь без соды практически невозможна идеальная чистка столовой и кухонной эмалированной, фарфоровой, стеклянной и фаянсовой посуды, а также кухонного инструментария и оборудования от посторонних запахов и различных налетов и патины. Особенно незаменима и необходима сода при чистке чайной посуды - заварочных чайников и чашек от образующегося на их стенках чайного налета, пленки.
Столь же необходимо применение соды при мытье посуды, в которой приготавливалась рыба, чтобы отбить рыбный запах. Обычно поступают следующим образом: стойкий рыбный запах отбивают тем, что протирают посуду луком, а затем уничтожают (смывают) луковый запах, чистя эту посуду содой.
Словом, сода - непременный компонент кухонного производства, и на хорошей кухне без нее нельзя обойтись. Более того, ее отсутствие в арсенале повара или хозяйки немедленно становится заметным, ибо оно связывает того, кто работает у плиты или за разделочным столом, во многих его действиях.
Современные экологические обстоятельства вызвали еще одно новое применение соды на кухне как средства, повышающего качество овощного сырья. Можно, например, рекомендовать обмывать все обработанные, но еще не нарезанные овощи - перед их закладкой в котел или на сковородку - в растворе соды в воде. Или засыпать одной-двумя чайными ложками соды уже очищенный картофель, залитый холодной водой и предназначенный для отваривания или приготовления пюре. Это не только очистит картофель от химикатов, которые использовались при его выращивании, но и сделает сам продукт светлее, чище, красивее, снимет все побочные запахи, приобретенные при транспортировке или неправильном хранении, а также порче. Сам картофель станет после готовности рассыпчатым, вкусным. Таким образом, применение соды до приготовления, при холодной обработке (затем продукт тщательно промывается холодной водой), способно повысить качество овощного пищевого сырья, в частности у крахмалосодержащих овощей, у корнеплодов и листовых культур (капусты, салатов, шпината, петрушки и т. д.).
Сода столь прочно заняла место щелочного агента, что до сих пор ничем не удалось сдвинуть ее с этой позиции. Пищевая сода как разрыхлитель может действовать двояко. Во-первых, она разлагается при нагревании по реакции:
2NaHCO3 (сода) → Na2CO3 (соль) + H2O (вода) + CO2 (углекислый газ).
И в этом случае, если добавить в песочное тесто излишнее количество соды, за небольшое время выпечки она может не успеть термически разложиться без остатка и печенье или кекс получат неприятный «содовый» привкус.
Точно так же, как и поташ, сода реагирует с кислотами, содержащимися в тесте или добавленными туда искусственно:
NaHCO3 (сода) + R-COOH (кислота) → R-COONa (соль) + H2O (вода) + CO2 (углекислый газ)
Медицина.
К ак выглядит сода, прекрасно знают все - это белый порошок, который впитывает воду и отлично в ней растворяется. Но мало кто знает об удивительных целебных свойствах этого «простого» вещества. Между тем, сода - гидрокарбонат натрия - один из главных ингредиентов нашей крови. Результаты исследования влияния соды на организм человека превзошли все ожидания. Оказалось, что сода способна выравнивать кислотно-щелочное равновесие в организме, восстанавливать обмен веществ в клетках, улучшать усвоение кислорода тканями, а также препятствовать потере жизненно необходимого калия. Помогает сода при изжоге, при морской болезни, при простудах, при сердечных заболеваниях и головных болях, при кожных заболеваниях. Как видите, сода - лекарство первой помощи.
ак выглядит сода, прекрасно знают все - это белый порошок, который впитывает воду и отлично в ней растворяется. Но мало кто знает об удивительных целебных свойствах этого «простого» вещества. Между тем, сода - гидрокарбонат натрия - один из главных ингредиентов нашей крови. Результаты исследования влияния соды на организм человека превзошли все ожидания. Оказалось, что сода способна выравнивать кислотно-щелочное равновесие в организме, восстанавливать обмен веществ в клетках, улучшать усвоение кислорода тканями, а также препятствовать потере жизненно необходимого калия. Помогает сода при изжоге, при морской болезни, при простудах, при сердечных заболеваниях и головных болях, при кожных заболеваниях. Как видите, сода - лекарство первой помощи.
Раствор питьевой соды используется в качестве слабого антисептика для полосканий, а также как традиционное кислотонейтрализующее средство от изжоги и болей в желудке (современная медицина не рекомендует применять из-за побочных эффектов, в том числе, из-за «кислотного рикошета») или для устранения ацидоза и т. п.
Пищевая сода применяется для лечения заболеваний, связанных с повышенной кислотностью; раствор питьевой соды применяется для полоскания горла, для промывания кожи при попадании кислот.
Бикарбонат натрия (пищевая сода) может замедлять развитие хронического заболевания почек. Она обладает нейтрализующими качествами, используется в медицинской практике для лечения гастритов с повышенной кислотностью. Способна убивать микробов, используется как дезинфицирующее средство: соду применяют для ингаляций, полосканий, очищения кожи.
Широкое применение сода имеет и в здравоохранении:
Профилактика кариеса, удаление неприятного запаха ног, при укусах насекомых, при цистите, при солнечных ожогах, от боли в горле, от неприятного запаха изо рта.
Содовые примочки значительно улучшают состояние малышей с опрелостями. Они уменьшают зуд и ускоряют заживление кожи.
При простуде полезно делать ингаляцию. Для отхаркивания вязкой мокроты 2 раза в день выпивать натощак по 1/2 стакана теплой воды, в которой растворены 0,5 чайн. ложки соды и щепотка соли. При частых мигренях каждый день принимать раствор кипяченой воды с пищевой содой.
Прочее.
П ри ринитах, стоматитах, ларингитах, конъюнктивитах применяют 0,5-2% раствор соды.
ри ринитах, стоматитах, ларингитах, конъюнктивитах применяют 0,5-2% раствор соды.
Для обеззараживания слизистой оболочки рта полезно полоскать рот некрепким раствором (сода - 85 г, соль - 85 г, мочевина - 2,5 г) после еды.
Средство от курения: полоскать рот раствором пищевой соды (1 столовая ложка на 200 мл воды).
При сухости кожи, сухих дерматитах, ихтиозе и псориазе полезны лечебные ванны (сода - 35 г, карбонат магнезии - 20 г, перборат магния - 15 г). Температура воды должна быть не выше 38-39° С, сначала нужно садиться просто в теплую ванну, потом постепенно увеличивать температуру. Длительность ванны 15 минут.
Пожаротушение.
Гидрокарбонат натрия входит в состав порошка, применяемого в порошковых системах пожаротушения, утилизируя тепло и оттесняя кислород от очага горения выделяемым углекислым газом.
2.Аспирин.

2.1Салициловая (старое название "спираевая") кислота отвечает формуле НОС6Н4СООН; в ее молекуле имеется бензольное кольцо с гидроксильной (ОН) и карбоксильной (СООН) группами.
Полное химическое наименование ацетилсалициловой кислоты следующее
2-ацетокси-бензойная кислота
2.1.История открытия Аспирина.
В древнеегипетских папирусах, датируемых 1534 г. до н.э., среди описания более чем 700 лекарственных и растительных препаратов как важнейшее упоминается растение tjeret или salix, известное сегодня как ива [2]. В античном мире это средство широко использовалось в качестве общетонизирующего. Сотни лет спустя, в 1758 г. в Англии Reverend Edward Stone опубликовал результаты первого клинического исследования по применению коры ивы в качестве эффективного средства лечения больных малярией. Начало XIX века было отмечено значительным прогрессом в области науки и развития технологий. В 1828 г. профессор фармакологии Мюнхенского университета Joseph Buchner рафинировал продукты коры ивы и идентифицировал активное вещество, названное им «салицин». В 1838 г. итальянским химиком Raffaele Piria из салицина была синтезирована салициловая кислота. В начале и середине XIX века салицин и салициловая кислота широко использовались во всей Европе для лечения различных болей, лихорадки и воспалений. Однако в то время препараты салициловой кислоты имели ужасный вкус и плохую переносимость с побочными явлениями со стороны желудочно–кишечного тракта, что побуждало большинство пациентов отказываться от их применения. В 1852 г. Charles Gerchard определил молекулярную структуру салициловой кислоты, заменил гидроксильную группу на ацетильную и впервые синтезировал ацетилсалициловую кислоту (АСК). К сожалению, получившееся соединение было нестойким и не привлекло дальнейшего внимания фармакологов. Более удачливым оказался Herman Kolbe в 1859 г., благодаря которому стало возможным промышленное производство АСК.
В 1897 г. молодой химик Felix Hoffmann из Friderich Bayer & Co разработал устойчивую и более удобную форму АСК, стараясь при этом минимизировать побочные действия лекарства, и в 1899 г. новый препарат был выпущен под торговой маркой Аспирин. В то время и на протяжении еще более чем 50 лет АСК использовалась исключительно как противовоспалительное, жаропонижающее и анальгезирующее средство. Действие АСК на тромбоциты было впервые описано в 1954 г. Bounameaux. В 1967 г. Quiсk обнаружил, что АСК увеличивает время кровотечения. Однако ингибиторный эффект АСК на синтез тромбоксана не был известен до 70–х годов прошлого века. В 1971 г. Vane и соавт. была опубликована работа, удостоенная Нобелевской премии, в которой было описано дозозависимое действие АСК на синтез простагландинов. Нemler и соавт. в 1976 г. была идентифицирована и выделена фармакологическая цель действия Аспирина – фермент циклооксигеназа (ЦОГ).
2.2. Физико-химические свойства
Краткая химическая формула: C9H8O4
Молекулярная масса:180.2
Температура плавления:133 - 138 0С
Константа диссоциации: pKa 3.7
Ацетилсалициловая кислота производится путём нагревания салициловой кислоты с уксусным ангдридом
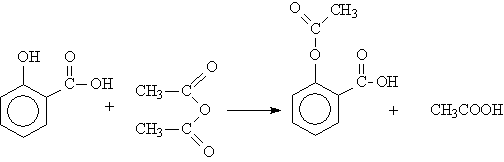
Идентификация
При нагревании с гидроксидом натрия (NaOH) в водном растворе ацетилсалициловая кислота гидролизуется до салицилата натрия и ацетата натрия. При закислении среды салициловая кислота выпадает в осадок и может быть идентифицирована по температуре плавления (156-1600С). Другим методом идентификации салициловой кислоты, образующейся при гидролизе, является окрашивание её раствора в тёмно-фиолетовый цвет при добавлении хлорида железа (FeCl3). Уксусная кислота, присутствующая в фильтрате, превращается при нагревании с этанолом и серной кислотой в этоксиэтанол, который можно легко распознать по его характерному запаху. Кроме того, ацетилсалициловая кислота может быть идентифицирована при помощи различных хроматографических методов.
Ацетилсалициловая кислота кристаллизуется с образованием бесцветных моноклинных многогранников или игл, немного кислых на вкус. Они стабильны в сухом воздухе, однако во влажной среде постепенно гидролизуются до салициловой кислоты и уксусной кислоты (Leeson и Mattocks, 1958; Stempel, 1961). Чистое вещество представляет собой белый кристаллический порошок, почти не обладающий запахом. Запах уксусной кислоты свидетельствует о том, что вещество начало гидролизоваться. Ацетилсалициловая кислота подвергается эстерификации под действием щелочных гидроксидов, щелочных бикарбонатов, а также в кипящей воде.
Ацетилсалициловая кислота плохо растворима в воде, растворима в эфире и хлороформе и легко растворима в 96% этаноле.
Одна часть ацетилсалициловой кислоты растворяется в
300 частях воды
20 частях эфира
17 частях хлороформа
7 частях 96% этанола
Растворимость ацетилсалициловой кислоты в воде и водных средах сильно зависит от уровня рН. При рН=2 её растворимость в воде не превышает 60 мкл/л, однако быстро увеличивается по мере повышения значения рН (увеличение щёлочности) в связи с усиливающейся диссоциацией.
2.3. Использование аспирин.
Аспирин оказывает противовоспалительное, жаропонижающее и болеутоляющее действие, поэтому его широко применяют при лихорадочном состоянии, головной боли, невралгиях и при ревматизме. Он полезен при тромбофлебитах, предупреждает свертывание крови и образование послеоперационных тромбов, снимает приступы стенокардии при ишемической болезни сердца. Более того, считается, что регулярный прием аспирина может снизить риск сердечно-сосудистых нарушений и уменьшает вероятность инфаркта.
Противовоспалительное действие аспирина вызвано уменьшением проницаемости капиллярных сосудов, а жаропонижающее − влиянием на центры терморегуляции организма. Кроме того, аспирин подавляет болевую чувствительность. Другими словами, универсальные лечебные качества и широкое распространение в медицине дают основание назвать аспирин одним из главных лекарств ХХ века.
Аспирин для лица Ацетилсалициловая кислота широко используется в борьбе с акне и для лечения кожи. может Уменьшить покраснение и воспаление можно, добавив аспирин в крем для кожи. Кроме того, зернистая текстура растворенного аспирина также помогает при отшелушивании кожи. Тем не менее, после применения аспирина для лица, нужно обязательно ополоснуть лицо. После того, как смешанный с аспирином крем для лица засохнет, на вашем лице останется слоистый беспорядок.Как использовать аспирин в быту
Аспирин для волос Наиболее распространенными способом лечения болезней волос, в том числе и перхоти, является, конечно, лечебный шампунь. Однако те, кто предпочитают натуральные домашние средства, знают, что добавляя измельченный аспирин в шампунь для волос, можно усилить целебные свойства шампуня. Аспирин содержит салицилаты, а почти все лечебные шампуни содержат в виде активных ингредиентов салициловую кислоту.
Самое распространенное использование аспирина в быту – это бросить таблетку аспирина в воду, налитую в вазу с цветами. В этом случае цветы будут дольше сохранять свою красоту и свежесть.
В продолжение этой темы, с помощью аспирина лечат зараженную грибком низкокислотную почву. Для этого готовится раствор: в 1 литре воды растворяется одна таблетка аспирина. Этим раствором поливается зараженная почва.
Так же с помощью аспирина можно помочь растениям бороться с различными насекомыми и болезнями. Для этого одна таблетка аспирина растворяется в 5 литрах воды и этим раствором поливается растение. После этого происходят положительные изменения в корнях, стеблях и листьях.
Очень хорошо аспирином удаляются пятна от пота или крови. В пол-стакане воды растворяют две таблетки аспирина и в этой жидкости замачиваются на три часа участки одежды с пятнами. Затем с помощью стирального порошка или мыла застирывается всю одежда. Если что-то не вывелось, увеличьте концентрацию аспирина и повторите процедуру, замочив эти участки ещё на час.
Если в автомобиле сел аккумулятор, то можно его реанимировать, если кинуть в каждую «банку» с дистиллированной водой (ячейку аккумуляторной батареи) по таблетке шипучего аспирина или две измельченные обычные таблетки. Пройдет реакция аспирина с электролитом, которая приведет к кратковременному заряду аккумулятора, которого хватит, чтобы завести автомобиль.
Чтобы вымыть узкую цветочную вазу с солевыми, трудно отмываемыми разводами, нужно бросить в воду шипучую таблетку аспирина и через некоторое время промыть вазу проточной водой. Ваза заблестит первозданной чистотой и красотой.
Чтобы убрать налет в унитазе опять те же шипучие таблетки аспирина бросьте в унитаз и через минут семь спустите воду. Унитаз будет чист и без всяких налетов.
И наконец, чтобы пробить образовавшийся засор в раковине, нужно несколько шипучих таблеток аспирина бросить в раковину и залить их уксусной кислотой. Через несколько минут, открыть кран и пустить струю воды. Можно для большего эффекта еще прокачать и вантузом.
3.Перекись водорода
H2O2
Молекула пероксида водорода имеет следующее строение
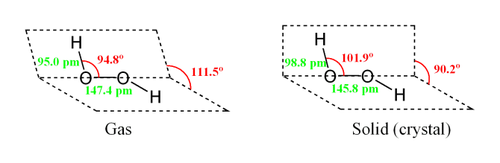
3.1.История открытия перекиси водорода
Перекись водорода имеет свою историю открытия. В 1818 году французский ученый Луис Тенаро получил его в результате реакции пероксида бария (ВаО) и серной кислоты (H2SO4 ). Данное вещество называлось «окисленная вода», которая была в 1,5 раза тяжелее воды, испарялась медленнее, а растворялась в ней в любых пропорциях. Пероксид бария Луис Тенаро получил, нагревая оксид бария в воздухе. Затем французский химик на протяжении нескольких лет изучал полученное вещество, которое ему удалось получить практически в чистом виде с учетом нестабильности перекиси.
В Берлине в 1873 году началось промышленное производство. В начале 20-го века использовалась электрохимическая технология производства H2O2. Данная технология основывалась на электролизе сульфата калия или серной кислоты, однако, срок годности был достаточно маленьким – пару недель. Активно перекись водорода выпускалась концентрацией в 30%, которая использовалась для отбелки тканей и 3% и 6% концентрацией для использования в быту. Объем выпуска H2O2 возрос в 1930-1940-х годах.
Фашистские ученые применяли H2O2 в конструировании жидкостнотопливного ракетного двигателя. Истребитель «Комет» использовали для обороны Германии во время Второй Мировой войны. Истребитель работал за счет реакции перекиси с метанолом, гидразином. Самолет развивал скорость до 965 км/ч. Также пероксид водорода был составляющим компонентом в баллистической ракете. Такие ракеты приводились в действие с наклонной платформы при помощи катапульты поршневой, выталкивающей в воздух благодаря потоку водяных паров, кислорода, которые образовывались в результате реакции 100 кг перекиси и перманганата калия. Для этого использовался пероксид концентрацией в 80%.
Широко применяться перекись водорода стала только спустя сто лет, после ее открытия, после того как Волькенштейн получил H2O2 в чистом и безопасном составе. На сегодняшний день 3% раствор перекиси – это отличный антисептик, хранящийся в каждой домашней аптечке, который можно свободно купить в каждой аптеке.
3.2. Химические свойства Оба атома кислорода находятся в промежуточной степени окисления −1, что и обуславливает способность пероксидов выступать как в роли окислителей, так и восстановителей. Наиболее характерны для них окислительные свойства:


При взаимодействии с сильными окислителями пероксид водорода выступает в роли восстановителя, окисляясь до кислорода:

Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2O2 — неустойчивое соединение, легко разлагается. Так же этому может поспособствовать присутствие ионов переходных металлов. В разбавленных растворах пероксид водорода тоже не устойчив и самопроизвольно диспропорционирует на H2O и O2.Реакция диспропорционирования катализируется ионами переходных металлов, некоторыми белками:
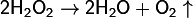
Однако очень чистый пероксид водорода устойчив.
Пероксид водорода проявляет слабые кислотные свойства (К = 1,4·10−12), и поэтому диссоциирует по двум ступеням:

При действии концентрированного раствора Н2O2 на некоторые гидроксиды в ряде случаев можно выделить пероксиды металлов, которые можно рассматривать как соли пероксида водорода (Li2O2, MgO2 и др.):


Пероксид водорода может проявлять как окислительные, так и восстановительные свойства. Например, при взаимодействии с оксидом серебра он является восстановителем:

В реакции с нитритом калия соединение служит окислителем:
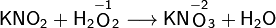
3.3 Применение
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химии, в медицине, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит свое применение в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов. В медицине растворы пероксида водорода применяются как антисептическое средство. При контакте с повреждённой кожей и слизистыми пероксид водорода под влиянием фермента каталазы распадается с выделением кислорода, что способствует сворачиванию крови[и создаёт неблагоприятные условия для развития микроорганизмов. Однако такое действие непродолжительно и обладает слабым эффектом. Тем не менее, пероксид водорода (аптечное название — перекись водорода, 3 %) применяется при первичной обработке ран (в том числе открытых). Перекись водорода очень эффективна для лечения небольших царапин, особенно у детей — она не «щиплет», не имеет запаха, бесцветна. Однако она может вызывать небольшое жжение в районе открытой раны.. В пищевой промышленности растворы пероксида водорода применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией. Кроме того, на предприятиях по производству молочной продукции, соков, растворы перекиси водорода используются для дезинфекции упаковки (технология «Тетра Пак»). Для технических целей пероксид водорода применяют в производстве электронной техники
Перекись водорода применяется также для обесцвечивания волос и отбеливания зубов, однако эффект в обоих случаях основан на окислении, а следовательно, разрушении тканей, и потому такое применение (особенно в отношении зубов) не рекомендуется специалистами
В быту применяется также для выведения пятен MnO2, получившихся при взаимодействии перманганата калия «марганцовки» с предметами (ввиду его окислительных свойств).
3 % перекись водорода в аквариумистике
В практическом аквариумном рыбоводстве перекись водорода приносит свои положительные эффекты и используется в следующих случаях:
Оживление задохнувшейся рыбы
Удушье рыб — добавление раствора в аквариум (10-20 мл. на каждые 100 л. аквариумной воды). Этот метод хорош, когда нет возможности запустить компрессор, а кислород рыбам остро необходим. Процедура проделывается не больше 1-го раза в сутки, и при этом учитывается заселение аквариума: если аквариум перенаселен, то можно слегка увеличить дозировку.
Борьба с нежелательной живностью в аквариуме
Борьба с простейшими и паразитами
Бактериальная инфекция на теле рыбы и ее плавниках
Борьба с сине-зелеными водорослями в аквариуме
Борьба с водорослями на растениях
4. Раствор йода спиртовой 5 %

РАСТВОР ЙОДА СПИРТОВОЙ 5 % (Solutio Iodi spirituosa 5 %). Синонимы: Йодная настойка 5 %, Тinctura iodi 5 %. Водно-спиртовой раствор йода 5 % содержит йода 5 г, калия йодида 2 г, воды и спирта 95 % поровну до 100 мл. Прозрачная жидкость красно-бурого цвета с характерным запахом.
4.1. Йод в живом организме.
Йод – необходимый для животных и человека микроэлемент. В почвах и растениях таёжно-лесной нечерноземной, сухостепной, пустынной и горных биогеохимических зон. Йод содержится в недостаточном количестве или не сбалансирован с некоторыми другими микроэлементами (Са, Mn, Cu); с этим связано распространение в этих зонах эндемического зоба. Среднее содержание Йода в почвах около 3*10-4%, в растениях около 2*10-5%. В поверхностных питьевых водах Йода мало (от 10-7 до 10-9%). В приморских областях количество Йода в 1 м3 воздуха может достигать 50 мкг, в континентальных и горных составляет 1 или даже 0,2 мкг.
Поглощение Йода растениями зависит от содержания в почвах его соединений и от вида растений. Некоторые организмы (так называемые концентраторы Йода, например морские водоросли – фукус, ламинария, филлофора, накапливают до 1% Йода, некоторые губки до 8,5% (в скелетном веществе спонгине). Водоросли, концентрирующие Йод, используются для его промышленного получения. В животный организм Йод поступает с пищей, водой, воздухом. Основной источник Йода растительные продукты и корма. Всасывание Йода происходит в передних отделах тонкого кишечника. В организме человека накапливается от 20 до 50 мг Йода, в том числе в мышцах около 10 – 25 мг, в щитовидной железе в норме 6 – 15 мг. С помощью радиоактивного Йода (I131 и I125) показано, что в щитовидной железе Йод накапливается в митохондриях эпителиальных клеток и входит в состав образующихся в них алл - и моноиодтирозинов, которые конденсируются в гормон тетраиодтиронин (тироксин). Выделяется Йод из организма преимущественно через почки (до 70 – 80% ), молочные, слюнные и потовые железы, частично с жёлчью.
Химические свойства Йода.
Химически Йод довольно активен, хотя и в меньшей степени, чем хлор и бром. С металлами Йод при легком нагревании энергично взаимодействует, образуя Йодиды.
Hg + I2 = HgI2
С водородом Йод реагирует только при нагревании и не полностью, образуя йодистый водород.
I2 + H2 = 2НI
Элементный Йод - окислитель, менее сильный, чем хлор и бром. Сероводород H2S, тиосульфат натрия Na2S2O3 и другие восстановители восстанавливают его до I- .
I2 + H2S = S + 2НI
Хлор и другие сильные окислители в водных растворах переводят его в IO3-.
При растворении в воде Йода частично реагирует с ней;
I2 + H2O = HI + HIO
В горячих водных растворах щелочей образуются Йодид и Йодат.
I2 + 2KOH = KI + KIO + H2O
3KIO = 2KI + KIO3
При нагревании йод взаимодействует с фосфором:
3I2 + 2P = 2PI3
При взаимодействии H2SO4 и KI образуется продукт, окрашенный темно-бурый цвет, и сульфатная кислота восстанавливается до H2S
8KI + 9H2SO4 = 4I2 + 8KHSO4 + SO2 + H2O
Йод легко реагирует с алюминием, причем катализатором в этой реакции является вода: 3I2 + 2AL = 2ALI3
Йод может также окислять сернистую кислоту и сероводород:
H2SO3 + I2 + H2O = H2SO4 + HI
H2S + I2 = 2HI + S
Йод взаимодействует с нитратной кислотой:
I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2O
При соединении кислоты с щелочью образуется соль:
HIO3 + KOH = KIO3 + H2O
При окислении йодид-иона йодат-ионом в кислой среде образуется свободный йод:
5KI + KIO3 + 3H2SO4 = 3I2 + 3K2SO4 + 3H2O
Йод хорошо взаимодействует с серноватистокислым натрием (тиосульфатом):
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
4.3. Йод в медицине.
Антисептические свойства Йода в хирургии первым использовал врач Буанэ. Как ни странно, самые простые лекарственные формы Йода – водные и спиртовые растворы очень долго не находили применения в хирургии, хотя ещё в 1865 – 1866 гг. великий русский хирург Н.И.Пирогов применял Йодную настойку при лечении ран.
Препараты, содержащие Йод, обладают антибактериальными и противогрибковыми свойствами, они оказывают также противовоспалительное и отвлекающее действие; их применяют наружно для обеззараживания ран, подготовки операционного поля. При приеме внутрь препараты Йода оказывают влияние на обмен веществ, усиливают функцию щитовидной железы. Малые дозы Йода (микроЙод) тормозят функцию щитовидной железы, действуя на образование тиреотропного гормона передних долей гипофиза. Поскольку Йод влияет на белковый и жировой (липидный) обмен, он нашел применение при лечении атеросклероза, так как снижает содержание холестерина в крови; повышает также фибринолитическую активность крови.
Для диагностических целей используют рентгеноконтрастные вещества, содержащие Йод. При длительном применении препаратов Йода и при повышенной чувствительности к ним возможно появление Йодизма – насморк, крапивница, отек квинке, слезотечение, угревидная сыпь (Йододерма). Препараты Йода нельзя принимать при туберкулезе легких, беременности, при заболеваниях почек, хронической пЙодермии, геморрагических диатезах, крапивнице.
Йод - уникальное лекарственное вещество. Он определяет высокую биологическую активность и разностороннее действие лекарственных препаратов, и используют его в основном для изготовления различных лекарственных форм.
Элементарный йод оказывает противомикробное и противогрибковое (фунгицидное) действие, его растворы широко применяют для обработки ран, подготовки операционного поля и т. п. Они обладают противовоспалительными и отвлекающими свойствами, при нанесении на кожу и слизистые оболочки оказывают раздражающее действие и могут вызвать рефлекторные изменения в деятельности организма.
Препараты йода блокируют накопление радиоактивного йода в щитовидной железе и способствуют его выведению из организма, тем самым снижают лучевую дозу и ослабляют радиационное воздействие.
При приеме внутрь препараты йода оказывают влияние на обмен веществ, усиливают функцию щитовидной железы. Малые дозы йода тормозят функцию щитовидной железы, угнетая образование ширеотропного гормона передней доли гипофиза. Данное свойство используют при лечении больных с заболеваниями щитовидной железы.
Установлено также, что йод влияет на обмен жиров и белков. При применении йодных препаратов наблюдается снижение уровня холестерина в крови и уменьшение ее свертываемости.
Рефлекторным повышением выделения слизи железами дыхательных путей и протеолитическим действием (расщеплением белков) объясняется применение препаратов йода в качестве отхаркивающих и муколитических (разжижающих мокроту) средств.
Для диагностических целей используют рентгенконтрастные вещества, содержащие йод.
Искусственно полученные радиоактивные изотопы йода 1-123, 1-125, 1-131 используются для определения функционального состояния щитовидной железы и лечения ряда ее заболеваний. Применение радиоактивного йода в диагностике связано со способностью йода избирательно накапливаться в щитовидной железе; использование в лечебных целях основано на способности излучения радиоизотопов йода разрушать клетки железы, вырабатывающие гормоны.
5.Активированный угль

5.1АКТИВНЫЙ УГОЛЬ (активированный уголь), материал с развитой пористой структурой. На 87-97% (по массе) состоит из С, содержит также Н, О и в-ва, введенные в активный уголь при его получении. Зольность активного угля может составлять 1 -15% (иногда его обеззоливают до 0,1-0,2%). Поры в активном угле классифицируют по их линейным размерам х Для адсорбции в микропорах (уд. объем 0,2-0,6 см3/г), соизмеримых по размерам с адсорбируемыми молекулами, характерен гл. обр. механизм объемного заполнения. Аналогично происходит адсорбция также в супермикропорах (уд. объем 0,15-0,2 см3/г)-промежут. области между микропорами и мезопорами. В этой области св-ва микропор постепенно вырождаются, св-ва мезопор проявляются.
Механизм адсорбции в мезопорах заключается в последоват. образовании адсорбц. слоев (поли молекулярная адсорбцияХ к-рое завершается заполнением пор по механизму капиллярной конденсации. У обычных активных углей уд. объем мезопор составляет 0,02-0,10 см3/г, уд. пов-сть-от 20 до 70 м2/г; однако у нек-рых активных углей (напр., осветляющих) эти показатели могут достигать соотв. 0,7 см3/г и 200-450 м2/г.
Макропоры (уд. объем и пов-сть соотв. 0,2-0,8 см3/г и 0,5-2,0 Mi/r)служат транспортными каналами, подводящими молекулы поглощаемых в-в к адсорбц. пространству зерен (гранул) активного угля. Для придания активному углю каталитич. св-в в макро- и мезопоры вносят, как правило, спец. добавки.
В активном угле часто существуют все разновидности пор, и дифференциальная кривая распределения их объема по размерам имеет 2-3 максимума. В зависимости от степени развития супермикропор различают активные угли с узким распределением (эти поры практически отсутствуют) и широким (существенно развиты).
5.2. История применения.
Наиболее раннее из исторических упоминаний об использовании углей, относится к Древней Индии, где в санскритских писаниях говорилось, что питьевую воду необходимо предварительно пропускать через уголь, выдерживать в медных сосудах и подвергать действию солнечных лучей. Уникальные и полезные свойства углей были известны также и в Древнем Египте, где древесный уголь использовали в медицинских целях уже за 1500 лет до н. э. Древние римляне также пользовались углем для очистки питьевой воды, пива и вина. В 1773 г. химик из Штральзунда, Карл Шееле сообщал об адсорбции газов на древесном угле. Через несколько лет, в 1785 г., Ловиц установил, что древесный уголь может обесцвечивать определенные жидкости. Это открытие привело к первому промышленному применению древесного угля на английском сахаро-рафинадном заводе в 1794 г. После установления блокады на континенте в 1808 г. один из французских заводов также использовал древесный уголь для осветления сахарных сиропов.
В 1811 г. во время опытов с приготовлением черного сапожного крема Фитье заметил обесцвечивающую способность костяного угля. Благодаря опубликованию этого открытия костяной уголь нашел впоследствии широкое применение в сахарной промышленности. Поскольку костяной уголь можно реактивировать прокаливанием, производство на основе древесного угля не получило дальнейшего развития. Тем не менее, в 1850 г. была предпринята попытка приготовить обесцвечивающие угли обработкой древесных опилок карбонатом магния и торфа водяным паром, однако эти продукты не выдерживали конкуренции с костяным углем. Кровяной уголь сильного осветляющего действия, открытый де Бюсси в 1828 г., также не изменил этого положения.
Только появление двух патентов Осгрейко в 1900—1901гг, открыло путь современной технологии производства активных углей. Предмет изобретения одного патента составляло нагревание растительного материала с хлоридами металлов, а во втором [3] описано активирование древесного угля диоксидом углерода и водяным паром при нагревании до слабо-красного каления.
В 1909 г. на химических заводах в Ратиборе (Силезия) по патенту Острейко была выпущена первая промышленная партия порошкового угля эпонит. В 1911 г. за ним последовали норит и пурит торфяные угли, активированные водяным паром. Химическое активирование древесных опилок хлоридом цинка впервые осуществили на Австрийском объединении химической и металлургической продукции в Ауссиге (в 1914 г.) и на фабриках красителей Байера (в 1915 г.) для производства карборафина. Эти порошковые угли использовались в основном в качестве осветляющих в химической и сахарной промышленности. Во время первой мировой войны был впервые применен активный уголь из скорлупы кокосового ореха в качестве адсорбента в противогазных масках. Благодаря этому опыту и разработке в середине 30-х годов технологии производства гранулированных углей типа суперсорбон и бензосорбон активные угли нашли применение в адсорбции газов и паров. Возможность извлечения бензола из светильного газа и другие рекуперационные процессы сыграли решающую роль в расширении областей применения активных углей. В настоящее время мировое производство активного угля составляет примерно 300 тыс. т/год (1977 г.), из которых примерно треть выпускается в Северной Америке и Европе.
5.3. Производство

Исходным сырьем для парогазового активирования служат обычно карбонизованные природные материалы: древесный уголь, торфяной кокс, уголь из скорлупы кокосового ореха, материалы типа каменного угля или кокса из бурого угля. Важнейшим фактором, определяющим способность этих продуктов к активированию, является доля летучих компонентов. Если она очень мала, то активирование трудноосуществимо или вообще невозможно. Примером этого служит графит. С увеличением содержания летучих можно в первом приближении говорить о пропорциональном повышении реактивности. Однако, если реактивность слишком велика, например, во вспучивающихся и спекающихся каменных углях, то возможно снижение степени активирования. Реактивность исходного материала в значительной степени связана с присутствием макропор.
Для активирования газами обычно используется кислород (воздух), водяной пар и диоксид углерода. Активирование воздухом имеет избирательный характер, однако существует опасность внешнего обгара гранул. Поэтому предпочтение отдается водяному пару и диоксиду углерода. Для достаточно высокой с технической точки зрения скорости реакции при использовании этих газов необходимы температуры 800—1000 °С. Поэтому для ведения процесса необходимо специальное оборудование: шахтные, вращающиеся, многополочные печи, реакторы с движущимися слоями и различные другие аппараты. Выбор подходящего оборудования зависит от степени дробления исходного материала и от того, в какой форме должны быть получены угли порошкообразные, зерненые или формованное. Универсальными являются вращающиеся печи, поэтому они применяются особенно часто.
При активировании углеродсодержащего материала происходит значительное уменьшение массы твердого вещества. В оптимальных условиях это эквивалентно увеличению пористости. Отсюда в первом приближении можно простым весовым способом оценить увеличение активности угля. Удобным методом в этом случае является определение насыпной плотности.
Важными факторами, позволяющими сделать правильный выбор активных углей для определенных целей, являются гранулометрический состав, площадь внутренней поверхности, распределение пор по размерам, природа и содержание примесей. По внешнему виду различают порошковые угли, которые используются преимущественно для обесцвечивания, и зерненые угли с неправильной формой зерен, а также формованные угли, которые в большинстве случаев состоят из цилиндрических гранул.
Важное значение для активности угля имеют микропоры; диаметры этих пор соизмеримы с размерами адсорбирующихся молекул. Микропоры обеспечивают развитие основной части внутренней поверхности активного угля. Кроме них в угле присутствуют переходные поры с диаметрами 2—50 нм и более крупные макропоры.
5.4. ИСПОЛЬЗОВАНИЕ АКТИВИРОВАННОГО УГЛЯ
Медицинские угли для лечения заболеваний желудочно-кишечного тракта. Уже около 1550 г. до н.э. в старом египетском папирусе упоминалось о применении древесного угля в медицине. Гиппократ (400 г. до н.э.) и Плиний Старший сообщали о применении этого адсорбента.
До настоящего времени медицинский активный уголь используется в форме гранул или таблеток, поэтому его передозировка невозможна даже при применении без консультации врача. Обычно активный уголь рекомендуется при инфекционных заболеваниях желудочно-кишечного тракта. Эффективность этого препарата основана на адсорбции вредных веществ, т. е. токсинов, выделяемых бактериями при обмене веществ или образующихся в воспалительном процессе желудочно-кишечного тракта. Такое адсорбционное действие точно установлено in vitro с помощью стандартных реактивов — метиленового голубого, стрихнина или сулемы. Опыты по оценке эффективности препарата, содержащего активный уголь, описаны в некоторых фармакопеях. Однако существуют различные взгляды и опытные данные, доказывающие возможность прямой адсорбции бактерий. Например, Шмидт показал, что из разбавленной культуры бактерий в течение 10 мин может адсорбироваться около 100 % микробов. Приведенные ниже данные иллюстрируют уменьшение числа бактерий при адсорбции на порошковом медицинском угле:
Известно, что в угольных шахтах практически не встречается людей со злокачественными поражениями кожи и происходит довольно быстрое заживление ран. Это наблюдение послужило основанием для успешного применения активного угля в лечении ран от ожогов и обморожения во время второй мировой войны. После войны от таких методов лечения отказались в пользу медикаментозной обработки ран, при этом наряду с соображениями безопасности сыграли роль субъективные причины, связанные с необходимостью ежедневной обработки ран углем.
Научный интерес к активному углю возрос в последнее время, когда было замечено, что определенные продукты обмена, накапливаемые в организме при работе искусственных почек, можно связывать адсорбцией, принимая внутрь несколько граммов угля, а затем выводить из организма. Особенно эффективно снижается таким способом содержание холестерина и триглицерида.
Прием внутрь порошкового медицинского угля неудобен, поэтому его обычно применяют в форме гранул или таблеток. Для их получения используется связующее, которое теряет свои вяжущие свойства в желудочно-кишечном тракте, тогда как порошковый уголь сохраняет почти исходную активность.
Абсорбирующие свойства активированного угля позволяют широко использовать его в промышленности и в быту для очистки, сепарации, фильтрации и дезодорации различных веществ. Активированный уголь используют как наполнитель фильтров для воды и фильтров для очищения воздуха. Его применяют в походах, если поблизости нет чистой питьевой воды. При производстве водки высокого качества спирт пропускают через мощные угольные фильтры. Активированным углем очищают медицинский спирт, который применяется для изготовления различных настоек и лекарств.
Активированный уголь можно использовать, чтобы избавиться от запаха в холодильнике. Для этого несколько растолченных таблеток угля надо высыпать в в пластмассовую баночку с отверстиями в крышке и держать в холодильнике постоянно. Если активированный уголь положить в горшок с комнатными растениями, то их очистительные свойства усилятся.
Первые уроки рисования
С помощью активированного угля можно учить рисовать малышей. Активированный уголь прекрасно рисует на обычной белой бумаге. Еще его можно растолочь и сделать различные оттенки серого. Если в разведенный водой порошок активированного угля добавить капельку йода или зеленки, то палитра художника существенно обогатится.
Отбеливание зубов активированным углем
О  тбеливание зубов углем является традиционным бабушкиным способом. В давние времена вместо активированного угля применяли угольки из печки, хорошенько натирали ими зубы, затем полоскали родниковой водой до полного вымывания черного налета. Для отбеливания зубов разотрите в порошок таблетку активированного угля, капните несколько капель воды и размешайте, чтобы получилась однородная кашица без комочков, которые могут повредить зубную эмаль. Для процедуры очистки используйте недорогую зубную щетку, ведь потом ее нужно будет заменить. Чистите зубы, как обычно, затем, прополоскав рот, повторите процедуру очищения зубов дважды, тщательно выполаскивая остатки активированного угля из межзубного пространства. Результат будет заметен после третьей процедуры отбеливания. Проводить эту процедуру рекомендуется не чаще одного раза в 10 дней.
тбеливание зубов углем является традиционным бабушкиным способом. В давние времена вместо активированного угля применяли угольки из печки, хорошенько натирали ими зубы, затем полоскали родниковой водой до полного вымывания черного налета. Для отбеливания зубов разотрите в порошок таблетку активированного угля, капните несколько капель воды и размешайте, чтобы получилась однородная кашица без комочков, которые могут повредить зубную эмаль. Для процедуры очистки используйте недорогую зубную щетку, ведь потом ее нужно будет заменить. Чистите зубы, как обычно, затем, прополоскав рот, повторите процедуру очищения зубов дважды, тщательно выполаскивая остатки активированного угля из межзубного пространства. Результат будет заметен после третьей процедуры отбеливания. Проводить эту процедуру рекомендуется не чаще одного раза в 10 дней.
Косметические маски для лица с активированным углем
Косметические маски для лица с активированным углем следует делать для очищения и сужения пор, для избавления от «черных точек» и других проблем кожи.
Активированный уголь полезен и животным
Многие ветеринары рекомендуют время от времени проводить курсы очищения организма своим домашним питомцам. Для этого достаточно давать кошке или собаке по утрам одну таблетку активированного угля. Оказывается, активированный уголь может существенно повысить показатели в птицеводстве. Согласно результатам исследований, проведенных российскими учеными, добавление активированного угля в комбикорм для кур улучшает сохранность молодняка на 20%. Кроме того, мясо птиц, получавших активированный уголь в количестве от 2% до 5% от объема комбикорма, выше по качеству.
Содержание
1.Сода………………………………………………………………………….…………………1 1.2. История использования ……………………………………………………………………1
1.3 Химические свойства………………………………………………………………………..1
1.4. Применение………………………………………………………………………………….2
2.Аспирин…………………………………………………..........................................................5
2.1.История открытия Аспирина………………………………………………………………..6
2.2. Физико-химические свойства………………………………………………………………6
2.3. Использование аспирин…………………………………………………………….………7
3.Перекись водорода………………………………………………………………..………….8
3.1.История открытия перекиси водорода…………………………………………………..…8
3.2. Химические свойства……………………………………………………………………….9 3.3 Применение…………………………………………………………………...…………….10
4. Раствор йода спиртовой 5 %................................................................................................11
4.1. Йод в живом организме……………………………………………………………………11
4.2. Химические свойства Йода………………………………………………………………..11
4.3. Йод в медицине…………………………………………………………………………….12
5.Активированный угль………………………………………………………………...……13
5.1Физико-химические свойства………………………………………………………………13
5.2. История применения………………………………………………………………….…..14
5.3. Производство………………………………………………………………………………15
5.4. Использование активированного угля……………………………………………………16
Список литературы и интернет – ресурсов
Ивашиченко Л.И., Глущенко В.Ю., Адсорбция и адсорбенты, 1974г.
http://www.xumuk.ru/
http://schoolchemistry..ru/
http://www.xliby.ru
23






 овременные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Серлс в Калифорнии. В России из-за отсутствия крупных месторождений сода из минералов не добывается.
овременные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Серлс в Калифорнии. В России из-за отсутствия крупных месторождений сода из минералов не добывается. сновное применение питьевой соды - кулинария, где она применяется, преимущественно, в качестве основного или дополнительного разрыхлителя при выпечке (так как при нагревании выделяет углекислый газ), изготовлении кондитерских изделий, производстве газированных напитков и искусственных минеральных вод, самостоятельно или в составе комплексных разрыхлителей (например, пекарского порошка, в смеси с карбонатом аммония), например, в бисквитном и песочном тесте. Это связано с легкостью ее разложения при 50-100° С.
сновное применение питьевой соды - кулинария, где она применяется, преимущественно, в качестве основного или дополнительного разрыхлителя при выпечке (так как при нагревании выделяет углекислый газ), изготовлении кондитерских изделий, производстве газированных напитков и искусственных минеральных вод, самостоятельно или в составе комплексных разрыхлителей (например, пекарского порошка, в смеси с карбонатом аммония), например, в бисквитном и песочном тесте. Это связано с легкостью ее разложения при 50-100° С. оду в качестве мизерных добавок к любой пище в процессе приготовления, и именно во время тепловой обработки, добавляют во многих национальных кухнях, учитывая, что это дает в ряде случаев не только неожиданный вкусовой эффект, но и обычно очищает пищевое сырье и все блюдо от различных случайных побочных запахов и привкусов.
оду в качестве мизерных добавок к любой пище в процессе приготовления, и именно во время тепловой обработки, добавляют во многих национальных кухнях, учитывая, что это дает в ряде случаев не только неожиданный вкусовой эффект, но и обычно очищает пищевое сырье и все блюдо от различных случайных побочных запахов и привкусов. ак выглядит сода, прекрасно знают все - это белый порошок, который впитывает воду и отлично в ней растворяется. Но мало кто знает об удивительных целебных свойствах этого «простого» вещества. Между тем, сода - гидрокарбонат натрия - один из главных ингредиентов нашей крови. Результаты исследования влияния соды на организм человека превзошли все ожидания. Оказалось, что сода способна выравнивать кислотно-щелочное равновесие в организме, восстанавливать обмен веществ в клетках, улучшать усвоение кислорода тканями, а также препятствовать потере жизненно необходимого калия. Помогает сода при изжоге, при морской болезни, при простудах, при сердечных заболеваниях и головных болях, при кожных заболеваниях. Как видите, сода - лекарство первой помощи.
ак выглядит сода, прекрасно знают все - это белый порошок, который впитывает воду и отлично в ней растворяется. Но мало кто знает об удивительных целебных свойствах этого «простого» вещества. Между тем, сода - гидрокарбонат натрия - один из главных ингредиентов нашей крови. Результаты исследования влияния соды на организм человека превзошли все ожидания. Оказалось, что сода способна выравнивать кислотно-щелочное равновесие в организме, восстанавливать обмен веществ в клетках, улучшать усвоение кислорода тканями, а также препятствовать потере жизненно необходимого калия. Помогает сода при изжоге, при морской болезни, при простудах, при сердечных заболеваниях и головных болях, при кожных заболеваниях. Как видите, сода - лекарство первой помощи. ри ринитах, стоматитах, ларингитах, конъюнктивитах применяют 0,5-2% раствор соды.
ри ринитах, стоматитах, ларингитах, конъюнктивитах применяют 0,5-2% раствор соды.






 тбеливание зубов углем является традиционным бабушкиным способом. В давние времена вместо активированного угля применяли угольки из печки, хорошенько натирали ими зубы, затем полоскали родниковой водой до полного вымывания черного налета. Для отбеливания зубов разотрите в порошок таблетку активированного угля, капните несколько капель воды и размешайте, чтобы получилась однородная кашица без комочков, которые могут повредить зубную эмаль. Для процедуры очистки используйте недорогую зубную щетку, ведь потом ее нужно будет заменить. Чистите зубы, как обычно, затем, прополоскав рот, повторите процедуру очищения зубов дважды, тщательно выполаскивая остатки активированного угля из межзубного пространства. Результат будет заметен после третьей процедуры отбеливания. Проводить эту процедуру рекомендуется не чаще одного раза в 10 дней.
тбеливание зубов углем является традиционным бабушкиным способом. В давние времена вместо активированного угля применяли угольки из печки, хорошенько натирали ими зубы, затем полоскали родниковой водой до полного вымывания черного налета. Для отбеливания зубов разотрите в порошок таблетку активированного угля, капните несколько капель воды и размешайте, чтобы получилась однородная кашица без комочков, которые могут повредить зубную эмаль. Для процедуры очистки используйте недорогую зубную щетку, ведь потом ее нужно будет заменить. Чистите зубы, как обычно, затем, прополоскав рот, повторите процедуру очищения зубов дважды, тщательно выполаскивая остатки активированного угля из межзубного пространства. Результат будет заметен после третьей процедуры отбеливания. Проводить эту процедуру рекомендуется не чаще одного раза в 10 дней.

















