
ЕГЭ по химии задание 1

План
- Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы.
- Электронная конфигурация атомов и ионов. Основное и возбужденное состояние атомов

Главное квантовое число и энергетический уровень
Квантовые числа — это своеобразный код записи положения электрона в атоме. Если сравнить атом с домом, то квантовые числа – это адрес электрона: этаж, квартира, комната.
Электроны в атоме сосредоточены на энергетических уровнях – «этажах». Их нумеруют числами 1, 2, 3, … или буквами K, L, M, N, O, P, Q. Главное квантовое число n – это и есть номер энергетического уровня.

С удалением от ядра число электронов возрастает. Чем выше энергетический уровень, тем больше электронов на нём находится. Их максимальное число для каждого уровня определяется по формуле:
N = 2n 2
N – максимальное число электронов
n – номер уровня (главное квантовое число)
На внешнем энергетическом уровне не может находиться больше 8 электронов.
В энергетических уровнях также выделяют подуровни. Их количество также соответствует главному квантовому числу. Это напоминает расположение квартир в доме: на первом этаже располагается одна квартира, на втором – две, на третьем – три и т.д.
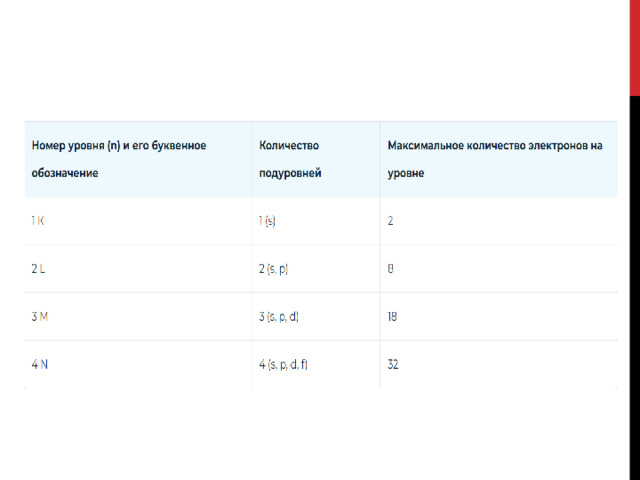
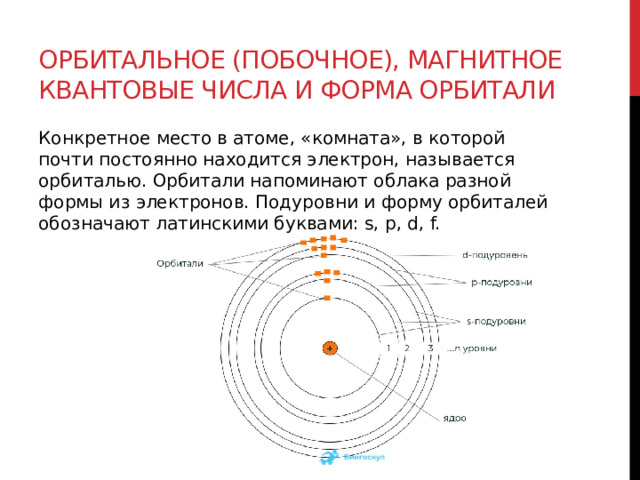
Орбитальное (побочное), магнитное квантовые числа и форма орбитали
Конкретное место в атоме, «комната», в которой почти постоянно находится электрон, называется орбиталью. Орбитали напоминают облака разной формы из электронов. Подуровни и форму орбиталей обозначают латинскими буквами: s, p, d, f.
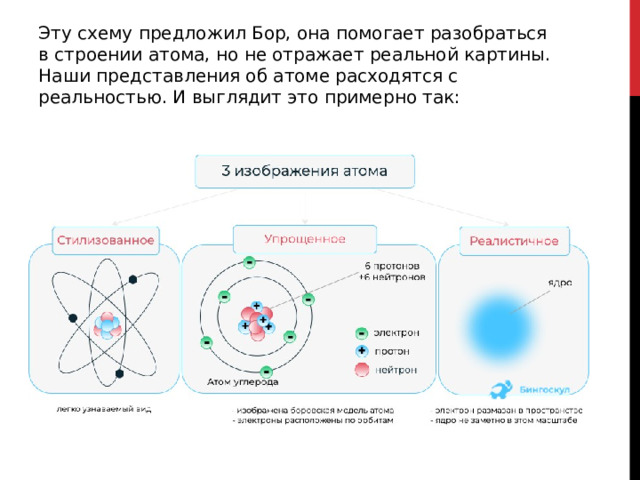
Эту схему предложил Бор, она помогает разобраться в строении атома, но не отражает реальной картины. Наши представления об атоме расходятся с реальностью. И выглядит это примерно так:

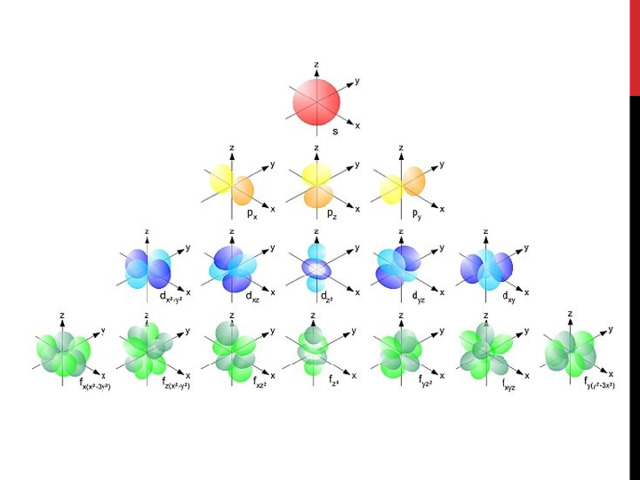
Магнитное квантовое число ml показывает, какие проекции есть у орбитали. Количество таких вариантов определяется по формуле 2l+1.
Для s-орбитали l = 0 и ml = 0, так и получается, что сфера принимает только одно положение в пространстве.
Для p-орбитали l = 1, ml принимает три значения -l, 0, +l. При l = 3, магнитный момент принимает семь (2l + 1 = 7) значений: -3, -2, -1, 0, +1, +2, +3.

Спин электрона
Еще два квантовых числа – спиновое и проекция спина – характеризуют уникальное квантовое свойство электрона. Спин не имеет аналогов в классической механике. Можно представить, что электрон вращается вокруг своей оси в одну или другую сторону.

В атомах первого периода таблицы Менделеева есть один энергетический уровень. В нём один или два электрона движутся по s-единственной орбитали.
В атомах второго периода появляется второй уровень. Он состоит из s-и p-подуровней. Второй s-подуровень – это тоже s-орбиталь, на p-подуровне есть три орбитали, которые по-разному расположены в пространстве. Каждая p-орбиталь вмещает 1 или 2 электрона, поэтому максимально на p-подуровне их может быть 6.
В атомах третьего периода появляется d-подуровень с пятью d-орбиталями, в атомах четвёртого периода – f-подуровень с семью f-орбиталями.

Как заполняются орбитали?
Принцип минимума энергии . Электрон «стремится» занять положени в атоме с наименьшей энергией. То есть электроны сначала «заселяют» низкоэнергетические орбитали. Рейтинг желаемых орбиталей выглядит так: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5р 6 6s 2 5d 1 4f 14 ... Как будто электроны сначала выбирают малозаселённые этажи с небольшим количеством квартир. Принцип Паули . В атоме не может быть двух электронов с одинаковыми свойствами. То есть на каждой орбитали может находиться либо один неспаренный электрон, либо два электрона с разными спинами. Это похоже на дорогу с двусторонним движением: либо едет один автомобиль, либо два, но навстречу друг другу. Правило Хунда . Наиболее устойчивое (основное) состояние атома достигается тогда, когда на одном уровне находится как можно больше неспаренных электронов. Можно провести такую аналогию: электроны сначала селятся по одному, а потом ищут себе пару.

Электронная конфигурация атомов и ионов. Основное и возбужденное состояние атомов

Электронная конфигурация атомов
Запись по электронным оболочкам (схема электронного строения)
Показывает заряд ядра и количество электронов на каждом энергетическом уровне.
Легче всего начинать с неё, потому что она показывает структуру атома «крупным планом».

Запись с обозначением энергетических уровней и подуровней
Каждая орбиталь обозначается квадратной ячейкой. Электрон обозначается стрелкой. Различное направление стрелок указывает на противоположные спины.Под ячейкой подписывают номер энергетического уровня, буквенное обозначение орбитали и количество электронов на ней.
Буквенно-числовое обозначение такого «адреса» электрона – это электронная формула . Электронная конфигурация – это электронная формула, которая показывает распределение электронов по энергетическим уровням.
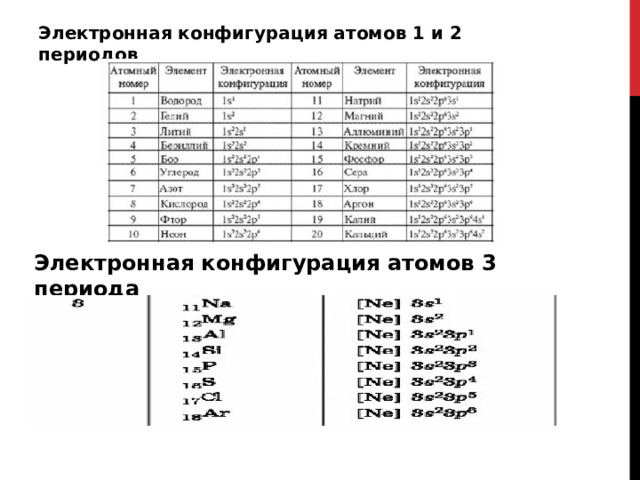
Электронная конфигурация атомов 1 и 2 периодов
Электронная конфигурация атомов 3 периода

Электронная конфигурация атомов 4 периода
Заполнение орбиталей атомов 4 периода имеет свои особенности.
На движение электрона влияют поле ядра и поле других электронов. Поэтому в атомах с большим количеством электронов энергия электрона определяется главным и орбитальным квантовыми числами.
Здесь уже надо смотреть на сумму обоих квантовых чисел (n+l). Если для двух подуровней эта сумма равна: 3d, 4p, 5s (n+l=5), то сначала заполняются уровни с меньшими значениями n. То есть последовательность заполнения будет следующей: 3d – 4p – 5s.
Поэтому в 4 периоде сначала заполняется подуровень 4s, а потом подуровень 3d.
Есть ещё одна особенность, которая появляется в 4 периоде. Хром и медь имеют на 4s-орбитали по одному электрону. Всё дело в заполнении d-оболочек. Полузаполненные или заполненные d-оболочки устойчивее частично заполненных. В атоме хрома на каждой из 5 3d-орбиталей есть по одному электрону. В атоме меди на каждой на каждой 3d-орбитали есть по два электрона.

Алгоритм записи электронной конфигурации атома
- По порядковому номеру химического элемента в таблице Менделеева определяем количество электронов в атоме.
- Распределяем электроны по энергетическим уровням, то есть составляем схему электронного строения.
- Выписываем s-, p-, d-подуровни в каждом энергетическом уровне.
- Заполняем подуровни электронами: сначала по одному электрону на орбиталь, потом достраиваем электронные пары.
Электронная конфигурация ионов
Электронная конфигурация ионов составляется по тем же принципам. Нужно учитывать изменения количества электронов на внешнем энергетическом уровне.
Атом электронейтрален, то есть сколько протонов ядре, столько же электронов в атоме. Если атом принимает электроны, он становится отрицательно заряженным ионом (анионом), если отдаёт электроны – положительно заряженным ионом (катионом).
Атому легче всего отдать электроны внешнего энергетического уровня, «чужие» электроны он тоже примет на внешний энергетический уровень. На внешнем энергетическом уровне не может находиться более 8 электронов. Теория «октета» была предложена в 1916 году Гилбертом Ньютоном Льюисом и Вальтером Косселем
Атом «стремится» добрать электроны на внешний уровень или избавиться от них, поэтому и становится ионом. Полное заполнение s- и p-подуровней внешнего уровня придаёт атому стабильность. Только атом гелия имеет на единственном внешнем энергетическом уровне 2 электрона, а не 8, потому что первый энергетический уровень состоит только из одной s-орбитали.
Запись по электронным оболочкам (схема электронного строения)
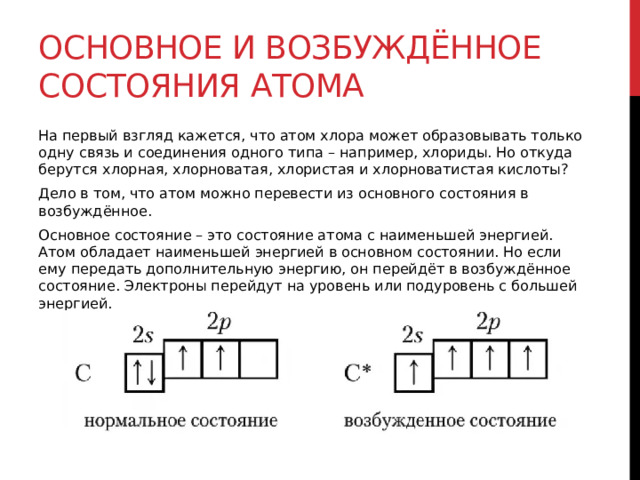
Основное и возбуждённое состояния атома
На первый взгляд кажется, что атом хлора может образовывать только одну связь и соединения одного типа – например, хлориды. Но откуда берутся хлорная, хлорноватая, хлористая и хлорноватистая кислоты?
Дело в том, что атом можно перевести из основного состояния в возбуждённое.
Основное состояние – это состояние атома с наименьшей энергией. Атом обладает наименьшей энергией в основном состоянии. Но если ему передать дополнительную энергию, он перейдёт в возбуждённое состояние. Электроны перейдут на уровень или подуровень с большей энергией.

Сначала разрываются электронные пары на 3p-подуровне, электроны переходят на 3d-подуровень. Если атом хлора получит ещё больше энергии, спаренный электрон покинет даже 3s-орбиталь и перейдёт на 3d-подуровень.
Благодаря этому атом хлора может образовывать больше химических связей. Затраты энергии, потраченные на распаривание электронов, окупаются при образовании новых химических связей.
Но в возбуждённое состояние могут перейти атомы, у которых есть неспаренные электроны и свободные орбитали. Длится возбуждённое состояние недолго: атом отдаст энергию и вернётся в основное состояние. Хотя если сообщить атому слишком много энергии, электрон покинет его и атом станет ионом.

Электронная конфигурация атомов
1. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне четыре электрона.
Ответ: 35
2. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне один электрон.
Ответ: 12

Электронная конфигурация ионов
1. Определите, какие два из указанных элементов образуют устойчивый отрицательный ион, содержащий 18 электронов.
Ответ: 23
2. Определите, какие из указанных элементов образуют устойчивый положительный ион, содержащий 10 электронов.
Ответ: 15

Домашняя работа
Вариант № 5508754
Ссылка - https:// chem-ege.sdamgia.ru/test?id=5508754














































