
Егэ по химии задание 11

план
- Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
- Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа

Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
Что такое органическая химия?
Теория строения органических соединений
Основные положения теории Бутлерова
Гомология и изомерия.
Структурная изомерия
Взаимное влияние атомов в молекулах
Заключение

Что такое органическая химия?
Органическая химия – это раздел химии, который изучает структуру, свойства и методы получения (синтеза) углеводородов и их производных. Сейчас число известных органических соединений составляет почти 30 млн, однако оно продолжает расти Этот рост обусловлен необычными свойствами углерода. Например, данный элемент может образовать цепи любой длины, способные замыкаться и образовывать циклы, а также атом углерода способен создавать одинарные, двойные или тройные связи. Валентность углерода всегда равна 4-м, поэтому он всегда будет создавать вокруг себя 4 связи. Это могут быть четыре одинарных, две двойных, одна тройная и одна одинарная и др. В любом случае, способов образовывать связи много, однако чаще всего углерод связывается с водородом, кислородом, фосфором, азотом и некоторыми другими атомами этих элементов.

Теория строения органических соединений
Ещё в глубокой древности люди могли получать органические вещества, но теория их строения была сформулирована только в 1860-х годах русским химиком Александром Михайловичем Бутлеровым. Теория получила название в честь своего автора и стала фундаментом органической химии. До возникновения этой теории существовала такая точка зрения, что органические вещества нельзя получить из неорганических, то есть для их синтеза необходима некая сила, существующая только у живых организмов. Естественно, что появление теории, противоречащей всем знаниям в области органики, вызвало непонимание у химиков того времени. Научившись самостоятельно синтезировать органические вещества, ученые столкнулись с соединениями с одинаковой молекулярной формулой и молярной массой, но абсолютно другими свойствами.

Основные положения теории Бутлерова
- Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностью.
- Химическое строение можно устанавливать химическими методами.
- Свойства любого органического вещества зависят от последовательности соединения атомов в молекуле.
- По свойствам вещества можно определить строение его молекулы, а по строению молекулы – предугадать свойства.
- Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга.

Гомология и изомерия.
Гомология (от греч. «подобный») – явление, при котором вещества имеют похожие строение и свойства, но отличаются между собой по молекулярному составу на одну или несколько групп CH 2 . Например алканы: CH 4 (метан), C 2 H 6 (этан), C 3 H 8 (пропан), C 4 H 10 (бутан). В органической химии существуют целые гомологические ряды. У каждого класса органических веществ есть свой гомологический ряд, отражающий общую формулу соединений, входящих в него.

Изомерия
Изомерия (от греч. «равный») – явление, при котором вещества имеют похожий количественный и качественный состав, но разные строение и свойства. Изомерия бывает структурная и пространственная.
Структурная изомерия
Структурные изомеры – вещества одинакового количественного и качественного состава, но разного химического строения. Структурная изомерия бывает 3-х типов.
Пространственные изомеры (стереоизомеры) – вещества одинакового количественного и качественного состава и одинакового химического строения, отличающихся друг от друга пространственным расположением атомов в молекуле. Пространственная изомерия бывает 2-х типов.
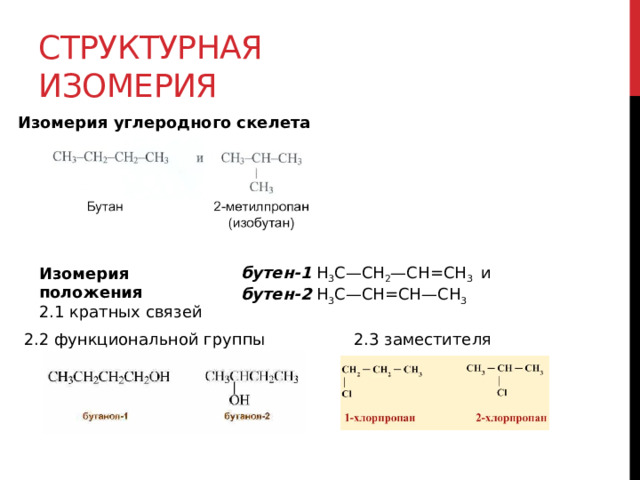
Структурная изомерия
Изомерия углеродного скелета
бутен-1 H 3 C—CH 2 —CH=CH 3 и
бутен-2 H 3 C—CH=CH—CH 3
Изомерия положения
2.1 кратных связей
2.2 функциональной группы
2.3 заместителя
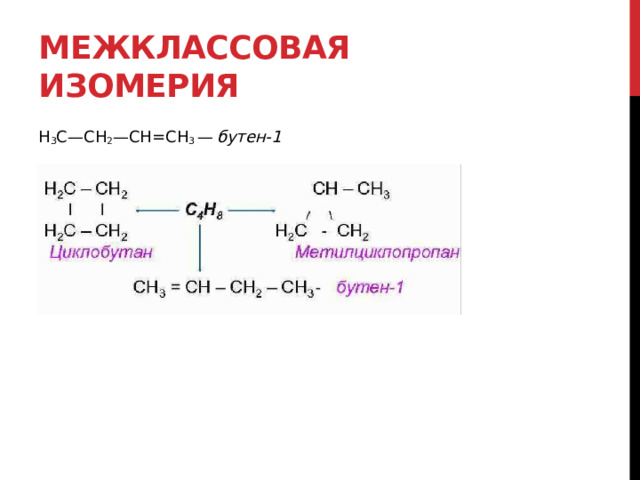
Межклассовая изомерия
H 3 C—CH 2 —CH=CH 3 — бутен-1
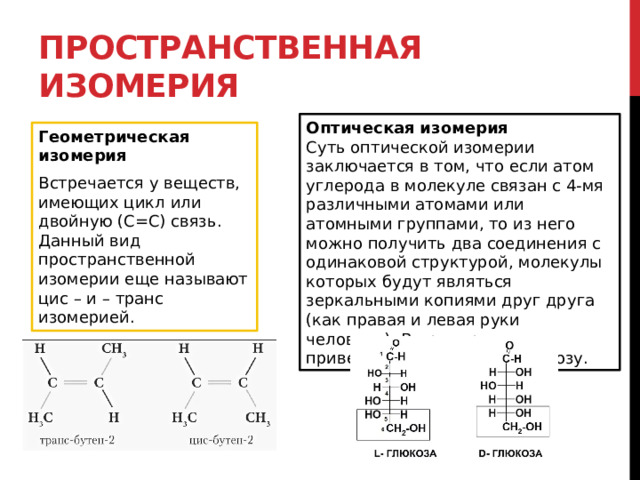
Пространственная изомерия
Оптическая изомерия
Суть оптической изомерии заключается в том, что если атом углерода в молекуле связан с 4-мя различными атомами или атомными группами, то из него можно получить два соединения с одинаковой структурой, молекулы которых будут являться зеркальными копиями друг друга (как правая и левая руки человека). В пример можно привести D-глюкозу и L-клюкозу.
Геометрическая изомерия
Встречается у веществ, имеющих цикл или двойную (С=С) связь. Данный вид пространственной изомерии еще называют цис – и – транс изомерией.

Взаимное влияние атомов в молекулах
С момента появления электронной теории химической связи (1912-1916 гг.) знания о структуре химических соединений, как о последовательности соединенных атомов, были значительно пополнены. Данная теория объясняет причину влияния атомов или групп атомов внутри молекулы друг на друга. Всего существует два способа такого взаимодействия.
Индуктивный эффект – смещение электронной плотности по σ (сигма) связям, вследствие которого происходит перераспределение эффективных зарядов на атомах в молекуле. Эффект передается с постепенным затуханием, поэтому через 3 связи становится практически равным 0. Индуктивный эффект бывает положительным (+I) или отрицательным (-I).
Мезомерный эффект – смещение общей электронной плотности по цепи сопряженных π (пи) связей. Мезомерный эффект не затухает по системе кратных связей и p-орбиталей, чем отличается от индуктивного.

Заключение
Органическая химия играет большую роль в существовании живых организмов. С давних времен люди пытались разгадать тайны органических веществ, но стремительно развиваться этот раздел химии начал только в середине XIX века. Разгадав тайны строения этих соединений, люди продолжили двигаться вперед, открывая новое и в большинстве случаях полезное для человечества

Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
- Типы связей в молекулах органических соединений
- Гибридизация атомных орбиталей углерода
- Определение вида гибридизации атома углерода
- Функциональная группа и углеводородный радикал
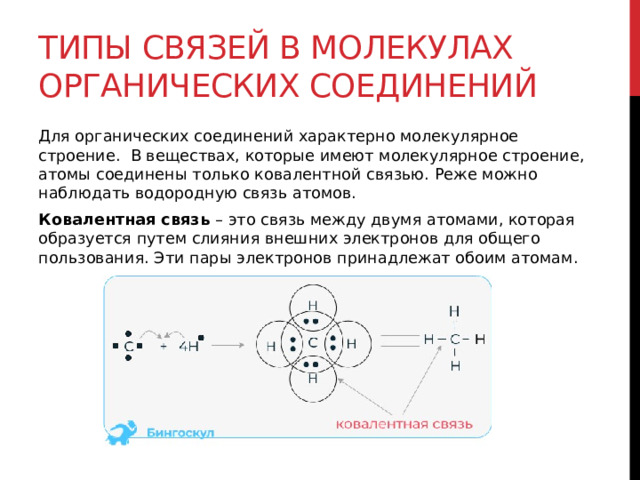
Типы связей в молекулах органических соединений
Для органических соединений характерно молекулярное строение. В веществах, которые имеют молекулярное строение, атомы соединены только ковалентной связью. Реже можно наблюдать водородную связь атомов.
Ковалентная связь – это связь между двумя атомами, которая образуется путем слияния внешних электронов для общего пользования. Эти пары электронов принадлежат обоим атомам.
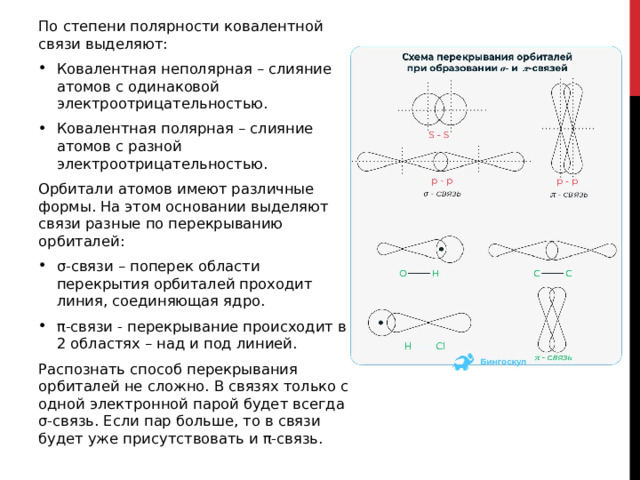
По степени полярности ковалентной связи выделяют:
- Ковалентная неполярная – слияние атомов с одинаковой электроотрицательностью.
- Ковалентная полярная – слияние атомов с разной электроотрицательностью.
Орбитали атомов имеют различные формы. На этом основании выделяют связи разные по перекрыванию орбиталей:
- σ-связи – поперек области перекрытия орбиталей проходит линия, соединяющая ядро.
- π-связи - перекрывание происходит в 2 областях – над и под линией.
Распознать способ перекрывания орбиталей не сложно. В связях только с одной электронной парой будет всегда σ-связь. Если пар больше, то в связи будет уже присутствовать и π-связь.

По количеству электронных пар выделяют:
1.одинарная, простая s—связь
2.двойная — 2 пары электронов
3. тройная, кратная —3 пары электронов
Водородная связь - связь, между положительно заряженным атомом водорода и отрицательно заряженным атомом, к таким атомам относят фтор, азот, кислород. Различают внутри- и межмолекулярные водородные связи.

Гибридизация атомных орбиталей углерода
В молекуле метана (СН 4 ) взаимодействуют 1 s- электрон и 3 р –атома углерода. Несмотря на разные характеристики эти электроны образуют 4 равносильные ковалентные связи. Это связано с видоизменением орбиталей атома углерода.

Гибридизация атомных орбиталей углерода
В процессе взаимодействия атомных орбиталей отличимых по виду, но схожих по энергии возникают одинаковые гибридные орбитали. Это явление принято называть гибридизацией АО. Образуя связь с орбиталями других атомов, процесс гибридизации способствует появлению более прочных химических связей.
Новые орбитали по форме напоминают одинаковые, ассиметричные гантели и не похожи на начальные электронные облака. Энергия, которая потрачена на гибридизацию компенсируется, и равно распределяется в гибридизированных орбиталях.

Определение вида гибридизации атома углерода
От атома углерода участвует только s – орбиталь. Соответственно, вид гибридизации на прямую будет связан с кол-вом вступивших в связь р-орбиталей (от 1 до 3).
Виды и свойства гибридизации атома углерода

Алгоритм определения вида гибридизации:
- Написать структурную формулу вещества.
- Определение количества валентных электронов, которые нужны для образования связи.
- Определение количества пар электронов образующие взаимосвязь:
если 1 пара — это σ-связь, относится к sp3-гибридизации;
если 2 пары — одна π-связь и одна σ-связь, относится к sp2-гибридизации;
если 3 пары — две π- и одна σ-связи, относится к sp-гибридизации.

Функциональная группа и углеводородный радикал
Органические соединения имеют в составе не только углерод и водород. Такие элементы, как кислород и азот образуют новые группы атомов – функциональные группы.
Функциональная группа – часть органической молекулы, которая отвечает за физические и химические свойства.
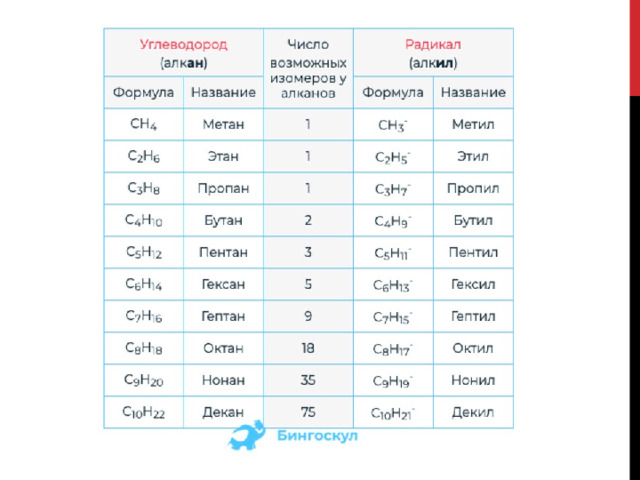
Заместителем в соединении может выступать и углеводородный радикал –остаток углеводорода, один атом водорода, в котором отсутствует. Обозначается буквой R. Каждому радикалу соответствует определенный углеводород (в названии меняется суффикс –ан на –ил, например метан и метил).

Гибридизация атомных орбиталей в органических соединениях. Типы связей
Задания для подготовки к егэ
Из предложенного перечня выберите два утверждения, которые характерны для этина.
1) линейное строение молекулы
2) sp 2 -гибридизация орбиталей атомов углерода
3) двойная связь между атомами углерода
4) неполярная связь между атомом углерода и атомом водорода
5) наличие двух -связей между атомами углерода
Ответ: 15.

Пояснение
Этин (ацетилен) — алкин, поэтому для него характерно:
1) линейное строение молекулы;
2) sp -гибридизация орбиталей атомов углерода;
3) тройная связь между атомами углерода;
4) полярная связь между атомом углерода и атомом водорода;
5) наличие двух пи-связей между атомами углерода.
С условием совпадают пункты 1 и 5.

Задания для подготовки к егэ
Строение органических соединений
Из предложенного перечня выберите две пары веществ, в каждой из которых содержатся одинаковые функциональные группы.
1) метанол и бензол
2) анилин и этиламин
3) нитробензол и нитроглицерин
4) глицерин и метан
5) бутанол-2 и фенол
Ответ: 25.

Пояснение
Анилин и этиламин — общая амино-группа (2); бутанол-2 и фенол — общая гидроксильная группа (5).

Задания для подготовки к егэ
Изомерия органических соединений
Из предложенного перечня выберите два вещества, которые являются структурными изомерами бутена-1.
1) бутан
2) циклобутан
3) бутин-2
4) бутадиен-1,3
5) метилпропен
Ответ: 25.

Пояснение
Структурными изомерами бутена-1 являются: циклобутан и метилпропен.

Домашняя работа
Вариант № 5509595
Ссылка - https:// chem-ege.sdamgia.ru/test?id=5509595













































