
ЕГЭ по химии задание 17

План
Классификация химических реакций в неорганической и органической химии

Общие понятия
Процесс преобразования одних веществ в другие, при этом отличающихся от исходных по своему составу и свойствам называется химической реакцией . Это явление сопровождается разрывом старых и образованием новых связей между атомными частицами.
Многообразие взаимодействий требует от химиков их классифицирования по следующим признакам
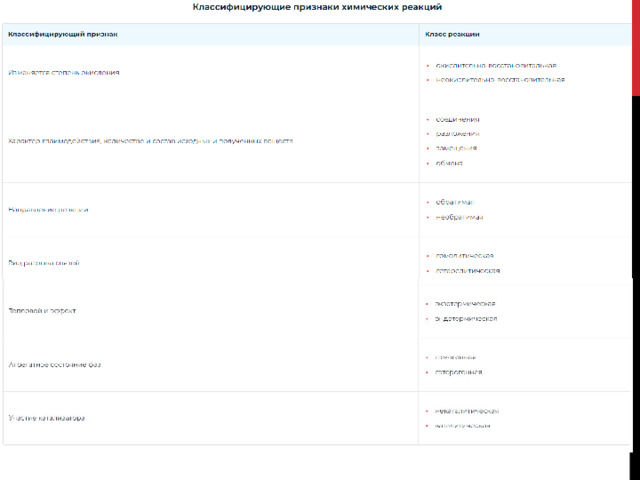

I. Систематизация реакций в химии неорганических веществ.
Примеры
1. В процессе окисления-восстановления меняется степень окисления химических элементов: Al 0 + S 0 → Al 2 +3 S 3 -2
В этом примере к атому серы присоединяются два электрона – это полуреакция восстановления. Окислительная степень её сменилась с 0 до -2.
Сера здесь – окислитель (акцептор электронов).
Атом алюминия, отдав 3 электрона, изменил степень окисления с 0 до +3 и стал восстановителем (донором электронов). Это окислительная полуреакция.
Обе полуреакции составляют единый окислительно-восстановительный процесс.

2. При проведении реакции соединения несколько реагентов образуют только один продукт: 4NO 2 +O 2 +2H 2 O=4HNO 3
3. Разложение наоборот продуцирует из одного химического реагента два или несколько других: CaCO 3 = CaO + CO 2
4. Взаимодействие простого и сложного вещества, которое ведёт к образованию других простых и сложных веществ, называется реакцией замещения : Zn + CuSO4 = ZnSO4 + Cu
5. В обменной реакции участвующие в ней реагенты меняются своими структурными частями: 2NaOH + CuCl 2 = 2NaCl + Cu(OH) 2
Частным случаем этого процесса является нейтрализация между собой кислот и оснований:
KOH + HCl = KCl + H 2 O
6. Классифицирующий признак «направление реакции» разделяет их на необратимые и обратимые . Если в ходе необратимой процесс идёт только в одном направлении до получения конечных продуктов, то в обратимой реакции он протекает в прямом и противоположном направлениях: 3H 2 + N 2 ⇆ 2NH 3 – обратимая реакция,
Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2 ↑ – необратимая реакция
7. Преобразование веществ обязательно сопровождается разрывом связей в молекулах и созданием новых.Если этот разрыв сопровождается образованием радикалов, что присуще молекулам с неполярными и малополярными ковалентными связями, то этот процесс — гомолитическая реакция:
Cl 2 свет → Cl∙ + ∙Cl
Каждая частица хлора, обладая неспаренным электроном, превращается в радикал. Реакции, связанные с разрывом сильнополярных связей и образованием заряженных частиц – ионов, являются гетеролитическими :
HBr ⇆H+ +Br –
8. Любое химическое превращение – это энергетический процесс. Поэтому ещё один показатель химического реагирования – тепловой эффект.Реакции, идущие с выделением тепловой энергии, называются экзотермическими . Практически все реакции соединения – экзотермические.
Если им ещё сопутствует световое излучение, то такая реакция носит название горение .
C + O 2 = CO 2 + Q, где Q – тепловой эффект.
Взаимодействие веществ с поглощением тепла эндотермическая реакция . К такому типу относятся реакции разложения:
CaCO 3 → CaO + CO 2 – Q
Для сведения. Уравнения, демонстрирующие тепловой эффект (Q), носят название термохимические .

9. Группа гомогенных и гетерогенных реагирований определяется фазным (агрегатным) состоянием веществ. В гомогенных – все исходные и полученные в ходе реакции вещества существуют в одной фазе. Например, в растворах, в газообразной среде:
NaOH(р-р) + HCl(р-р) = NaCl + H 2 O
2CO + O 2 = 2CO 2
Если реагенты и полученные продукты находятся в разных фазовых состояниях, то речь идёт о гетерогенном взаимодействии:
СаС 2 (т)+2Н 2 О(ж) = С 2 Н 2 ↑+Са(ОН) 2 (р-р).
10. Большая группа реакций определяется участием в них особых веществ – катализаторов , т.е. соединений – ускорителей реакции.
Каталитические реакции идут только с их участием:
2H 2 0 2 MnO 2 → 2H 2 O + O 2 (катализатор MnO 2 )
Некаталитические реакции в присутствии катализаторов не нуждаются:
КOH + HCl → КCl + H 2 O
Для сведения . Существуют также вещества, которые замедляют химические реакции – ингибиторы. В ходе реакций ни катализаторы, ни ингибиторы не расходуются и не изменяются.
II. Систематизация реакций в органической химии.
Примеры
В классификации реакций органической химии есть много аналогичного неорганической химии, но есть и своеобразие.
Основные типы взаимодействий органических веществ
замещение,
присоединение,
элиминирование (отщепление),
изомеризация и перегруппировка, - окисление,
конденсация и поликонденсация, - разложение
В реакциях замещения в исходных молекулах происходит замена одного или группы атомов, прикрепленных к углеродному скелету на другие атомы. В таких превращениях чаще всего участвуют насыщенные и ароматические углеводороды. Например, реакция спиртов с галогеноводородными кислотами:
C 2 H 5 OH + HBr = C 2 H 5 Br + H 2 O
Реакции присоединения различают по типу присоединяемого вещества, например (такие реакции происходят, когда есть двойные и тройные связи):Гидрирование — с присоединением водорода:
СН 3 —СН = СН 2 (пропен) + Н 2 → СН 3 —СН 2 —СН 3 (пропан)
Гидрогалогенирование — с присоединением галогеноводорода:
СН 2 = СН 2 (этен) + НСl → СН 3 —СН 2 —Сl (хлорэтан)
Реакция отщепления (элиминирования) сопровождается потерей атомов, причем получается новое вещество с одной или несколькими кратными связями. В названиях этих реакций присутствует приставка де- :
Дегидрирование – отрыв молекулы водорода:

Дегидратация – отрыв молекулы воды:
Изомеризация и перегруппировка сопровождаются внутримолекулярной перестройкой, связанной с перемещением атомов в молекуле без изменения её формулы:
При окислении благодаря действию окислителя повышается степень окисления углерода с отдачей электрона:
Суть конденсации – взаимодействие группы органических веществ, при котором образуются новые C — C связи и низкомолекулярное соединения (например, вода):НО—CH 3 —CH—OH + HO—CH 3 —CH—OH → НО—СH 2 —СH 2 —O—СH 2 —СH 2 — OH + H 2 O
При поликонденсации составные части (функциональные группы) образующегося полимера различаются с исходным мономером.
Например, реакция получения лавсана:
Реакция разложения, как и в неорганической химии заключается в преобразование сложного соединения на несколько более простых веществ:

Заключение
Как и многие иные научные систематизации, приведенная в статье классификация реакций в определённом смысле условна. Химики договорились разложить химические превращения по классам на основе наиболее объективных признаков.
Но на деле всё сложнее. Многим реакциям соответствуют самые разные отличительные признаки.
Например, синтез аммиака (NH 3 ) характеризуется признаками реакции окислительно- восстановительной, экзотермической, обратимой, соединения, гетерогенной, каталитической, идущей со снижением давления в реакционной среде.
Всё это надо учитывать в технологическом регламенте. Конкретный химический процесс всегда многогранен и качественно многообразен.

Задание для подготовки к егэ
Признаками реакции замещения в органической химии являются следующие: из 2 веществ образуется 2 вещества, углеродный скелет не разрушается, атом или группа атомов замещается на другой атом или группу атомов. Признаком реакции замещения в неорганической химии является взаимодействие простого и сложного вещества, как правило реакция окислительно-восстановительная.
Толуол вступает в реакцию замещения с веществами под номерами 1) и 4).
Ответ: 14.

Задание для подготовки к егэ
В этой реакции образуется щелочь и водород, поэтому она необратимая (3). Также при этом меняются степени окисления атомов металла и водорода — она окислительно-восстановительная (4).
Ответ: 34.

Домашняя работа
Вариант № 5510447
Ссылка - https:// chem-ege.sdamgia.ru/test?id=5510447




























