

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до 27.05.2025
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока


Электропроводность в солевых композициях хлорид-нитратных систем щелочных металлов
Целью данной работы является экспериментальное изучение процессов фазообразования в двух- и трехкомпонентных систем с участием нитратов цезия, рубидия и оксида ванадия (V).
Задачами данной работы являются:
- Анализ и обобщение степени изученности и их теплофизических и термодинамических свойств системы CsNO3 – RbNO3 – V2O5 и элементов ее огранения.
- Изучение процессов фазообразования в системах nMNO3-V2O5 (n=1,2. M- Cs, Rb) в твердой фазе и расплавах;
- Построение фазовых диаграмм систем nMNO3-V2O5 (n=1,2. M- Cs, Rb);
- Анализ физико-химических взаимодействий в системах nMNO3-V2O5 (n=1,2. M- Cs, Rb) с целью оценки их прикладного значения.
Достоверность сформулированных выводов и обоснованность рекомендаций достигалась использованием современных физико-химических методов исследования, методов статистической обработки данных, применением метрологически аттестованных приборов и оборудования и согласованного анализа полученных результатов с фундаментальной теорией физико-химического анализа и с литературными данными.
Просмотр содержимого документа
«Электропроводность в солевых композициях хлорид-нитратных систем щелочных металлов»
Фазообразование в системе
CsNO3 – RbNO3 – V2O5
Оглавление
Введение
Глава I. Литературный обзор
-
Физико-химические свойства нитратов щелочных металлов.
-
Взаимодействие оксида ванадия (V) с нитратами щелочных металлов.
-
Физико-химические характеристики систем CsNO3 – RbNO3, RbNO3 – V2O5.
Глава II. Методологическое и инструментальное обеспечение исследований.
2.1. Методологическое обеспечение исследований…………………..
2.2. Дифференциально – термический анализ………………………..
2.3. Визуально – политермический анализ……………………………
2.4. Подготовка исходных веществ ……………………………………
Глава III.Экспериментальное изучение системы CsNO3 – RbNO3 – V2O5
3.1. Двухкомпонентная система CsNO3 -V2O5.
3.2. Трехкомпонентная система CsNO3 – RbNO3 – V2O5
Результаты и их обсуждение…………………………………………
Выводы …………………………………………………………………………..
Литература ………………………………………………………………
Введение
Основой исследования многокомпонентных систем (МКС) является, созданный академиком Курнаковым Н.С. и его школой, физико-химический анализ (ФХА). Задачей его является изучение изменений свойств при последовательном изменении состава в равновесной системе, позволяющий вскрыть сложную картину взаимодействия компонентов в сплавах, растворах, шлаках, солевых системах.
В последнее время физико-химическая наука достигла больших успехов в развитии теории жидкого состояния. Стали широко изменяться прямые экспериментальные методы изучения свойств высокотемпературных расплавов.
Одним из методов ФХА является измерение электропроводности ионных расплавов, позволяющая установить зависимость «Свойство-состав» и «свойство-свойство» с изменением температуры, давления, концентрации, объема. С помощью электропроводности можно определить структуру расплава и ее изменение, концентрацию растворенного вещества, степень диссоциации электролитов, реакцию среды и т.д.
Для проведения тех или иных технологических процессов в среднетемпературных (100-500 0С) расплавах наиболее перспективными являются расплавленные нитраты. Благодаря легкоплавкости, хорошей электропроводности, нитраты все шире используется в металлургии, энергетике и других областях, применяются в качестве теплоносителей, как электролиты химических источников тока и др.
В расплавленном состоянии нитраты щелочных металлов полностью диссоциируют и в присутствии оксида ванадия (V) образуют бронзы, к которым возрастает интерес прикладной химии.
Нитраты одновалентных металлов имеют низкую температуру плавления и сохраняют стабильное состояние в широком интервале температур. Точечная группа симметрии нитрат-иона зависит от симметрии окружающих его полей. При нарушении плоской структуры NO3 - в результате межмолекулярного взаимодействия в расплаве можно ожидать понижение симметрии по схеме: D3h – C3v – C2v – Cs.
Расплавы нитратов относятся к ионным жидкостям со сложным (многоатомным) анионом NO3ˉ. Их физико-химические свойства определяются как строением молекулярных анионов, так и характером взаимодействия последних с катионами расплава.
Нитраты щелочных металлов (Li, Na, K, Rb и Cs) характеризуются наличием многоатомных ионов, причем в нитрат анионе (NO3-) химическая связь в ней очень прочная и при плавлении нитратов щелочных металлов заряженные частицы остаются в значительной мере устойчивыми и имеет несферическую форму. Образование различных разновидностей наиболее возможной экономной упаковки несферических многоатомных анионов (NO3-) щелочных металлов (Li, Na, K, Rb и Cs) в кристаллах сильно ограничены требованиями симметрии.
При плавлении нитратов щелочных металлов (Li, Na, K, Rb и Cs) происходит понижение потенциальной энергии, вследствии более близкого (тесного) соприкосновения катиона с одним или несколькими несферическими анионами ввиду отсутствия ограничения по требованиям симметрии.
Такое внимание исследователей к оксидным бронзам ванадия обусловлено, с одной стороны, особыми химическими, физическими и физико-химическими свойствами, такими как значительная электропроводность, высокая химическая стойкость к щелочам и кислотам, высокая механическая прочность, с другой стороны, той значительной ролью, которую они играют в важных производственных процессах. Оксидные бронзы нашли самостоятельное применение в качестве новых материалов в различных областях науки и техники.
Впервые оксидные бронзы были получены Ф. Веллером в 1823г, в результате реакций восстановления водородом расплавленных смесей вольф-рамата натрия и триоксида вольфрама. Внешнее сходство по цвету с металлическими бронзами на основе меди дало основание назвать новую группу неорганических соединений - оксидными бронзами. Этот термин впоследствии был распространен на другие аналогичные нестехиометрические соединения, т.е. фазы переменного состава на основе Мо, V, Nb, Ti, Re и других переходных металлов. Оксидные бронзы следует рассматривать как сложные оксиды, образующие в трехкомпонентных системах, например МхО - AyOz - Ayn-1Oz-1, где М - преимущественно металл I или II группы, а А - переходный металл преимущественно IV-VI групп П.С.Д.И. Менделеева. Следует отметить что интерес к оксидным бронзам постоянно возрастает. К последним в первую очередь следует отнести технологию электролитического получения молибдена и вольфрама, а также ванадия из металлургических шлаков, так называемую коррозию металла в энергетических установках, работающих на ванадий содержащем мазуте и т.д.
Оксидные ванадиевые бронзы - перспективные неограниченные материалы. Проведенные в последние десятилетия исследования позволили установить, что ОВБ могут быть успешно использованы для изготовления элек-тродов, применяемых при окислительно-восстановительном титрованиии в присутствии фториона, обладают высокой активностью и селективностью и в некоторых процессах успешно заменяют платиновые металлы [1-3]. B расплавленном состоянии ОВБ являются очень сильными восстановителями и применяются для травления лазерных стержней [4]. В ряде промышленных процессов ванадиевые бронзы образуются как побочные продукты. Они труднорастворимы, и что приводит к заметному снижению эффективности переработки ванадиевого сырья [5].
В процессах, связанных с применением ванадий - содержащего топлива (мазута) образование ОВБ - одна из причин возникновения ванадиевой коррозии, приводящей к преждевременному выходу из строя паровых котлов и турбин [6-8]. Для анализа роли химической реакции с участием ОВБ в промышленных процессах необходимо знание термодинамических характеристик ванадиевых бронз, которые до последнего времени отсутствовали.
Целью данной работы является экспериментальное изучение процессов фазообразования в двух- и трехкомпонентных систем с участием нитратов цезия, рубидия и оксида ванадия (V).
Задачами данной работы являются:
-
Анализ и обобщение степени изученности и их теплофизических и термодинамических свойств системы CsNO3 – RbNO3 – V2O5 и элементов ее огранения.
-
Изучение процессов фазообразования в системах nMNO3-V2O5 (n=1,2. M- Cs, Rb) в твердой фазе и расплавах;
-
Построение фазовых диаграмм систем nMNO3-V2O5 (n=1,2. M- Cs, Rb);
-
Анализ физико-химических взаимодействий в системах nMNO3-V2O5 (n=1,2. M- Cs, Rb) с целью оценки их прикладного значения.
Достоверность сформулированных выводов и обоснованность рекомендаций достигалась использованием современных физико-химических методов исследования, методов статистической обработки данных, применением метрологически аттестованных приборов и оборудования и согласованного анализа полученных результатов с фундаментальной теорией физико-химического анализа и с литературными данными.
Научная новизна работы:
-
Проведен анализ и обобщение степени изученности и их теплофизических и термодинамических свойств системы CsNO3 – RbNO3 – V2O5 и элементов ее огранения.
-
Изучены процессы фазообразования в системах nMNO3-V2O5 (n=1,2. M- Cs, Rb) в твердой фазе и расплавах;
-
Построены фазовые диаграммы систем nMNO3-V2O5 (n=1,2. M- Cs, Rb);
-
Проведен анализ физико-химических взаимодействий в системах nMNO3-V2O5 (n=1,2. M- Cs, Rb) с целью оценки их прикладного значения.
-
Синхронным термическим анализом изучены полученной композиции: термогравиметрия ТГ, дифференциальный термический анализ ДТА и дифференциальная сканирующая калориметрия ДСК.
Практическая ценность работы:
Полученные экспериментальные данные важны для дальнейшего развития и разработки среднетемпературных ТАМ на основе нитратов и оксида ванадия (V).
Впервые методами термического (ДТА, ВПА, СТА) и рентгенофазового анализа изучены процессы фазообразования в системах CsNO3-V2O5 и CsNO3- RbNO3 -V2O5. Выявлено, что растворимость оксида ванадия (V) в нонвариантных точках составляет 5 и 2 мол.%.
Построены экспериментально подтвержденные топологические модели фазовых диаграмм (плоскостная и объёмная) с нанесением изотерм и политерм.
Выявлены следующие соединения M2V6O16, M2V8O20,8, K2V2O13,3, MVO3, MV6O15, M2V5O13.3, соединения носят характер “бронз”, кроме MVO3- метаванадатов, образование которых зависит от количественных соотношений и подтверждено методами ДТА, ТГА и РФА.
Результаты изучения процессов физико-химического взаимодействия в твёрдой и жидкой фазах в системах nMNO3-V2O5 предложены для разработки относительно низкотемпературных химико-технологических систем : методов электрохимического синтеза щелочных бронз ванадия; способов нанесения антикоррозионных покрытий путём химико-термической обработки поверхности металлов и сплавов; методов топо- и электрохимического получения сложнооксидных фаз, содержащих ванадий (V+5) и (V+4) с катионами щелочных металлов.
Результаты данной работы можно использовать при чтении курса лекций студентам по дисциплине: «Физическая химия».
Личный вклад автора: Все экспериментальные результаты получены автором лично; анализ экспериментальных данных и теоретические обоснования проведены под руководством научного руководителя и научных сотрудников аналитического центра коллективного пользования Дагестанского научного центра Российской академии наук (АЦКП ДНЦ РАН) и НИИ ДГПУ
Объем и структура работы: Выпускная квалификационная работа изложена на 65 страницах машинописного текста, иллюстрирована 12 рисунками, и 5 таблицами. Список литературы содержит 53 ссылок.
ГЛАВА 1.0. Литературный обзор
1.1. Физико-химические свойства
Нитраты щелочных металлов по сравнению с другими неорганическими солями характеризуются низкой температурой плавления (табл.1). Некоторые эвтектические смеси нитратов плавятся при температурах, не намного превышающих температуру кипения воды.
Результаты термического анализа и исследования физико-химических свойств [9-24] свидетельствуют о том, что в расплавленном состоянии нитраты щелочных металлов практически полностью диссоциированы и не образуют между собой химических соединений.
Авторы работ [18-22] предполагают, что образующиеся в результате диссоциации нитратов анионы NО3- могут подвергаться дальнейшей диссоциации согласно схеме: NО3- ↔ NО2+ + О2-, аналогичной уравнению самодиссоциации воды: Н2О ↔ Н+ + ОН-.
В соответствии с представлениями авторов [18-22], кислотно-основные свойства расплавов нитратов определяются концентрацией нитроний-ионов NО2+, где высокая степень диссоциации и отсутствие химического взаимодействия обусловливают высокую электропроводность расплавов, хотя и несколько ниже, чем у расплавленных хлоридов, она выше или сравнима с электропроводностью многих водных растворов электролитов [24,25].
Нитраты одновалентных металлов имеют низкую температуру плавления и сохраняют стабильное состояние в широком интервале температур. Точечная группа симметрии нитрат-иона зависит от симметрии окружающих его полей. При нарушении плоской структуры NO3 - в результате межмолекулярного взаимодействия в расплаве можно ожидать понижение симметрии по схеме: D3h – C3v – C2v – Cs.
Расплавы нитратов относятся к ионным жидкостям со сложным (многоатомным) анионом NO3ˉ. Их физико-химические свойства определяются как строением молекулярных анионов, так и характером взаимодействия последних с катионами расплава.
Нитраты щелочных металлов (Li, Na, K, Rb и Cs) характеризуются наличием многоатомных ионов, причем в нитрат анионе (NO3-) химическая связь в ней очень прочная и при плавлении нитратов щелочных металлов заряженные частицы остаются в значительной мере устойчивыми и имеет несферическую форму. Образование различных разновидностей наиболее возможной экономной упаковки несферических многоатомных анионов (NO3-) щелочных металлов (Li, Na, K, Rb и Cs) в кристаллах сильно ограничены требованиями симметрии.
При плавлении нитратов щелочных металлов (Li, Na, K, Rb и Cs) происходит понижение потенциальной энергии, вследствии более близкого (тесного) соприкосновения катиона с одним или несколькими несферическими анионами ввиду отсутствия ограничения по требованиям симметрии.
При тетраэдрическом расположении кислородных атомов вокруг каждого катиона в расплавленном нитрате натрия, по схеме
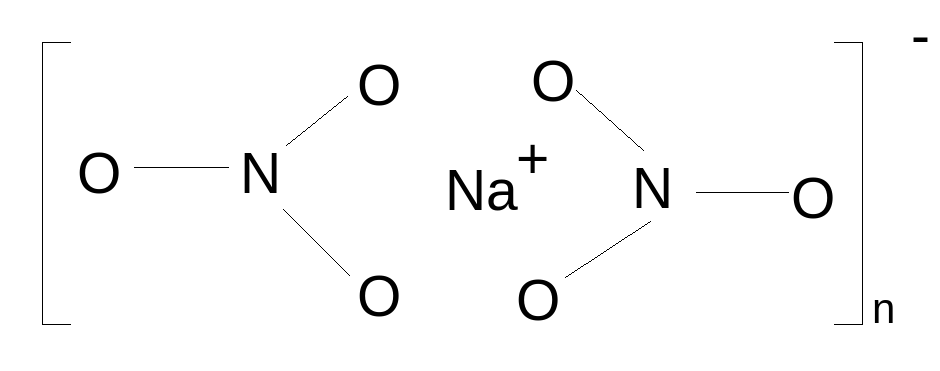
В кристалле вблизи точки плавления каждый катион Na+ окружен шестью анионами, расположенными на равных расстояниях от него.
В работах некоторых авторов (А. А. Фармаковская., И. А. Бровкина) отмечается, что вероятно существование разновидности квазирешеточной модели, в которой предполагается, что каждый катион нитратного расплава окружен четырьмя равноценными анионами. Несмотря на то, что группировки M(NO3)4³־ , где М (Li, Na, K, Rb и Cs) называются ассоциатами или комплексными ионами, они, по существу, рассматриваются как фрагменты квазирешетки.
В отличие от расплавленных нитратов щелочных металлов (Li, Na, K, Rb и Cs) в расплавах нитратов щелочноземельных металлов (Ca, Sr, Ba) взаимодействие между ионами очень сильное, т.е. межионное взаимодействие характеризуются большей силой.
О высоком поляризующем действии катионного окружении в нитратах щелочноземельных металлов (Ca, Sr, Ba) свидетельствует то, что у них при температуре близким к точкам плавления, происходит нарушение симметрии и искажение нитрат аниона, чем и объясняется их повышенная склонность к разложению. Сильное кулоновское поле, которое создают катионы в нитратах щелочноземельных металлов (Ca, Sr, Ba), препятствует разрушению кристаллической решетки, чем объясняются их относительно высокие температуры плавления.
Однако нарушение симметрии при плавлении сопровождается дополнительным искажением аниона и его термическим распадом.
В смешанных нитратных расплавах, содержащих катионы щелочноземельных металлов (Ca, Sr, Ba), так же, как и в индивидуальных, характер межионного взаимодействия преимущественно электростатический. Так как структура расплава непрерывна и существование дискретных комплексных частиц в ней трудно обосновать, под комплексными ионами подразумевают ассоциаты (катионы окруженные анионами), внутри которых расстояние катион – анион и, следовательно, значения энергии связи отличаются от ожидаемых для незакомплексованного ионного состояния, которое характерно для чистого растворителя. Таким образом, «комплексные ионы» рассматриваются не как дискретные изолированные частицы, занимающие отдельные места в анионной подрешетке, а как фрагменты ионной жидкой структуры.
Согласно комплексной модели в присутствии второй соли комплексы образуются по реакции
МХ+(n-1)AX→An-1· MXn
характеристики «комплексного иона» зависят от конкурирующего взаимодействия А и М с одним и теми же лигандами. В расплавах содержащих АХ и МХ, существуют два вида связей: М-Х и А-Х, в которых участвуют Х-ионы, находящиеся в различных энергетических состояниях. В смесях с разнозарядными катионами тенденция к усилению катион – анионных взаимодействий более выражена, чем в случае только одновалентных катионов. Катионы, имеющие большой положительный заряд (катионы ЩЗМ) оказывают большее влияние на общий анион NO3ˉ, а это ведет к изменению катион – анионных взаимодействий в первой координационной сфере и увеличению отклонения смеси от простейшего ионного раствора. Добавление двухвалентного катиона способствует расщеплению Δυ3, которое по Джанзу, определяется поляризующим воздействием катиона М2+ на анион NO3ˉ. Величина Δυ3 в смесях KNO3 –M(NO3)2, где M – катион ЩЗМ, возрастает при переходе от бария к кальцию, что свидетельствует о повышении в этом же ряду поляризующей способности двухвалентных катионов и упрочнении комплексного иона M(NO3)42- Усиление катион – анионного взаимодействия при переходе от бария к кальцию коррелируется с повышением в такой же последовательности теплоты смещения при образовании расплавленных смесей KNO3-M(NO3)2. Локализация катион – анионного взаимодействия в координации ЩЗМ – иона ведёт к ослаблению связи одновалентного катиона с ионом NO3ˉ, а это эквивалентно одностороннему искажению аниона, т.е. снижению его симметрии. Появление на спектрах смешанных расплавов, не разрешенных правилами отбора частот, отсутствующих на спектрах для индивидуальных компонентов, подтверждает изменение межионного взаимодействия и свидетельствует о понижении симметрии NO3ˉ - ионов. Изменение межионного взаимодействия и симметрии NO3ˉ - иона сказывается на транспортных и термодинамических свойствах расплава.
Таким образом, для многокомпонентных нитратных расплавов характер взаимодействия, термическая стойкость, транспортные и термодинамические свойства и т.д. определяется структурой. Образование сложных комплексных ионов (ассоциатов) в многокомпонентных нитратных расплавах определяется, прежде всего, природой катиона – зарядом, поляризуемостью и т.д. Так, например, в смеси состоящей из трех нитратов: нитрата лития, нитрата натрия и нитрата калия прочность анионов уменьшается в следующей последовательности [Li(NO3)4]3- → [Na(NO3)4]3- → [К(NO3)4]3-. В том же направлении уменьшается поляризующая способность катионов щелочных металлов. При добавлении к двухкомпонентной смеси (нитрат лития и нитрат натрия) нитрата калия, происходить замена наименее прочных комплексных ионов [К(NO3)4]3-на [Li(NO3)4]3-. Замена катионов лития катионами натрия во второй координационной сфере при переходе от LiNO3 к двухкомпонентной смеси LiNO3–NaNO3 сопровождается значительным уменьшением электропроводности, так как первую очередь заменяются не связанные в комплексы катионы лития, которые вносят наибольший вклад в проводимость. При этом электропроводность смеси должна уменьшаться, и тем значительнее, чем больше размер вводимого катиона. Относительно громоздкие анионы [Li(NO3)4]3- вносят малый вклад в электропроводность.
Изменение мольных объемов расплавленных солевых смесей с их составом может дать ценные сведения относительно структуры и характера взаимодействия компонентов. В расплавленной смеси LiNO3–NaNO3 можно ожидать изменение плотности расплава вследствие перестройки второй координационной сфере при замене в ней катионов лития на катионы натрия. Размер комплексного аниона [Li(NO3)4]3- значительно меньше, чем [Na(NO3)4]3-, поэтому упаковка аниона катионов натрия вокруг анионов [Li(NO3)4]3- должна быть менее плотной, чем вокруг [Na(NO3)4]3-. Этот эффект, должен проявляться в отклонениях мольных объемов смесей LiNO3–NaNO3 от аддитивности. Установлено также, что при малых содержаниях катионов меньшего радиуса подвижность их меньше, чем у катионов больших размеров, преобладающих в смеси. С повышением концентрации ионов меньшего размера их подвижность возрастает и становится больше подвижности катионов большего размера.
Именно поэтому в расплавленной трехкомпонентной системе LiNO3–NaNO3–KNO3 при незначительном содержании нитрата калия наиболее вероятно существование следующих комплексных ионов: Na2Li[Li(NO3)4], Na2К[Li(NO3)4]. Конечно же, соотношение тех или иных комплексных ионов определяется эквивалентным составом данной смеси. При добавлении к этой смеси нитрата стронция, т.е. катиона с большим положительным зарядом приведет к изменению катион-анионых взаимодействий в первой координационной сфере, что в свою очередь приведет к ослаблению связи катионов щелочных металлов с нитрат ионом, а в следствии и к снижению симметрии.
В ранних работах по изучению нитратных расплавов предполагалось, что анионы обладают максимальной для их состава симметрией D3h. Тщательные дальнейшие спектроскопические исследования показали, что даже в расплавах индивидуальных солей NO3ˉ - ионы имеют более низкую симметрию. Анализ силовых констант растяжения связей и изменения валентного угла в расплавах нитратов одновалентных металлов позволил авторам сделать заключения о перераспределения связей внутри иона в зависимости от его катионного окружения. Перераспределение связей внутри аниона происходит в результате усилия внешней связи М‾ - О1. По мнению Понятенко Н.А,Janz G.J, Wait S.C , благодаря усилению внешней связи образуется контактные ионные пары типа М‾ - ОNO2‾, в которых симметрия NO3ˉ - иона в расплавах нитратов KNO3, NaNO3 и LiNO3 понижено до С2υ или С3. С использованием модели, предполагающей существование ионных пар, объяснено появление полосы в области низких частот (приписано колебаниям связи М – О), а также расщепление частоты υ3 (Е´) в ИК – и КР – спектрах в расплавах LiNO3 и нитратов щелочноземельных металлов (ЩЗМ).
Однако эту модель можно рассматривать лишь как весьма приближенную, поскольку она учитывает влияние на NO3ˉ - ион только одного катиона.
Авторы Wilmshurst J.K., Devlin J.P., Li P.C., Pollard G., Janz G.J., интерпретировали те же результаты спектроскопических исследований (дополнительные частоты в спектре, зависимости частот от параметров катиона) в рамках квазирешеточной модели, учитывающей коллективное колебательное движение ионов. По этой модели предполагается существование двух взаимопереплетенных подрешеток – катионной и анионной. Авторы отрицают возможность существования ионных пар на том основании, что время жизни колебательного уровня и время между трансляционными перескоками при диффузии соизмеримы (порядка 10‾¹²). Авторами А. А. Фармаковская., И. А. Бровкина рассмотрено разновидность квазирешеточной модели, согласно которой также предполагается, что каждый катион нитратного расплава окружен четырьмя равноценными анионами. Несмотря на то, что группировки M(NO3)4³־ называются ассоциатами или комплексными ионами, они, по существу, рассматриваются как фрагменты квазирешетки. Исследования последних лет показали, однако, что некоторые сведения, например о расщеплении полосы υ3 на три и более компонента, нельзя объяснить, основываясь только на квазирешеточной модели расплава. Поэтому представления об ионных парах и квазирешеточном строении в настоящее время трансформируются в концепцию ассоциированных квазикристаллических агрегатов с числом молекул в каждом от четырех до десяти для нитратов щелочных металлов с пониженным по сравнению с кристаллом средним координационным числом.
Симметрия NO3ˉ - ионов и характер их связей с катионами лучше интерпретируются при допущении существования квазикристаллических агрегатов, а не ионных пар. С позиции представлений о существовании кристаллитов хорошо объясняется аналогия характеристик силовых полей ионов в твердой соли и расплаве Нитраты характеризуются термической устойчивостью.
В смешанных нитратных расплавах, содержащих катионы щелочных металлов, так же как и в индивидуальных, характер межионного взаимодействия преимущественно электростатический. Используя квазирешеточную модель, образование смешанного расплава нитратов можно представить как замену ионов в катионной подрешетке по законам статистики. Процессы, протекающие при образовании смеси с различными катионами А и М, наглядно описываются квазихимической моделью Флангеса, рассмотренной на примере расплавленных хлоридов. Эта модель основана на концепции, что в смешанных расплавах существует «комплексные ионы». Так как структура расплава непрерывна и существование дискретных комплексных частиц в ней трудно обосновать, авторы под комплексными ионами подразумевают ассоциаты (катионы окруженные анионами), внутри которых расстояние катион – анион и, следовательно, значения энергии связи отличаются от ожидаемых для незакомплексованного ионного состояния, которое характерно для чистого растворителя. Таким образом, «комплексные ионы» рассматриваются не как дискретные изолированные частицы, занимающие отдельные места в анионной подрешетке, а как фрагменты ионной жидкой структуры.
Согласно, в присутствии второй соли комплексы образуются по реакции
МХ+(n-1)AX→An-1· MXn
характеристики «комплексного иона» зависят от конкурирующего взаимодействия А и М с одним и теми же лигандами. В расплавах содержащих АХ и МХ, существуют два вида связей: М-Х и А-Х, в которых участвуют Х-ионы, находящиеся в различных энергетических состояниях. В смесях с разнозарядными катионами тенденция к усилению катион – анионных взаимодействий более выражена, чем в случае только одновалентных катионов. Катионы, имеющие большой положительный заряд (катионы ЩЗМ) оказывают большее влияние на общий анион NO3ˉ, а это ведет к изменению катион – анионных взаимодействий в первой координационной сфере и увеличению отклонения смеси от простейшего ионного раствора.
Добавление двухвалентного катиона способствует расщеплению Δυ3, которое по Джанзу, определяется поляризующим воздействием катиона М2+ на анион NO3ˉ. Величина Δυ3 в смесях KNO3 –M(NO3)2, где M – катион ЩЗМ, возрастает при переходе от бария к кальцию, что свидетельствует о повышении в этом же ряду поляризующей способности двухвалентных катионов и упрочнении комплексного иона M(NO3)42- . Усилению катион – анионного взаимодействия при переходе от бария к кальцию коррелируется с повышением в такой же последовательности теплоты смещения при образовании расплавленных смесей KNO3-M(NO3)2.
Локализация катион – анионного взаимодействия в координации ЩЗМ – иона ведёт к ослаблению связи одновалентного катиона с ионом NO3ˉ, а это эквивалентно одностороннему искажению аниона, т.е. снижению его симметрии. Появление на спектрах смешанных расплавов не разрешенных правилами отбора частот, отсутствующих на спектрах для индивидуальных компонентов, подтверждает изменение межионного взаимодействия и свидетельствует о понижении симметрии NO3ˉ - ионов. Изменение межионного взаимодействия и симметрии NO3ˉ - иона сказывается на транспортных и термодинамических свойствах расплава.
Многие исследователи делали попытки связать изменение электропроводности расплавленных солевых смесей в зависимости от их состава с типами диаграмм плавкости этих систем. Они исходили при этом из предположения, что структура солевых расплавов близка к структуре кристаллического состояния. Однако полного соответствия между изотермами удельной или эквивалентной электропроводности и диаграммами плавкости установить не удалось. Характерные точки на изотермах электропроводности лишь относительно соответствовали характерным точкам на линии ликвидуса. Электропроводность расплавленных солей непосредственно связана с движением ионов и зависит от природы и взаимодействия между ними, то есть от типа связи, (например, хлориды щелочных металлов) характеризуются высокой электропроводностью в расплавленном состоянии, тогда как расплавы солей с ковалентной связью плохо проводят электрический ток. Большое количество работ посвящено изучению электропроводности расплавленных щелочных металлов и их солей, полный обзор дана в работе.
Рассматривая расплавы хлоридов, бромидов, иодидов щелочных металлов видно, что проводимость изменяется в ряду CI - Br - I –для любого катиона, кроме Li+ .Даже соли лития подчиняются этому правилу вблизи точки плавления. Аналогично для каждого галогена проводимость солей изменяется в ряду Li+ Na+ K+ Rb+ Cs+. В галогенидах щелочных металлов ток в основном переносится катионами. Измерения коэффициентов в этих расплавах показали, что анион также играет в процессе переноса значительную роль. В работе сделан вывод о том, что чем меньше и легче проводящий ион, тем выше проводимость. Кроме размеров и масс значение имеют и другие факторы - момент инерции, поляризуемость заряда, эффективный объем и др. Зависимость удельной электропроводности от температуры для большинства расплавленных солей хорошо описывается уравнением
σ =α +bT + cT2,
где α, b, c – эмпирические постоянные; Т – температура, К. Теоретически эта формула до сих пор не обоснована.
Так, LiNО3 начинает разлагаться при температурах выше 530 0С [26].
Термическое разложение нитратов щелочных металлов протекает с выделением кислорода и образованием соответствующего нитрита: 2MNO3 = 2MNО2 + О2↑.
Результатом процесса электрохимического разложения расплава нитрата является выделение на катоде соответствующего металла, а на аноде - окисление нитрат ионов. При температурах выше температуры плавления соответствующих нитратов выделяющиеся на катоде щелочные металлы неустойчивы и взаимодействуют с нитратом по реакциям:
10М + 2MNО3 → 6М2О + N2; 2M + MNО3 → MNО2 + M2О.
Сложность получения щелочных металлов электролизом расплавленных нитратов обусловлена протеканием выше приведенных процессов.
Разность между равновесными потенциалами реакции окисления нитрат ионов и процесса выделения щелочного металла соответствует напряжению разложения нитратов и определяет область их электрохимической устойчивости.
Напряжение разложения индивидуальных нитратов в работе [9] определялось методом снятия кривых сила тока-напряжение, а в [27-29] путем измерения электродвижущей силы (ЭДС) электрохимической ячейки с платиновыми электродами и расплавами KNО3, NaNО3 и LiNО3 после выключения постоянного тока. Их значения при температуре 344 0С равны 3,69; 3,50 и 3,67 В, соответственно.
Нитраты щелочных и щелочноземельных металлов, особенно LiNО3 и Ca(NО3)2 представляют собой сильно гигроскопичные вещества. Нитрат лития образует с водой устойчивый кристаллогидрат состава LiNО3•3H2О, который начинает терять воду при температуре выше 30 0С. Из нитратов щелочных металлов наиболее трудно отдает воду нитрат лития. Наименее гигроскопичен нитрат калия.
Для нитратов калия, рубидия и цезия, помимо безводных солей, известны кристаллические продукты присоединения азотной кислоты с общими формулами MNО3•HNО3 и MNО3•2HNО3, выделяющиеся из растворов соответствующих нитратов, содержащих большой избыток свободной HNО3 [22].
В расплавах нитратов могут в сравнительно больших количествах растворяться другие неорганические соли, например, галогениды и нитриты. Спектроскопические исследования показали, что в смесях нитратов и галогенидов щелочных и щелочноземельных металлов комплексные соединения не образуются.
Нитраты образуются при взаимодействии оксидов и гидроксидов металлов и карбонатов с азотной кислотой: МОН + HNO3 = MNО3 + Н2О; М2СО3 + 2HNО3 = 2MNО3 + СО2↑ +H2О.[24]
Свойства исходных компонентов [52]
Таблица 1
| Вещество | p, г/см3 | tпл 0C | tкип 0C |
| V2O5 | 3,36 | 680 | 1827 |
| RbNO3 | 3,11 | 310 | - |
| CsNO3 | 3,685 (3,69) | 414; | разл. |
1.2. Взаимодействие оксида ванадия(V) с нитратами щелочных металлов.
B работе [32], посвященной изучению систем V2О5 – MNО3, с помощью термографического и рентгенофазового анализов показано, что в областях, богатых оксидом ванадия и нитратами натрия и калия, при нагревании выше 1000С образуются твердые растворы нитратов и оксида ванадия. Дополнительное исследование взаимодействия нитратов натрия и калия с оксидом ванадия проведено [33] при молярном отношении компонентов MNО3:V2О5 = 2:3, отвечающем составу найденного в [32] химического соединения. Согласно этим исследованиям фиксируемое изменение массы навески наблюдается в области температур 250 для калиевой и 2700С для натриевой систем. С повышением температуры до 300-3200С, т.е. в условиях устойчивого существования гипотетического соединения М2V6O15(N2О6), удаление оксидов азота полностью заканчивается в течение 1 ч.
Следует отметить, что скорость взаимодействия оксида ванадия с нитратом натрия больше, чем с нитратом калия. Совместное испарение и диссоциация чистых солей нитратов натрия и калия становятся заметными при температурах, значительно превышающих температуры их плавления. Скорости этих процессов для индивидуальных солей обратно пропорциональны скоростям реакций в смесях с оксидом ванадия. В смеси, содержащей KNО3, при том же соотношении исходных реагентов в результате полного взаимодействия образуется соединение К2V6О16 по реакции:
2КNO3 + 3V2O5 = K2V6O16 + N2O5. (1)
Кристаллы этого соединения имеют желто-оранжевый цвет. Рентгенофазовый анализ продуктов взаимодействия после часовой выдержки при заданных температурах подтверждает это заключение. В сплавленном при 6000С и затем медленно охлажденном образце обнаружены три соединения - K2V8O20,8, K2V5О13,3 и К2V6O16. Неравновесный состав в области 25 мол. % К2О объясняется малой скоростью взаимодействия K2V8O20,8 с расплавом в момент кристаллизации K2V6О16. В результате расплав обогащается калием, и создаются условия для образования соединения K2V5O13,3. Следовательно, соединение K2V6О16 без примеси других фаз можно синтезировать путем нагревания стехиометрического состава смеси из оксида ванадия и нитрата калия до температуры 4500С. Более подробно исследовано взаимодействие между V2О5 и NaNО3 [34].
При нагревании смесей, содержащих 0-14,28 мол. % Na2О (рис. 1, А, а) на кривых ДТА первым фиксируется полиморфное превращение NaNО3 при 2760С. Одновременно начинается взаимодействие между исходными компонентами, сопровождающееся выделением с небольшой скоростью оксидов азота. При дальнейшем нагревании нитрат натрия плавится (эндоэффект при 3060С), что приводит к резкому возрастанию скорости взаимодействия. На кривых ДТА – ДТГ в интервале 300-4200С четко фиксируются большой эндотермический эффект (кривая ДТА) и соответствующий ему "эффект" скорости убыли массы (кривая ДТГ), имеющие максимум при 3700С. Это свидетельствует о прохождении между исходными компонентами реакции с образованием бронзы Na2V5O13,3. Одновременно из системы удаляются оксиды азота и кислород по реакции:
6V2O5 + (2-n)NaNO3 = (1-0,5n)Na2V5O13,3 + (3,5+1,25n)V2O5 +
+ (1-0,5n)N2O5 + (0,1-0,05n)О2. (2)
В рассматриваемом интервале концентраций n принимает значения от 2 до 0.
В интервале 420-4600С изменение массы и фазового состава образцов, состоящих из Na2V5О13,3 и V2О5, отсутствует. При температурах 460-5740С из образцов с небольшой скоростью выделяется кислород, свидетельствующий о частичном восстановлении пятивалентного ванадия. На ИК-спектрах образцов, полученных при этих температурах, полосы Na2V5О13,3 с ростом температуры постепенно исчезают, интенсивность поглощения V2O5 ослабевает, что свидетельствует о перестройке решеток V2O5 и Na2V5OI3,3 и образовании структуры NaV6О15. Твердофазное взаимодействие в этой неравновесной системе происходит согласно схеме:
(1-0,5n)Na2V5O13,3 + (3,5+l,25n)V2O5 = (2-n)NaV6O15 + 3nV2O5 +
+ (0,4-0,2n)O2. (5)
В конце рассматриваемого температурного интервала образец с n = 0 (14,28 мол.% Na2O) состоит из одной фазы NaV6O15, при 0 n в равновесном образце находятся NaV6O15 и V2O5. При 574-6620С происходит плавление и окисление кислородом воздуха бронзы β-типа, что влечет за собой увеличение массы .
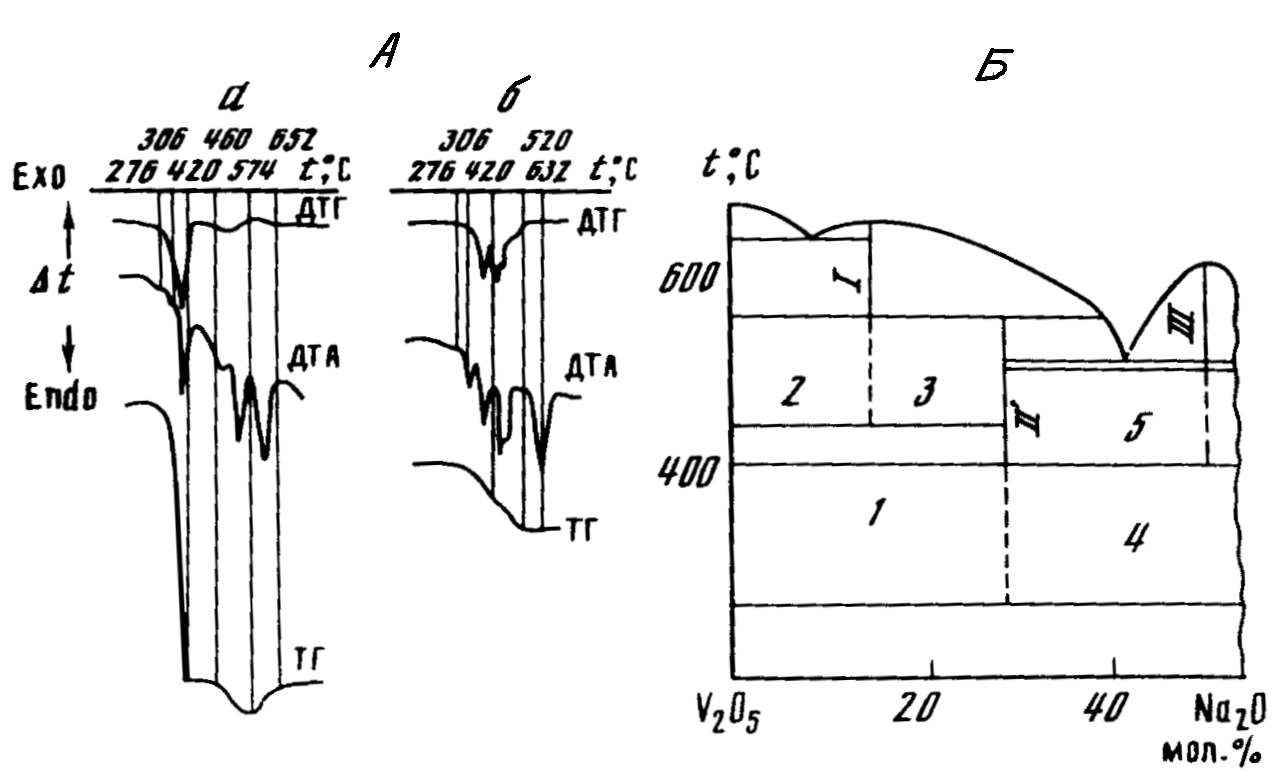
Рис. 1. Кривые ДТА, ДТГ, ТГ смесей V2O5 с нитратом натрия с 14,28 (а) и 50 (б) мол.% Na2О (А) и неравновесная диаграмма плавкости этих же смесей (Б)
I-NaV6O15, II-Na3V5O13,3, III-NaVO3; области протекания реакций: 1-(2), 2-(3), 3-(4), 4-(5), 5-(6).
Взаимодействие в системе, содержащей смеси с 14,28-28,57 мол. % Na2O, начинается около 3000С с образования Na2V5O13,3 по реакции (2). Из-за изменения соотношения исходных компонентов величина n в рассматриваемой области концентраций изменяется от 0 до – 2,8. При завершении реакции (2), т.е. к 4200С, образцы представляют собой неравновесные твердофазные смеси, состоящие из Na2V5O13,3 и V2O5. Дальнейшее нагревание (460-5470С) смеси сопровождается твердофазной реакцией Na2V5О13,3 и V2O5 с образованием NaV6O15:
(1-0,5n)Na2V5O13,3 + (3,5+l,25n)V2O5 = (2+0,715n)NaV6O15 +
+ (-0,857n)Na2V5O13,5 + (0,4+0,143n)O2 . (4)
В результате уменьшения мольной доли V2O5 глубина «ямы» на кривой TГ, пропорциональная количеству выделившегося кислорода и количеству образующегося NaV6О15, уменьшается. При 28,57 мол.% Na2О бронза NaV6О15 не образуется.
При установлении равновесного состояния после всех химических взаимодействий на кривых ДТА наблюдаются два эндоэффекта, относящиеся, судя по диаграмме состояний V2O5-Na2О, к инконгруэнтному плавлению Na2V5O13,3 (5740C) и полному расплавлению образца.
Следовательно, в рассматриваемом интервале концентраций первично образующееся соединение Na2V5О13,3 при наличии свободного оксида ванадия образует при более высоких температурах бронзу состава NaV6О15, при его отсутствии никаких превращений Na2V5O13,3 не происходит.
Смеси, содержащие 28,57-50% Na2О (рис. 1, А, б). Взаимодействие V2O5 и NaNО3 во всем интервале концентраций осуществляется в два этапа, фиксируемых на кривых ТГ, ДТГ и ДТА, что свидетельствует о двух различных стадиях превращения в системе. Вторая – высокотемпературная стадия впервые появляется сразу после изменения отношения NaNО3 : V2O5 = = 2 : 2,5 при увеличении содержания NaNО3. По мере роста последнего доля второй стадии в общем взаимодействии увеличивается и достигает наибольшей величины в смеси с 50 мол. % Na2О. Оба этапа характеризуются «эффектами» на кривой ДТГ, имеющими максимальную убыль массы при 390 и 4500С. На кривой ДТА фиксируются соответствующие им эндотермические эффекты.
Судя по ИК-спектрам и кривой ТГ, первая стадия взаимодействия соответствует образованию Na2V5О13,3. В системе происходят следующие изменения:
2,5V2O5 + (2+n)NaNO3 = Na2V5O13,3 + nNaNO3 + N2O5 + 0,5O2. (5)
Величина n в рассматриваемом интервале концентраций меняет свое значение от 0 до 3. Весь V2O5 в результате реакции (5) переходит в Na2V5O13,3, после ее окончания в зависимости от исходного соотношения компонентов в смеси остается определенное количество нитрата натрия. Интерпретация ИК-спектров образцов, полученных при различных температурах второго этапа взаимодействия, свидетельствует об ослаблении, начиная с 4200С, интенсивности полос NaNO3 и Na2V5O13,3 и одновременном появлении полос NaVO3. Химическое взаимодействие может быть представлено следующей схемой:
Na2V5O13,3 + nNaNO3 + 0,033nO2 = 1,66nNaVO3 + (1-0,33n)Na2V5O13,3 +
+ 0,5nN2O5. (6)
В зависимости от исходного количества NaNO3 образец после полного завершения реакции (6) состоит из двух твердых фаз - Na2V5O13,3 + NaVO3, в предельном случае (50 мол.% Na2O) - только из NaVO3. В конце второй стадии взаимодействия на кривых ДТА и ДТГ при 460-5200С фиксируются два небольших эффекта. Поскольку ИК-спектроскопия образцов, прокаленных до этих температур, подтверждает прохождение реакции (6), указанные эффекты, по-видимому, связаны с происходящими на поверхности частиц десорбционными процессами.
Эвтектическое, перитектическое и полное плавление равновесных двухфазных образцов, а также плавление чистого NaVО3 (образец с 50 мол.% Na2О) происходит, по данным ДТА, при температурах, соответствующих равновесной диаграмме состояний V2О5-Na2О.
Таким образом, в системе V2O5-NaNО3 (в области до 50 мол.% Na2О) взаимодействие начинается независимо от соотношения исходных компонентов при температуре полиморфного превращения NaNО3 и ускоряется после плавления последнего. Первичным продуктом во всем интервале концентраций является ванадиевая бронза Na2V5O13,3. Причиной этого может быть, во-первых, самая низкая температура плавления этого соединения (5740С) в сравнении с другими соединениями системы V2О5-Na2О, во-вторых, образование сопряженной с этим соединением самой низкоплавкой в указанной системе эвтектики, с помощью которой (а точнее с помощью тройной эвтектики, включающей также расплавленный NaNО3) происходит взаимодействие в рассматриваемой системе.
При дальнейшей термической обработке Na2V5О13,3 реагирует с избытком находящегося в образце компонента - V2О5 или NaNО3. В первом случае благодаря диффузии натрия в оксид ванадия выравнивается градиент концентраций щелочного металла, одновременно происходит перестройка кристаллической структуры компонентов и образование бронзы NaV6O15. В случае избытка NaNО3 взаимодействие последнего с Na2V5О13,3 приводит к увеличению содержания натрия, что является причиной перестройки структуры этой бронзы в структуру метаванадата.
Последовательность превращений в смеси V2O5 и NaNО3 может быть выражена следующей схемой:
V 2O5 + NaNO3 276°C Na2V5O13,3 + V2O5, 460°C NaV6O15,
2O5 + NaNO3 276°C Na2V5O13,3 + V2O5, 460°C NaV6O15,
+ NaNO3, 420°C NaVO3.
Диаграмма неравновесных состояний (рис. 1, Б), соответствующая этой схеме, иллюстрирует проходящие в системе V2O5-NaNO3 химические превращения во всем изученном интервале концентраций исходных компонентов. Что касается вопроса образования твердых растворов в системах NaNO3-V2O5 и KNO3-V2O5, то довольно трудно предположить их существование из-за различия кристаллического строения, химической связи и кристаллохимических факторов. Проведены дополнительные исследования зависимости параметров решетки от состава [33] в областях максимального образования предполагаемых растворов. Как и следовало ожидать, параметры решеток V2O5, KNO3 и NaNO3 не меняются в исследованных пределах (0,5-10 мол.% добавляемого компонента)[34].
1.3. Физико-химические характеристики ограняющих элементов системы CsNO3-RbNO3-V2O5
Н![]() итрат цезия (CsNO3). - соль белого цвета, изоморфная KNO3 очень похожая на него. С повышением температуры растворимость незначительно увеличивается. Претерпевает полиморфные превращения: при 155°С (3 выше температуры плавления разлагается с образованием CsNO2 и О2
итрат цезия (CsNO3). - соль белого цвета, изоморфная KNO3 очень похожая на него. С повышением температуры растворимость незначительно увеличивается. Претерпевает полиморфные превращения: при 155°С (3 выше температуры плавления разлагается с образованием CsNO2 и О2
2CsNO3 → 2CsNO2 + О-22
Указанные нитраты характеризуются низкой температурой плавления, гигроскопичностью относительно высокой устойчивостью, почти полной степенью диссоциации нитрат-ионы NО-3 могут подвергаться дальнейшей диссоциации по схеме:
NO-3 ↔NO+2+O2
Высокая степень диссоциации обуславливает электропроводность нитратных расплавов, которая повышается от CsNO3 к KNO3 [51].
Нитрат рубидия (RbNО3) - соль белого цвета, изоморфная нитрату калия и очень похожая на него. С возрастанием температуры растворимость RbNО3 очень сильно повышается. Для него известно несколько полиморфных превращений: при 164 0С α↔β; при 220 0С β↔γ; при 265 0С γ↔δ. Выше температуры плавления, как и KNO3, разлагается с образованием RbNO2 и O2. Получают его аналогично нитрату калия [8].
Таблица 2
Значения удельной электропроводности для RbNO3.
Температура плавления 316 0С (589 0К)
χ = - 1,3769 + 3,8156х10-3Т - 1,2658х10-6Т2
| Т | χ | | Т | Χ | |
| 590 | 0.434 | | 680 | -0.632 | |
| 600 | 0.457 | | 690 | 0.653 | |
| 610 | 0.480 | | 700 | 0.673 | |
| 620 | 0.502 | | 710 | 0.694 | |
| 630 | 0.525 | | 720 | 0.714 | |
| 640 | 0.547 | | 730 | 0.734 | |
| 650 | 0.568 | | 740 | 0.753 | |
| 660 | 0.590 | | 750 | 0.773 | |
| 670 | 0.611 | | 760 | 0.792 | |
Оксид ванадия (V) представляет собой токсичный оранжевый -порошок tпл 6740С и tкип 18270С; он плохо растворим в абсолютном спирте, ограниченно растворим в воде.
При охлаждении расплавленного оксида ванадия (V) выделяются красноватый ромбические кристаллы V2О5 с плотностью 3,34 г/см3, обнаруживающие слабо парамагнитные свойства. Пятиокись ванадия ведет себя как амфотерное вещество (преобладают кислые свойства): легко растворяется в щелочах и концентрированных кислотах. При растворении V2O5 в избытке холодной щелочи получаются орто- и пированадаты, а при нагревании - триметаванадаты.
Исследование фазовых равновесий в бинарных системах оксид ванадия (V) - оксид РЗЭ представляет значительный интерес в связи с использованием монокристаллов ванадатов иттрия и лантаноидов в новой технике. Попытки исследовать взаимодействия оксидов ванадия и РЗЭ предпринимались рядом исследователей [1, 2], однако подробного изучения указанных систем, за исключением системы оксид ванадия - оксид иттрия [3], не проводились. Методами дифференциально-термического, рентгенофазового и химического анализов исследованы фазовые равновесия в системах оксид ванадия - оксид РЗЭ (диспрозия, гольмия, эрбия, тулия, иттербия и лютеция) в интервале в концентрации 0-50 мол.% оксида РЗЭ, а в системе с оксидом гадолиния - во всем интервале концентраций.
Таблица 3
Физико-химические свойства ортованадатов РЗЭ
| Свойство | GdVО4 | DyVО4 | HоVO4 | ErVО4 | TmVО4 | YbVО4 | LnVО4 |
| Тпл 0С | 1800 | 1670 | 1670 | 1680 | 1800 | 1820 | 1800 |
| d, г/см3 | 5,47 | 5,59 | 5,72 | 5,79 | 6,00 | 6,14 | 6,20 |
| -ΔН0943, ккал/моль | 424,8 | 427,3 | 426,2 | 428,5 | 421,8 | 414,6 | 427,4 |
Во всех исследованных системах при 6700С в твердой фазе протекает экзотермическая реакция образовании ортованадатов:
V2О5+Ln2О3→2LnVО4.
При этой же температуре оксид ванадия и образующийся ортованадат дают эвтектику. Фазовые диаграммы систем оксид ванадия - оксид диспрозия, гольмия, эрбия, тулия, иттербия и лютеция в изученном интервале концентраций простые, эвтектического типа.
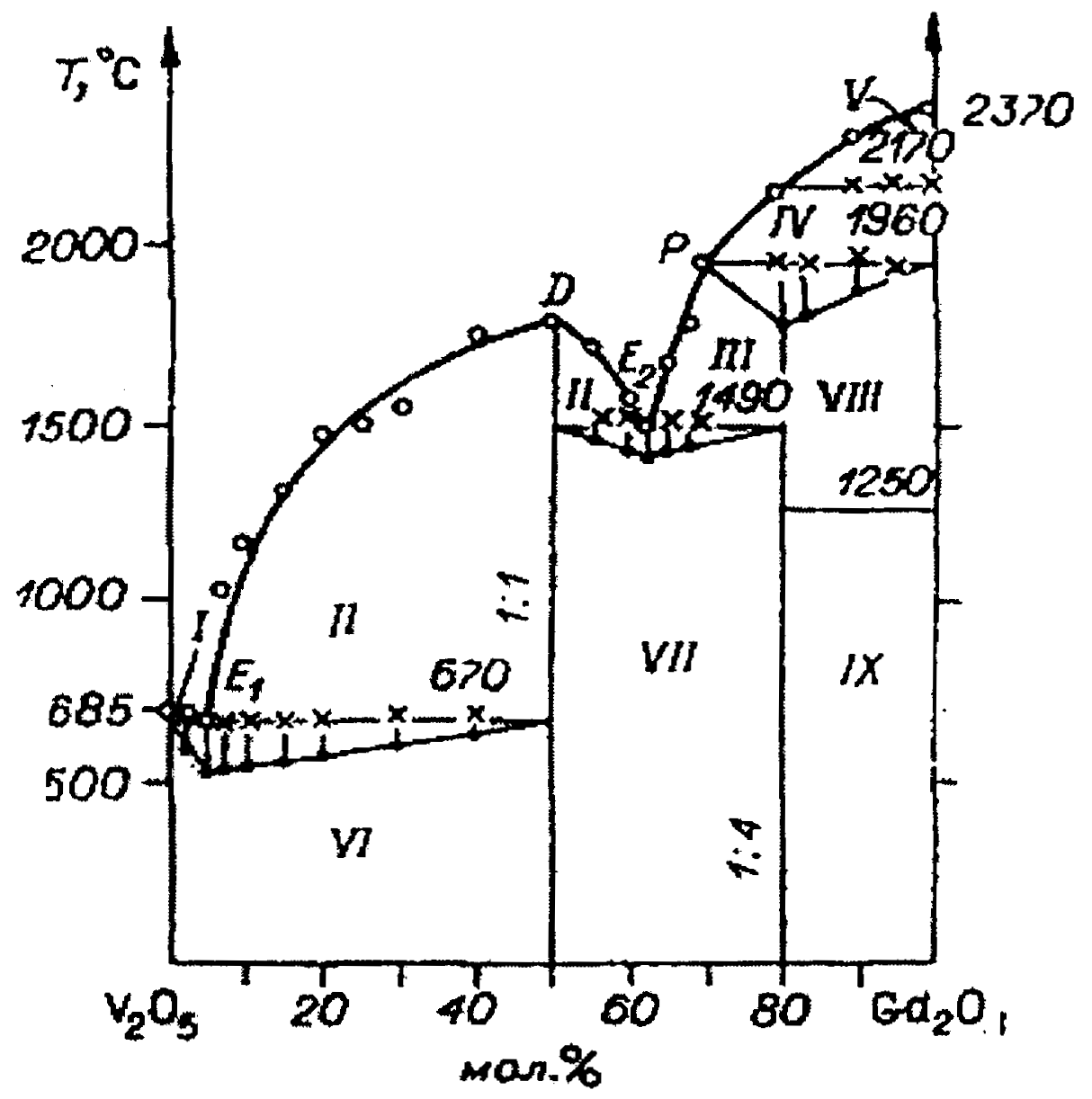
Рис. 2. Фазовая диаграмма система
оксид ванадия (V) - оксид гадолиния
Применение оксида ванадия (V).
1. Наиболее широкое применение получил в люминесцентных источниках света и в качестве красного компонента в цветном телевидении, получен люминофор на основе ортованадата иттрия, активированного европием (III) [3]. Попытки улучшить рабочие параметры этого люминофора стимулировали появление многочисленных работ по исследованию влияния различных добавок на выход и температурное тушение люминесценции европия в YVO4.
2. Дозиметры ионизирующего излучения. Способность ванадатов запасать энергию при воздействии ионизирующего излучения позволяет рекомендовать их для использования в качестве термолюминесцентных дозиметров.
3. Катализаторы. Хорошо известно применение ванадийсодержащих катализаторов в сернокислотной промышленности и в органическом синтезе.
4. Прочие возможные области использования. Имеются сведения о возможности применения оксидных соединений ванадия (V) в самых различных областях. Ортованадат натрия и растворы на его основе предложено использовать как стабилизатор электролитических ванн, работающих с солями никеля, палладия, меди и кобальта для удаления сероводорода из газообразных смесей, растворенного кислорода из воды и предотвращение связанной с ним коррозии. Ванадаты натрия и аммония предложено вводить в качестве цветообразующего вещества в чувствительный к давлению материал, используемый для воспроизведения. Предложено [23] использовать ванадат аммония для приготовления пасты, используемой для лечения и профилактики кариеса зубов у детей 7-11 лет. Паста, содержащая 50-57% ванадата аммония и глицерин, позволяет сократить срок лечения с 8-10 до 6—7 дней.
Таблица 4
Значение удельной электропроводности для оксида ванадия (V)
Температура плавления 6740С (9430К)
χ = -2,056 + 1,890x10-3Т
| Т | Χ | Т | χ | Т | Χ |
| 1140 | 0,099 | 1180 | 0,174 | 1220 | 0,250 |
| 1150 | 0,118 | 1190 | 0,193 | 1230 | 0,269 |
| 1160 | 0,136 | 1200 | 0,212 | 1240 | 0,288 |
| 1170 | 0,155 | 1210 | 0,231 | | |
Термодинамические свойства исходных компонентов
Нитрат цезия CsNO3
Ко(Т) = р(Cs) • p(N) • p3(O) • p-1(CsNO3)
Δr Ho(0) = 1599,163 кДж • моль-1
M = 194,9103
Δf Ho(CsNO3, г, 0) = -309,982 кДж • моль-1
Δf Hо(CsNO3, г, 298,15К) = -318,488 кДж • моль-1
Sояд = 27,079 Дж • К-1• моль-1
Фо(Т) = 415,2370+45,1060 -0,0019709x-2+0,27786x-1+592,6890x+1409,860x 2+1774,110x3 Дж • К-1• моль-1
(x = T•10-4; 298,15
Фо(Т) = 575,4680 + 107,3540 lnx -0,040967x-2 + 3,65481x-1 + 1,8182 – 1,116x2 + 0,358x3 Дж • К-1• моль-1
(x=T•10-4; 1500
Нитрат рубидия RbNO3
Ко(Т) = р(RbNO3)
Δs Ho(0) = 183,000 кДж • моль-1
M = 147,4727
Δf Ho(RbNO3, к, 0) = -489,494 кДж • моль-1
Δf Hо(RbNO3, к, 298,15К) = -494,700 кДж • моль-1
Sояд = 28,662 Дж • К-1• моль-1
Фо(Т) = 491,23 + 120,354 lnx + 1,07506x-1 – 1137,560x+8714,232x2 Дж • К-1• моль-1
(x = T•10-4; 298,15 T K)
Фо(Т) = 296,7672+75,833 lnx +0,76237х-1 + 683,335x Дж • К-1• моль-1
(x=T•10-4; 437
Оксид ванадия (V) V2O5
Ко(Т) = р2(V) • p5(O)
Δs Ho(0) = 3803,260 кДж • моль-1
M = 181,8798
Δf Ho(V2O5, к, 0) = -1541,345 кДж • моль-1
Δf Hо(V2O5, к, 298,15К) = -1551,000 кДж • моль-1
Sояд = 35,666 Дж • К-1• моль-1
Фо(Т) = 611,6013 + 190,878lnx - 0,0195170 x-2 +4,55100x-1-463,895x + 1587,20x2 Дж • К-1• моль-1
(x = T•10-4; 298,15 T K)
Фо(Т) = 634,4714+190,0 lnx +0,87612х-1 Дж • К-1• моль-1
(x=T•10-4; 954 T K),
где Δr Ho(0) – энтальпия реакции
Δf Ho – энтальпия образования вещества
Sояд – ядерная составляющая
Фо(Т) – энергия Гиббса
Δs Ho(0) – изменение энтальпии
Двухкомпонентные системы.
Система RbNО3 - V2O5.Изучена методом ВПА. При 300 0С и 2,5 мол.% V2О5, образуется эвтектика.
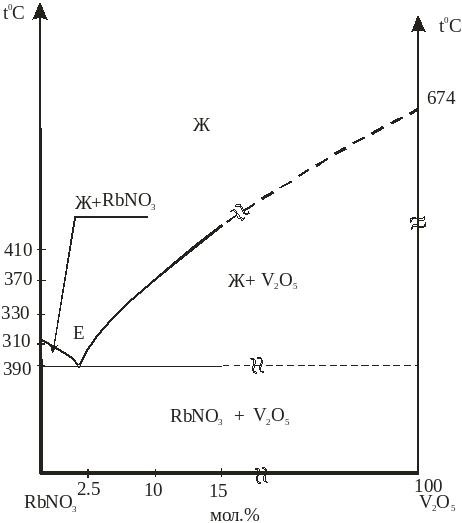
Рис. 3. Фазовая диаграмма системы RbNО3 – V2O5
Система CsNO3 – RbNO3. Исследования проводились авторами [48-50], визуально-политермическим, дифференциально-термическим, рентгенофазовыми методами анализа. Авторы указывают на непрерывный ряд твердых растворов с минимум при 2880С и 80% RbNO3, c последующим распадом и образованием CsNO3 при 3300С и 48,6% CsNO3.
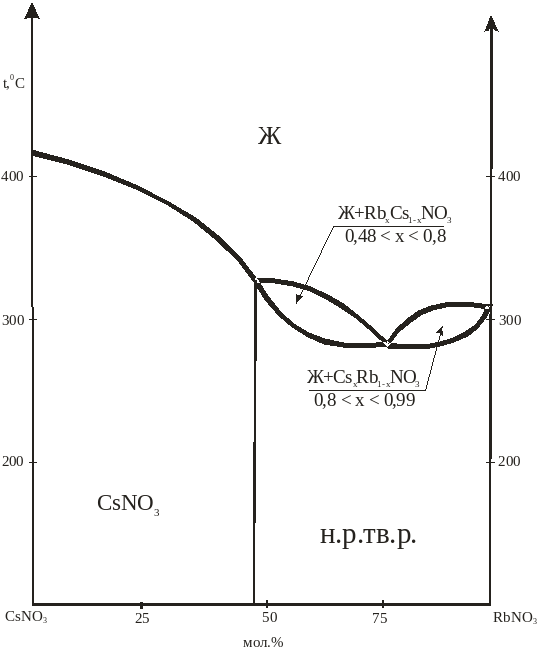
Рис.4. Фазовая диаграмма системы CsNO3 – RbNO3
Глава 2.0. Методологическое и инструментальное обеспечение исследований
2.1. Современные методы исследования многокомпонентных систем (МКС)
Исследование многокомпонентных систем (МКС) является одной из сложных задач физико-химического анализа. В ее основе лежит выбор фигуры для изображения диаграммы составов, предварительное разбиение её на симплексные элементы с учетом реакции обмена и комплексообразования и экспериментальное изучение наиболее перспективных в прикладном отношения симплексов с целью определения в них параметров равновесных состояний [35].
Учитывая задачи исследования, особенности взаимодействия компонентов и морфологию ликвидусов в ограняющих системах низших размерностей осуществляется выбор того или иного метода изучения реальной МКС.
Значительно облегчают решение одной из задач исследования определение параметров нонвариантных равновесий, малое разнообразие физико-химического взаимодействия исходных солей и морфологических типов систем, входящих в элементы огранения пятерной взаимной системы.
В данной работе использован проекционно-термографический метод (ПТГМ) [36], основанный на геометрическом соотношении различных элементов диаграмм состояния, изучаемых политермических разрезов (сечений). При этом исследуются отдельные области разреза дифференциально-термическим методом физико-химического анализа.
ПТГМ предназначен для решения одной из самых трудных экспериментальных задач – определению параметров n- вариантных равновесных состояний в изучаемой МКС [37,38].
Этот метод требует получение информации: по температурам всех фазовых переходов, происходящих при кристаллизации расплавов и подтверждение фазового состава продуктов химического взаимодействия. Данный метод позволяет упростить планирование эксперимента и интерпретацию полученных результатов, являясь экономичным, компактным и наглядным.
Исходя из этого в настоящей работе дифференциально-термический анализ (ДТА) является основным методом физико-химического анализа. В качестве дополнительного метода использован визуально-политермический анализ (ВПА). Использование рентгенофазового анализа позволило подтвердить фазовый состав различных элементов диаграммы плавкости.
Для исследования использовались соли квалификации (Х.Ч.)-фторид стронция (ЧДА) - карбонат стронция, фторид лития. Высокоплавкий фторид стронция прокаливался при температуре 550-6000C. Соли растирали в агатовой ступке и хранили в бюксах с притертыми крышками в сушильном шкафу при температуре 90-1100С во избежание попадание влаги.
2.2. Инструментальное обеспечение исследований
2.2.1. Дифференциально-термический анализ
Для записи кривых охлаждения (нагревания) применяли установку ДТА на базе электронного автоматического потенциометра КСП-4., [39, 40] схема которой приведена на рис.5.
Кроме КСП-4 в установке использовали узлы и блоки: I. Блок усиления. II. Блок управления, III. Силовая часть.
I. Блок усиления: в качестве усилителя использовали серийный микровольтамперметр Ф116/1, сигнал с дифференциальной термопары поступает на вход прибора, который в режиме усиления напряжения.
II.Блок управления состоит из источника, регулирующего напряжение ИРН-64, которая включена последовательно в цепь дифференциальной термопары, и магазина сопротивления, ИРН который необходим для измерения чувствительности установки. Скорость диаграммной ленты 600мм/ч.
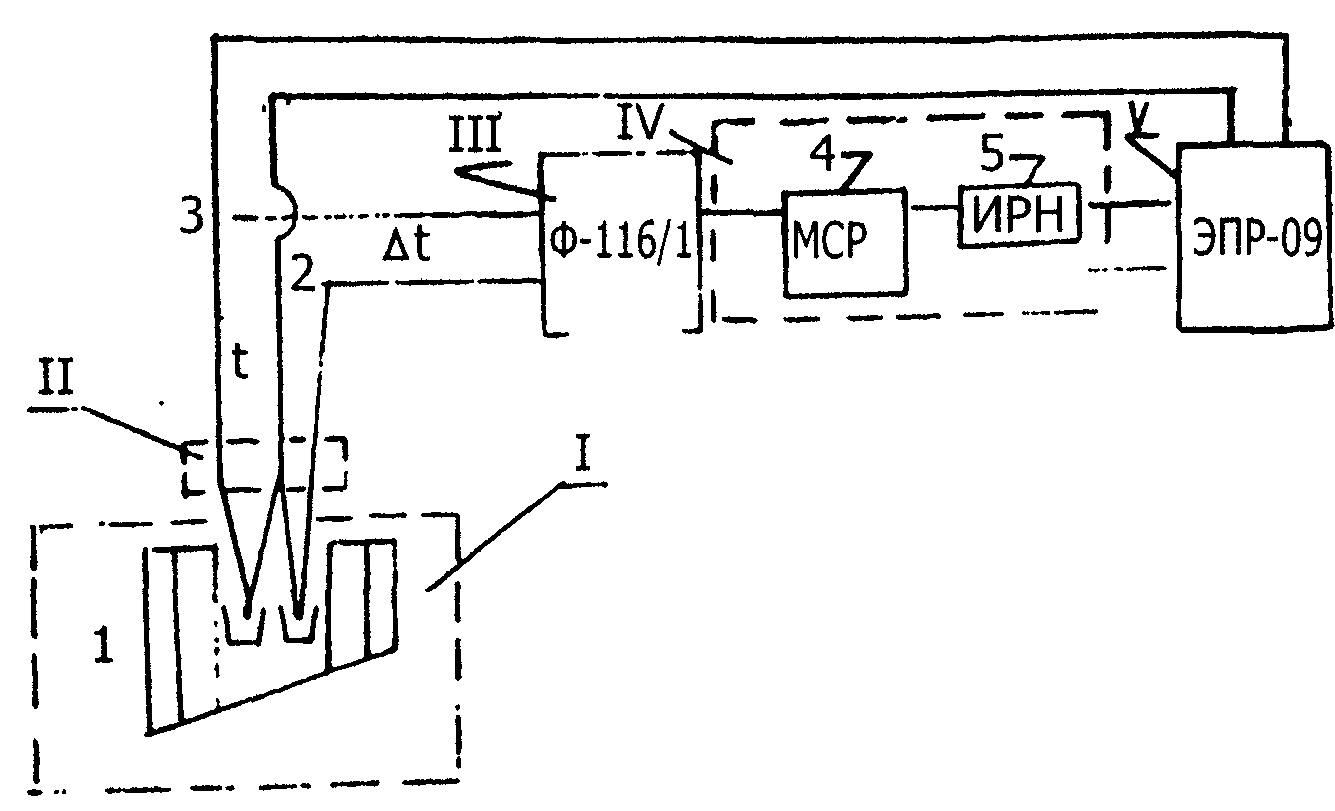
Рис. 5. Схема установки ДТА.
I. Печь шахтного типа.
II. Холодные спаи термопары.
III. Фотоусилитель Ф-116/1
IV. Силовой блок.
V. Электронный автоматический потенциометр ЭПР-09МВ.
1. Корпус печи.
2. Простая термопара.
3. Дифференциальная термопара.
4. Магазин сопротивлений.
5. Источник регулируемого напряжения.
III. Силовая часть состоит из печи шахтного типа, регулятора нагрева, реверсивного двигателя и приставного щитка. Основные требования, предъявляемые к печам для термического анализа, заключаются в возможности плавного изменения температуры и регулировки скорости нагрева в широких пределах, в равномерности распределения тепла внутри печи и в возможности того или иного температурного режима. Для регулировки скорости нагрева сопротивления (рабочий интервал от 25 до 1100°С) использовали автотрансформатор ЛАТР-2М. Скорость нагревания (охлаждения) образцов 10-20 град/мин
Исследования проводили в платиновых тиглях. Температуру измеряли с помощью калиброванных платино-платинородиевых термопар. В качестве эталонного вещества использовали свежепрокаленный оксид алюминия квалификации "ч.д.а". Навеска образцов и эталонного вещества составляла 0,2-0,5 г. Расчет составов смесей проводили по известным методикам [41].
Градуировку установки ДТА проводили по температурам фазовых переходов индивидуальных солей и смесей, рекомендованных в монографии Л.Г. Берга [39].
В печи в качестве нагревательного элемента использовали нихромовую (до 1100оС) проволоку.
Для построения фазовой диаграммы системы снимали кривые охлаждения, в отдельных случаях - нагревания и охлаждения. Ошибки в определении температур (по реперным веществам) не превышали ±5-7оС. Для воспроизведения температуры с большей точностью- до 1оС многократно повторялись съемки в строго постоянных условиях.
2.2.2. Визуально-политермический анализ
Визуально-политермический анализ разработан А.Г. Бергманом и широко освещен в литературе [42].
Сущность этого метода заключается в визуальном наблюдении за появлением первых кристаллов, которые выделяются при охлаждении расплава и за исчезновением последних кристаллов при нагревании. Одновременно регистрируется температура. По полученному ряду значений, при различных соотношениях между веществами, строят диаграмму плавкости, откладывая на оси абсцисс состав, а на оси ординат температуру.
Визуально-политермические исследования нами проведены в шахтных печах с использованием платиновых тиглей. Датчиком температуры образца служила платина-платинородиевая (10% родия) термопара ее термо-ЭДС измеряли милливольтметром с зеркальным отсчетом М 1109. Холодные спаи термопар термостатировали при 00С в сосуде Дьюара с тающим льдом. Для визуальной регистрации тигель с расплавом освещали ярким внешним источником. Схема установки представлена на рис. 6.
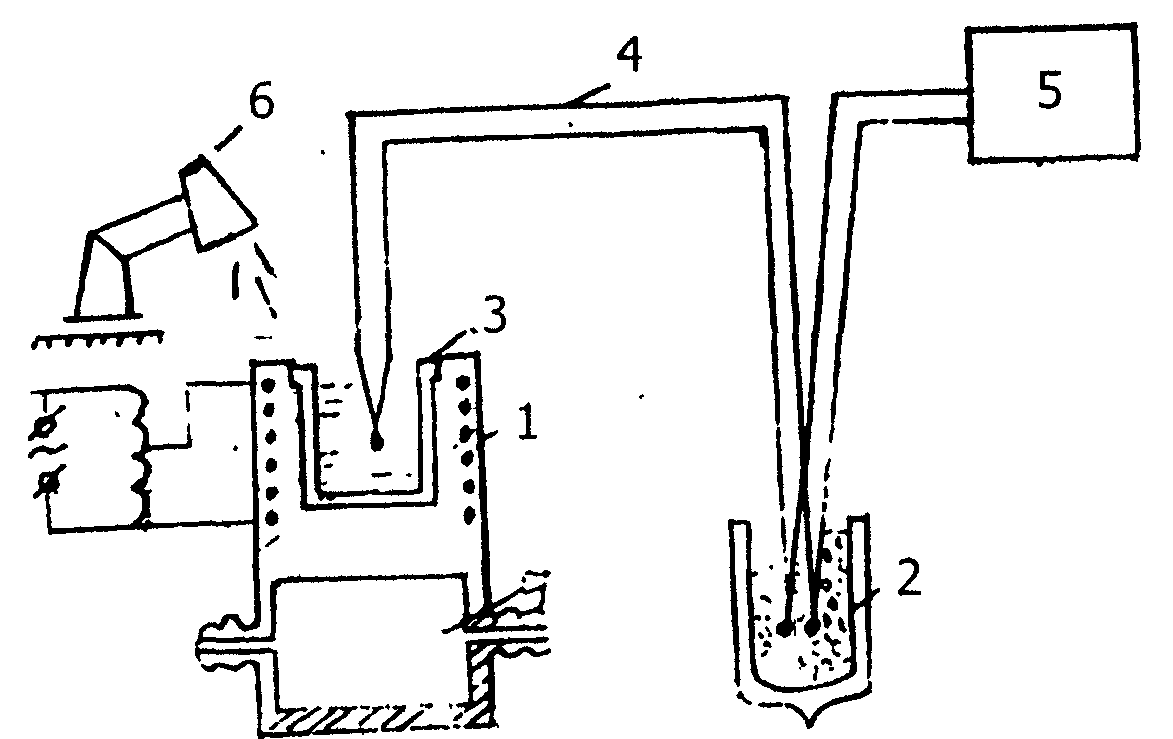
Рис. 6. Установка ВПМ:
1. Нагревательная печь.
2. Сосуд Дьюара.
3. Тигель.
4. Измерительные термопары.
5. Милливольтметр.
6. Осветитель.
Реперную кривую строили по температурам плавления солей и эвтектических смесей, рекомендованных в работе [40]. Расчет составов проводили по методике [43].
2.2.3. Рентгенофазовый анализ
Рентгенофазовый анализ исходных солей и фаз различных составов проводили на дифрактометре ДРОН-2,0 (излучение СuaК, l=0,154нм, никелевый - фильтр) [44, 45]. Образцы для РФА отжигали 18-20 часов и затем проводили закалку погружением тигля с образцом в тающий лёд. Пределы измерения 2.108имп/сек, постоянно времени 2,J=15мА, и=30кВ. Идентификацию фазовых составов проводили по таблицам Гиллера [46] и картотеки АSТМ [47]. Точность рентгенофазовых исследований 0,1 мас.%.
Рентгеновский аппарат ДРОН-2,0 предназначен для проведения широкого круга рентгеноструктурных исследований различных материалов, в том числе:
-
производить исследования общего характера (качественный и количественный фазовый анализ, исследование твёрдых растворов, определение макро- и микронапряжений, изучение ближнего порядка и др.);
-
получать полный набор интегральных интенсивностей отражений от монокристаллов;
-
определять ориентации срезов монокристаллов;
-
исследовать текстуры.
Рентгеновский аппарат ДРОН-2,0 (рис. 7) состоит из следующих функциональных узлов:
1 – дифрактометрическая стойка, объединяющая рентгеновскую трубку с гониометрическим устройством ГУР-5 и счётчиком квантов на общей жёсткой плите;
2 – электронно-вычислительное устройство ЭВУ-1-4, осуществляющее усиление, амплитудную дискриминацию и счёт сигналов, поступающих от детектора, а также питание сцинтилляционного и пропорционального детекторов;
3 – блок автоматического управления БАУ, обеспечивающий управление работой гониометра, электронно-вычислительного устройства и устройства вывода информации;
4 – устройство вывода информации УВИ-3, предназначенное для печати данных об интенсивности регистрируемого излучения и угловом положении детектора.

Рис. 7. Общий вид рентгеновского аппарата дифрактометра ДРОН-2


Рис. 8. Структурная схема рентгеновского дифрактометра ДРОН-2,0
2.1. Синхронный термический анализ
Данный метод анализа проводился на установке синхронного термического анализатора, модификации STA 449 F3 Jupiter (термоанализатор) (рис. 9), выпущенного германской фирмой «NETZSCH» и предназначенного для измерения термодинамических характеристик (температура и энтальпия фазовых переходов, теплоемкость) и регистрации изменения массы твердых и порошкообразных материалов в широком диапазоне температур от +250С до +15000С.
Синхронный термоанализатор представляет собой измерительный комплекс, в котором объединены функции дифференциального сканирующего калориметра и высокочувствительных аналитических весов. Данный прибор позволяет проводить одновременно в одном эксперименте и на одном образце измерение калориметрических величин при различных термодинамических переходах, измерять температуры этих переходов и регистрировать при этом изменение массы исследуемого образца.
Конструктивно прибор выполнен в металлическом корпусе, на котором смонтирована высокотемпературная подъемная печь, а внутри расположены высокочувствительные весы в термостатированном кожухе, электронная система управления и электрический привод подъемного устройства. Калориметрический измерительный узел ДСК, смонтированный на длинном стержне с пакетом радиационных экранов, укреплен на измерительном плече весов.
На задней панели синхронного анализатора расположены вводы для подсоединения внешних устройств и штуцеры для подключения и прокачки хладоносителя и продувки инертным защитным газом.
Управление процессом измерения осуществляется встроенным процессором. С помощью подсоединяемого через разъем RS 232 персонального компьютера осуществляется ввод параметров эксперимента (тип образца, его масса, температурный диапазон измерений, скорость нагрева или охлаждения) графическое и численное отображение процесса измерения и протоколирование.
Исследования проводились со скоростью нагревания и охлаждения 50С в минуту, в атмосфере гелия и в платиновых тиглях.
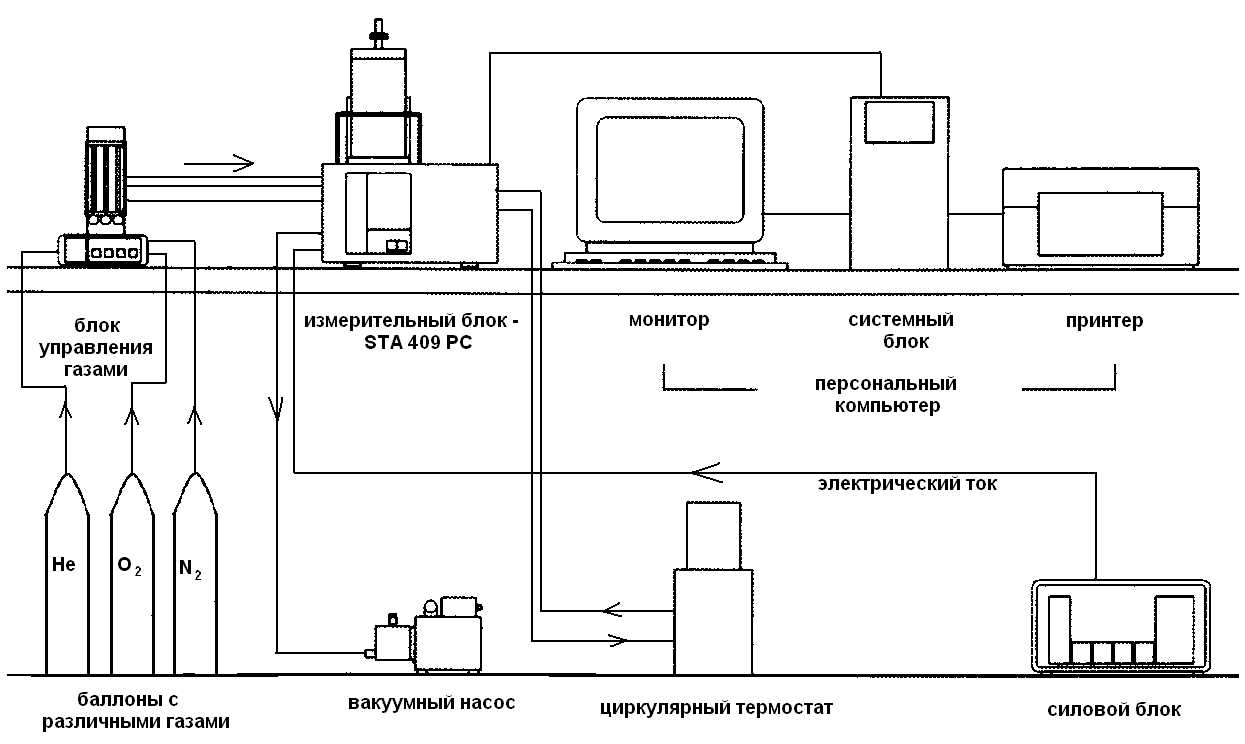
Рис. 9. Схема установки синхронного термоанализатора STA 409PC
Глава III. Экспериментальное изучение системы CsNO3 – RbNO3 – V2O5
3.1. Двухкомпонентная система CsNO3 -V2O5.
Cистема CsNO3 – RbNO3 – V2O5 состоит из трех двойных систем, из которых две двойные системы CsNO3 – RbNO3, RbNO3 – V2O5, изучены ранее, а система CsNO3 –V2O5 изучена нами (рис.10). В результате проведенных нами исследований установлено, что система носит эвтектический характер. Температура плавления её эвтектики 3900С и содержит 95% CsNO3 и 5% V2O5. Систему CsNO3 –V2O5 изучали визуально-политермическим методом, состав эвтектики подтвержден методом ДТА.
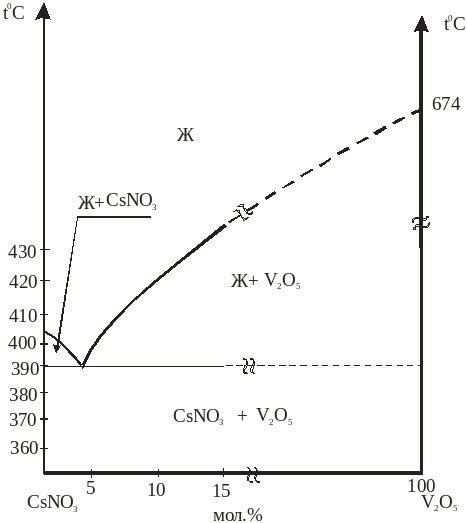
Рис. 10. Фазовая диаграмма системы CsNO3 –V2O5
3.2. Трехкомпонентная система CsNO3 – RbNO3 – V2O5
Для построения диаграммы плавкости в системы CsNO3 – RbNO3 – V2O5, изучено восемь внутренних разрезов (таб.3.), (рис.10-11), которые позволили очертить поля кристаллизующихся фаз (CsNO3, RbNO3, V2O5). Ликвидус системы представлен полями кристаллизации твердых растворов [RbxCs1-x] NO3, [CsxRb1-x] NO3, которые распадаются внутри системы с образованием исходных компонентов и V2O5, поле которого является доминирующим и занимает около 95% площади от общей поверхности ликвидуса.
Линии моновариантного равновесия, ограничивающие поля кристаллизации, сходятся в тройной эвтектике, которая плавится при температуре 2540С и содержит в мол%: CsNO3 - 19,5%, RbNO3 - 78,5%, V2O5 -2%. Температура фазообразования по моновариантным линиям составляют 270-260 0С с одной стороны, 348-260 0С – с другой, и 288-260- с третьей(рис.10. таб. 5 ) . Результаты исследований показали , что выше 420 0С расплавы системы разлагаются. Наиболее оптимальные составы в качестве электролитов можно подобрать с использованием объёмной фазовой диаграммы (рис. 12), которая является завершенной топологической моделью , в отличие от плоскостной (рис. 11), являющейся диаграммой составов.
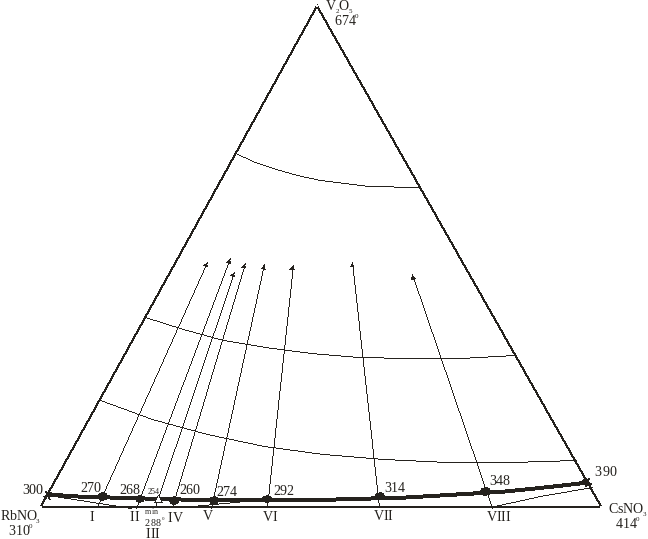
Рис.10. Диаграмма составов системы RbNO3 - CsNO3 – V2O5

Рис. 11. Внутренние разрезы системы RbNO3 – V2O5 – CsNO3.
Внутренние разрезы трехкомпонентной
системы RbNO3 – V2O5 – CsNO3.
Таблица 5.
| № | Внутренние разрезы | Добавляемый компонент | tпл, С | Кристаллизующиеся фазы |
| I II III IV V VI VII VIII | 90% RbNO3 + 10% CsNO3 83% RbNO3 + 17% CsNO3 80% RbNO3 + 20% CsNO3 77% RbNO3 + 23% CsNO3 70% RbNO3 + 30% CsNO3 60% RbNO3 + 40% CsNO3 40% RbNO3 + 60% CsNO3 20% RbNO3 + 80% CsNO3 | 2 % V2O5 2 % V2O5 2 % V2O5 2 % V2O5 2 % V2O5 2 % V2O5 3 % V2O5 3 % V2O5 | 270 268 254 260 274 292 314 348 | RbNO3 + V2O5 RbNO3 + V2O5 RbNO3 + V2O5 + CsNO3 CsNO3 + V2O5 CsNO3 + V2O5 - - - |
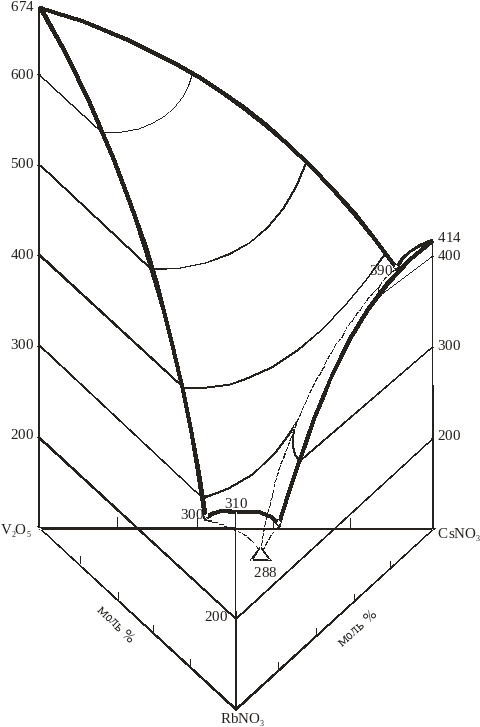
Рис.12. Объемная фазовая диаграмма трехкомпонентной
системы CsNO3 – RbNO3 -V2O5
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ.
В последнее время физико-химическая наука достигла больших успехов в развитии теории жидкого состояния. Стали широко изменяться прямые экспериментальные методы изучения свойств высокотемпературных расплавов.
Для проведения тех или иных технологических процессов в среднетемпературных (100-500 0С) расплавах наиболее перспективными являются расплавленные нитраты. Благодаря легкоплавкости, высокой термической устойчивости, хорошей электропроводности, нитраты все шире используется в металлургии, энергетике и других областях, применяются в качестве теплоносителей, при термической обработке, как электролиты химических источников тока и др.
Расплавы нитратов щелочных металлов полностью диссоциируются и в присутствии оксида ванадия (IV) образуют бронзы, к которым возрастает интерес прикладной химии.
Проведенный нами литературный обзор показывает, что нитраты щелочных металлов по сравнению с другими неорганическими солями характеризуются низкой температурой плавления (табл.1). Некоторые эвтектические смеси нитратов плавятся при температурах, не намного превышающих температуру кипения воды.
Нитраты щелочных металлов (Li, Na, K, Rb и Cs) характеризуются наличием многоатомных ионов, причем в нитрат анионе (NO3-) химическая связь в ней очень прочная и при плавлении нитратов щелочных металлов заряженные частицы остаются в значительной мере устойчивыми и имеет несферическую форму. Образование различных разновидностей наиболее возможной экономной упаковки несферических многоатомных анионов (NO3-) щелочных металлов (Li, Na, K, Rb и Cs) в кристаллах сильно ограничены требованиями симметрии.
При плавлении нитратов щелочных металлов (Li, Na, K, Rb и Cs) происходит понижение потенциальной энергии, вследствии более близкого (тесного) соприкосновения катиона с одним или несколькими несферическими анионами ввиду отсутствия ограничения по требованиям симметрии.
При тетраэдрическом расположении кислородных атомов вокруг каждого катиона в расплавленном нитрате натрия, по схеме

В кристалле вблизи точки плавления каждый катион Na+ окружен шестью анионами, расположенными на равных расстояниях от него.
В работах некоторых авторов (А. А. Фармаковская., И. А. Бровкина) отмечается, что вероятно существование разновидности квазирешеточной модели, в которой предполагается, что каждый катион нитратного расплава окружен четырьмя равноценными анионами. Несмотря на то, что группировки M(NO3)4³־ , где М (Li, Na, K, Rb и Cs) называются ассоциатами или комплексными ионами, они, по существу, рассматриваются как фрагменты квазирешетки.
В отличие от расплавленных нитратов щелочных металлов (Li, Na, K, Rb и Cs) в расплавах нитратов щелочноземельных металлов (Ca, Sr, Ba) взаимодействие между ионами очень сильное, т.е. межионное взаимодействие характеризуются большей силой.
О высоком поляризующем действии катионного окружении в нитратах щелочноземельных металлов (Ca, Sr, Ba) свидетельствует то, что у них при температуре близким к точкам плавления, происходит нарушение симметрии и искажение нитрат аниона, чем и объясняется их повышенная склонность к разложению. Сильное кулоновское поле, которое создают катионы в нитратах щелочноземельных металлов (Ca, Sr, Ba), препятствует разрушению кристаллической решетки, чем объясняются их относительно высокие температуры плавления.
Однако нарушение симметрии при плавлении сопровождается дополнительным искажением аниона и его термическим распадом.
В смешанных нитратных расплавах, содержащих катионы щелочноземельных металлов (Ca, Sr, Ba), так же, как и в индивидуальных, характер межионного взаимодействия преимущественно электростатический. Так как структура расплава непрерывна и существование дискретных комплексных частиц в ней трудно обосновать, под комплексными ионами подразумевают ассоциаты (катионы окруженные анионами), внутри которых расстояние катион – анион и, следовательно, значения энергии связи отличаются от ожидаемых для незакомплексованного ионного состояния, которое характерно для чистого растворителя. Таким образом, «комплексные ионы» рассматриваются не как дискретные изолированные частицы, занимающие отдельные места в анионной подрешетке, а как фрагменты ионной жидкой структуры.
Согласно комплексной модели в присутствии второй соли комплексы образуются по реакции
МХ+(n-1)AX→An-1· MXn
характеристики «комплексного иона» зависят от конкурирующего взаимодействия А и М с одним и теми же лигандами. В расплавах содержащих АХ и МХ, существуют два вида связей: М-Х и А-Х, в которых участвуют Х-ионы, находящиеся в различных энергетических состояниях. В смесях с разнозарядными катионами тенденция к усилению катион – анионных взаимодействий более выражена, чем в случае только одновалентных катионов. Катионы, имеющие большой положительный заряд (катионы ЩЗМ) оказывают большее влияние на общий анион NO3ˉ, а это ведет к изменению катион – анионных взаимодействий в первой координационной сфере и увеличению отклонения смеси от простейшего ионного раствора. Добавление двухвалентного катиона способствует расщеплению Δυ3, которое по Джанзу, определяется поляризующим воздействием катиона М2+ на анион NO3ˉ. Величина Δυ3 в смесях KNO3 –M(NO3)2, где M – катион ЩЗМ, возрастает при переходе от бария к кальцию, что свидетельствует о повышении в этом же ряду поляризующей способности двухвалентных катионов и упрочнении комплексного иона M(NO3)42- Усиление катион – анионного взаимодействия при переходе от бария к кальцию коррелируется с повышением в такой же последовательности теплоты смещения при образовании расплавленных смесей KNO3-M(NO3)2. Локализация катион – анионного взаимодействия в координации ЩЗМ – иона ведёт к ослаблению связи одновалентного катиона с ионом NO3ˉ, а это эквивалентно одностороннему искажению аниона, т.е. снижению его симметрии. Появление на спектрах смешанных расплавов, не разрешенных правилами отбора частот, отсутствующих на спектрах для индивидуальных компонентов, подтверждает изменение межионного взаимодействия и свидетельствует о понижении симметрии NO3ˉ - ионов. Изменение межионного взаимодействия и симметрии NO3ˉ - иона сказывается на транспортных и термодинамических свойствах расплава.
Таким образом, для многокомпонентных нитратных расплавов характер взаимодействия, термическая стойкость, транспортные и термодинамические свойства и т.д. определяется структурой. Образование сложных комплексных ионов (ассоциатов) в многокомпонентных нитратных расплавах определяется, прежде всего, природой катиона – зарядом, поляризуемостью и т.д. Так, например, в смеси состоящей из трех нитратов: нитрата лития, нитрата натрия и нитрата калия прочность анионов уменьшается в следующей последовательности [Li(NO3)4]3- → [Na(NO3)4]3- → [К(NO3)4]3-. В том же направлении уменьшается поляризующая способность катионов щелочных металлов. При добавлении к двухкомпонентной смеси (нитрат лития и нитрат натрия) нитрата калия, происходить замена наименее прочных комплексных ионов [К(NO3)4]3-на [Li(NO3)4]3-. Замена катионов лития катионами натрия во второй координационной сфере при переходе от LiNO3 к двухкомпонентной смеси LiNO3–NaNO3 сопровождается значительным уменьшением электропроводности, так как первую очередь заменяются не связанные в комплексы катионы лития, которые вносят наибольший вклад в проводимость. При этом электропроводность смеси должна уменьшаться, и тем значительнее, чем больше размер вводимого катиона. Относительно громоздкие анионы [Li(NO3)4]3- вносят малый вклад в электропроводность.
Изменение мольных объемов расплавленных солевых смесей с их составом может дать ценные сведения относительно структуры и характера взаимодействия компонентов. В расплавленной смеси LiNO3–NaNO3 можно ожидать изменение плотности расплава вследствие перестройки второй координационной сфере при замене в ней катионов лития на катионы натрия. Размер комплексного аниона [Li(NO3)4]3- значительно меньше, чем [Na(NO3)4]3-, поэтому упаковка аниона катионов натрия вокруг анионов [Li(NO3)4]3- должна быть менее плотной, чем вокруг [Na(NO3)4]3-. Этот эффект, должен проявляться в отклонениях мольных объемов смесей LiNO3–NaNO3 от аддитивности. Установлено также, что при малых содержаниях катионов меньшего радиуса подвижность их меньше, чем у катионов больших размеров, преобладающих в смеси. С повышением концентрации ионов меньшего размера их подвижность возрастает и становится больше подвижности катионов большего размера.
Нитраты щелочных и щелочноземельных металлов, особенно LiNО3 и Ca(NО3)2 представляют собой сильно гигроскопичные вещества. Нитрат лития образует с водой устойчивый кристаллогидрат состава LiNО3•3H2О, который начинает терять воду при температуре выше 30 0С. Из нитратов щелочных металлов наиболее трудно отдает воду нитрат лития. Наименее гигроскопичен нитрат калия.
Для нитратов калия, рубидия и цезия, помимо безводных солей, известны кристаллические продукты присоединения азотной кислоты с общими формулами MNО3•HNО3 и MNО3•2HNО3, выделяющиеся из растворов соответствующих нитратов, содержащих большой избыток свободной HNО3.
В расплавах нитратов могут в сравнительно больших количествах растворяться другие неорганические соли, например, галогениды и нитриты. Спектроскопические исследования показали, что в смесях нитратов и галогенидов щелочных и щелочноземельных металлов комплексные соединения не образуются.
Нитраты образуются при взаимодействии оксидов и гидроксидов металлов и карбонатов с азотной кислотой: МОН + HNO3 = MNО3 + Н2О; М2СО3 + 2HNО3 = 2MNО3 + СО2↑ +H2О.
Результаты термического анализа и исследования физико-химических свойств свидетельствуют о том, что в расплавленном состоянии нитраты щелочных металлов практически полностью диссоциированы и не образуют между собой химических соединений.
По совокупности данных литературы и наших экспериментальных исследований установлено, что в системах nMNO3 – V2O5(1≤n≤2, M-щелочные металлы) в результате частичного и полного взаимодействия реагентов образуются соединения M2V6O16, M2V8O20,8, K2V2O13,3, MVO3, MV6O15, M2V5O13,.3 образование которых зависит от количественных соотношений и подтверждено методами ДТА, ТГА и РФА. Температуры протекания этих реакций колеблются в интервале от 276 до 600 0С. Все эти соединения носят характер “бронз”, кроме MVO3- метаванадатов. Продуктами реакций также являются оксиды азота (N2O5, NO2) и кислород.
Нами впервые экспериментально изучены процессы фазообразования в системе CsNO3-RbNO3-V2O5 . В элементы огранения исследуемой системы входят три двухкомпонентные системы: -RbNO3-V2O5; CsNO3-RbNO3; CsNO3-V2O5; . Из них две системы -RbNO3-V2O5; CsNO3-RbNO3 изучены ранее. А процессы фазообразования в системе -CsNO3-V2O5 изучены нами методами ВПА и ДТА. Данная система носит эвтектический характер. Температура плавления эвтектики составляет 3900С и содержит 5 мол.% V2O5.
Результаты изучения процессов физико-химического взаимодействия в твёрдой и жидкой фазах в системах nMNO3-V2O5 предложены для разработки относительно низкотемпературных химико-технологических систем : методов электрохимического синтеза щелочных бронз ванадия; способов нанесения антикоррозионных покрытий путём химико-термической обработки поверхности металлов и сплавов; методов топо- и электрохимического получения сложнооксидных фаз, содержащих ванадий (V+5) и (V+4) с катионами щелочных металлов.
Для построения диаграммы состояния в системе CsNO3-RbNO3-V2O5 нами изучено восемь внутренних сечений, которые позволили очертить поля кристаллизующихся фаз. Поле кристаллизации оксида ванадия (V) является доминирующим и занимает примерно 95% площади от общей поверхности ликвидуса. Линии моновариантного равновесия, ограничивающей поля кристаллизации сходятся в тройной эвтектике, которая плавится при температуре 2540С и содержит в мол % : CsNO3 –19,5; RbNO3- 78,5; V2O5- 2.
По совокупности данных литературы и наших экспериментальных исследований нами построены топологические модели: плоскостная и объемная фазовые диаграммы с нанесением изотерм
ВЫВОДЫ
-
Впервые методами термического (ДТА, ВПА) и рентгенофазового анализа изучены процессы фазообразования в системах CsNO3-V2O5 и CsNO3- RbNO3 -V2O5. Выявлено, что системы эвтектического типа, с реализацией эвтектик плавящихся при температуре 390 и 254 оС соответственно. Растворимость оксида ванадия (V) в нонвариантных точках составляет 5 и 2 мол.%.
По совокупности данных нами построены экспериментально подтвержденные топологические модели фазовых диаграмм (плоскостная и объёмная) с нанесением изотерм и политерм.
2. По совокупности данных литературы и наших экспериментальных исследований установлено, что в системах nMNO3 – V2O5(1≤n≤2, M-щелочные металлы) в результате частичного и полного взаимодействия реагентов образуются соединения M2V6O16, M2V8O20,8, K2V2O13,3, MVO3, MV6O15, M2V5O13.3, образование которых зависит от количественных соотношений и подтверждено методами ДТА, ТГА и РФА. Температуры протекания этих реакций колеблются в интервале от 276 до 600 0С. Все эти соединения носят характер “бронз”, кроме MVO3- метаванадатов. Продуктами реакций также являются азота (N2O5,NO2) и кислород.
3. Результаты изучения процессов физико-химического взаимодействия в твёрдой и жидкой фазах в системах nMNO3-V2O5 предложены для разработки относительно низкотемпературных химико-технологических систем : методов электрохимического синтеза щелочных бронз ванадия; способов нанесения антикоррозионных покрытий путём химико-термической обработки поверхности металлов и сплавов; методов топо- и электрохимического получения сложнооксидных фаз, содержащих ванадий (V+5) и (V+4) с катионами щелочных металлов.
Литература
-
Оксидные ванадиевые бронзы. Под ред. Спицына. Наука. 1982г. 3-18 с
-
Фатиев А.Н., Слободин Б.В., Ходос М.Я. Ванадаты. М.: Наука, 1988г.; 129-133 с.
-
Морачевский Г.А. Справочник по расплавленным солям. Том 1. Электропроводность, плотность и вязкость индивидуальных расплавленных солей. Ленинград: Химия. 1971. 104-107, 111 с.
-
Барабошкин А.Н. Электрохимия. Электрокристаллизация металлов из расплавленных солей. М.: Наука. 1976. 132-157 с.
-
Ткаленко Д.А. Электрохимия нитратных расплавов. Киев: Наука. 1983. 76-114 с.
-
Электрохимия. Прошедшие тридцать и будущие тридцать лет. Под ред. Блума Г. и Гутмана Ф.М.: Высшая школа. 1982. 57-84 с.
-
Ефимов А.И. и другие. Свойства неорганических соединений. Ленинград. Химия. 1983. 130, 160, 184 с.
-
Посыпайко В.И., Алексеева Е.А., Васина Н.А. Диаграммы плавкости солевых систем. Часть III справочник. М.: Металлургия. 1979.89-84 с.
-
Поповская Н.П., Проценко П.И. Температурная зависимость
электропроводности нитратов и их смесей в расплавах//Журн. неорган. химии. 1962. 7. № 9. С.2237-2240.
10.Проценко П.И., Малахова А.Я. Плотность и мольные объёмы
расплавов взаимной системы из нитритов и нитратов калия и бария/ Журн. неорган.химии. 1961. 6. № 7. С. 1662-1671.
11. Фармаковская А.А., Бровкина И.А., Смирнов М.В., Хохлов В.А.
Связь транспортных свойств со строением бинарных расплавленных смесей перхлоратов и нитратов лития, натрия, калия//Физическая химия и электрохимия расплавленных и твёрдых электролитов. - Свердловск: УНЦ АН УССР, 1973. С.30-32.
12.Шаргородский С.Д., Шор О.И. Изучение термического
разложения нитратов и карбонатов берилия, кальция, стронция и бария// Укр. хим. журн. 1954. 20. №4. С.357-362.
13.Даниленко Э.В., Рыбкин Ю.Ф., Заславский Б.Г. Влияние
катионов и анионов на поверхностный потенциал расплавленного нитрата натрия//Электрохимия. 1972. 8. № 11. С.1714-1715.
14. Радченко И.В., Понятенко Н.А. Ориентационное взаимодействие
и вращательное движение иона NO3" в расплавах одновалентных нитратов// Оптика и спектроскопия. 1969. 2. № 6. С.645-651.
15.Поповская Н.П., Проценко П.И. О взаимодействии нитратов
металлов первой группы периодической системы Д.И. Менделеева с нитратом кадмия в расплавах//Журн. общ. химии. 1954. 24. № 2. С.207-211.
16. Проценко П.И., АндрееваТ.А. Электропроводность расплавов
системы Cs,Ba/NO2,NO3//3KypH. неорган, химии. 1962. 7. № 7. С. 1648-1654.
17.Проценко П.И., Проценко А.В. Потенциалы разложения расплавов нитратов щелочных металлов и серебра//Изв.вузов. Цвет; металлургия, 1963. № 5. С.95-98.
18.Duke F.R. Acid-base reactions in fused alkali nitrates//I.Chem.Educ, 1962. 39. № 2. p.57-58.
19.Duke F.R., IversonM.L. Acid-base reactions in fused salts. 1.The dichromate-nitrate reaction//J.Amer.Chem.Soc, 1958. 80. № 19. p.5061-5063.
20.Duke F.R., YamamotoS. Acid-base reactions in fused salts.2.The absolute concentration of NO2+ -ion in fused nitrate-Ibid., 1959. 81. № 24. p.6378-6379. 21.Kust R.N., Duke F.R. A Study of the nitrate ion dissociation in fused nitrates// Ibid., 1963. 85. № 21. p.3338-3340.
22.Hills G.J., Johnson K.E. Polarography in molten nitrates//In: Adv. Polarogr. 2 and Int. Congr. (Cambridge, 1959). Cembridge: Acad. Press. 1960. vol. 3. p.974-981.
23. Присяжный В.Д. О физико-химических свойствах расплавов бинарных солевых систем в связи со свойствами индивидуальных компонентов//В кн.: Физическая химия и электрохимия расплавленных солей. - Киев: Наук, думка, 1965. С. 770-781.
24.Делимарский Ю.К. Полярография ионных расплавов//Итоги науки и техники ВИНИТИ. Растворы. Расплавы. - 1975. 2, С.5-75.
25.Прикладная электрохимия / Н.П. Федотьев, А.Ф. Алабышев, Л.Д. Ротинян и др. — М.: Госхимиздат, 1962. — 552 с.
26.Бордюшкова Е.А. Термическая устойчивость и кинетика разложения нитритов и нитратов щелочных и щелочно-земельных металлов: Автореф. дис. ... канд. хим. наук. - Ростов н/Д: РГУ, 1965. - 28 с.
27.Arvia A.J., Calaiidra A.J., Martins M.E. A galvanic cell with molten lithium nitrate//Electrochim. acta, 1966.11. № 8. p.963-966.
28.Arvia A J., Calandra A.J., Martins M.E. A reversible chemical cell of molten potassium nitrate. - Ibid., 1967. 12. № 3. p.347-351.
29.Arvia A.J., Calandra A.J., Triaca W.E. The reversible de composition potential of molten sodium nitrate/flbid., 1964. 9. № 11. p. 1417-1422.
30. Некрасов Б.В. Курс общей химии. - М.: Химия, 1938. Т.1. 351с.
31.Химия. Справочное руководтво. Пер с нем. - Л.: Химия, 1975. 576с.
32.Мохосоев М.В., Алейкин С.М. Федеров П.И. // Журн. неорган. химии.1966.т. 11, №5 С.1206-1209
33.Фотиев А.А. // Журн. неорган. химии.1968.т. 13, №7 С.1782-1786
34.Фотиев А.А., Слободин Б.В., Ходос М.Я. Ванадаты. Состав, синтез, структура, свойства.- М. : наука, 1988.- 272с.ISBN 5-02-001410-9
35. Пригожин И., Дефейн Р. Химическая термодинамика. Новосибирск:
Наука, 1966.-506с.
36.Бергман А.Г. Политермический метод сложных солевых систем. Всесоюзный Менделеевский съезд по теоретической и прикладной химии.
Сост. 25 октября – 1 ноября 1932 года. Харьков – Киев ГНТИ 1935 г., Т. 2,
вып. 1 с. 631 – 637.
37.Бергман А.Г., Лужная Н.П. Физико-химические основы изучения использования соляных месторождений. М.: АН СССР, 1951.- 251 с.
38. Берг Л. Введение в термографию. М.:Наука.-1969.-395с
39. Уэндланд У. Термические методы анализа. (Пер. с анг. под ред. Степанова В.А., Берштейна В.А.). М.:Мир.-1978.-526с.
40. Берг Л.Г., Бурмистрова Н.П. Термографическое исследование солей с одновременной записью двух свойств- термодинамических эффектов и электропроводности // Журн. неорган. химии. 1960.-Т.5№3.-С.676-683.
41. Политермический метод изучения сложных соляных систем. 1932. Вып.1. С.631-637.
42.Трунин А.С., Петров Д.Г. Визуально-политермический метод. –Куйбышев:-94с. Представлен Куйбышевским политехн. Ин-том.- Деп. в ВИНИТИ 6.02.1978. №584-78
43. Трунов В.К., Ковба Л.М. Рентгенофазовый анализ: 2е изд.доп.и перераб.-М.:МГУ,1976.-232с.
44.Миркин Л.И. Справочник по рентгеноструктурному анализу поликристаллов. М.: Физматиц.-1961.-С.863.
45.Диаграммы плавкости солевых систем.Двойные системы с общим анионом. Справочник//Под обш. Ред.В.И.Посыпайко, Е.А.Алексеевой. - М.:Метуллургая, 1977.-303 с.
46.Диаграммы плавкости солевых систем.Двойные системы с общим катионом. Справочник//Под обш. Ред.В.И.Посыпайко, Е.А.Алексеевой. -М.:Метуллургая, 1977.с.
47. Справочник по плавкости систем из безводных неорганических солей. Двойные системы // Под общ. ред. Н.К.Воскресенской.-М.,-Л.:АН СССР,1961.
48. Блидин В.Г. // Изв. Сектора физ.-хим. анализа, 1953. Т. 23. С. 233.
49. Проценко П.И., Белова З.И. // Журн. общей химии 1955: В. 25. С. 244.
50. Проценко П.И., Шмелькова Г.У. Гетерогенные равновесия нитратных и нитритных системах – Элиста. Калмиздат. 1970. С. 23.
51. Елисеев А.А., Гориловская Н.Б., Циганков В.Н., Толстова В.А. // Журнал неорган. химии. 1989. Т. 34. Вып. 10, С. 2678-2681.
52. Свойства неорганических соединений. Справочник. Ефимов А.И. и др.- Л.: Химия,1983. 392 С
53. Гасаналиев Э.А. Дипломная работа. Махачкала. ДГУ,1982г.
50
Полезное для учителя























