| Тема нашего урока «Электрический ток в жидкостях. Закон электролиза». На уроке мы с вами познакомиться с новым понятием - электролиз, сравнить эти понятия с точки зрения физики и химии, получим закон электролиза Фарадея. Вернемся к нашим опытам, мы убедились, что кристаллический хлорид натрия и дистиллированная вода не проводят ток, а водный раствор этого вещества очень хорошо проводит электрический ток. Откуда же в растворе появились заряженные частицы? Рассмотрим механизм образования ионов в растворе (демонстрация анимационного ролика «Растворение хлорида натрия в воде»). Давайте разберемся, что же происходит при растворении хлорида натрия в воде. В молекулах хлорида натрия связь ионная, и состоят из ионов натрия и хлора, но ионы в кристалле не могут свободно перемещаться, поэтому сухое вещество не может проводить электрический ток. Молекула воды образуется при помощи ковалентных полярных связей, разорвать которые трудно. Поэтому и дистиллированная вода тоже не проводит электрический ток. Вода – полярное вещество, так как атомы, входящие в ее состав, отличаются величиной электроотрицательности. За счет избыточного положительного заряда на водороде и отрицательного заряда на кислороде вода способна притягивать к себе заряженные частицы и полярные молекулы. При растворении хлорида натрия в воде ионы его взаимодействуют с диполями воды с той силой, с какой диполи воды притягивают к себе ионы натрия и хлора. А так как силы притяжения между ионами натрия и хлора меньше, чем сила ковалентных связей в воде, то хлорид натрия в воде распадается по схеме: 
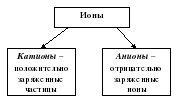
Итак, водный раствор хлорида натрия состоит из заряженных частиц, и поэтому данный раствор является электролитом. CuSO4 →Cu2+ + SO4 2- AgNO3 → Ag+ + NO3– Ионы: катионы положительно заряженные частицы, анионы отрицательно заряженные частиц. Процесс распад электролитов в водном растворе под действием электрического тока называется электролитической диссоциацией. Если пропустить через раствор или расплав электролита постоянный электрический ток. То ионы приобретают упорядоченное движение, т.е. отрицательные ионы перемещаются к положительному электроду – аноду, а положительные ионы к отрицательному электроду – катоду. Таким образом установится электрический ток. Поскольку перенос заряда в водных растворах электролитов осуществляется ионами, такую проводимость называют ионной. Демонстрация переноса вещества: давайте посмотрим, что же происходит с раствором иодидом калия под действием электрического тока. В U-образную трубку нальем раствор иодида калия, в левое колено добавим фенолфталеин (для чего?), и подключим к источнику постоянного тока. Наблюдаем, что на электродах началось выделение газа и желто- коричневого налета с другой стороны (йода), а в левой части раствор окрасился в малиновый цвет. KI → K+ + I- Н2 О→ Н+ + ОН-

( - ) катод ( +) анод K+ 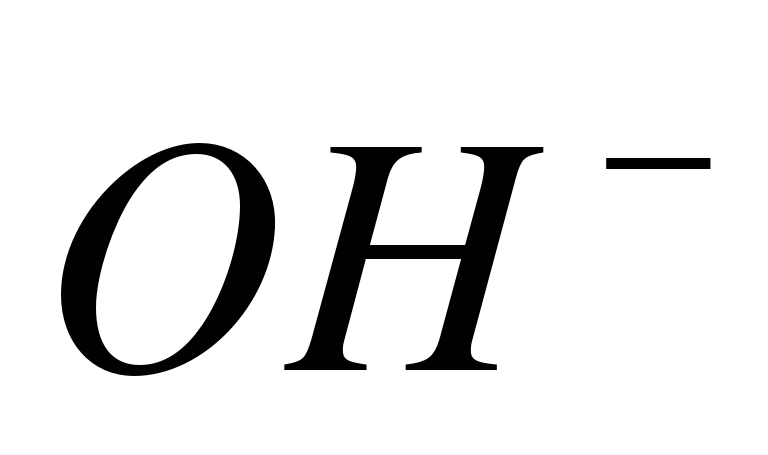 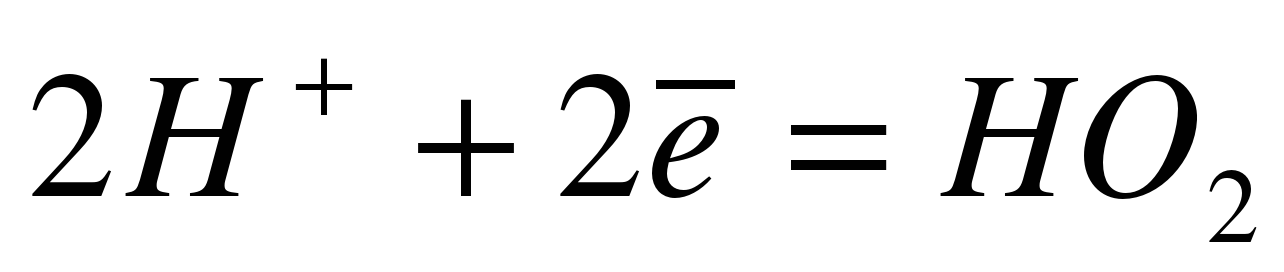 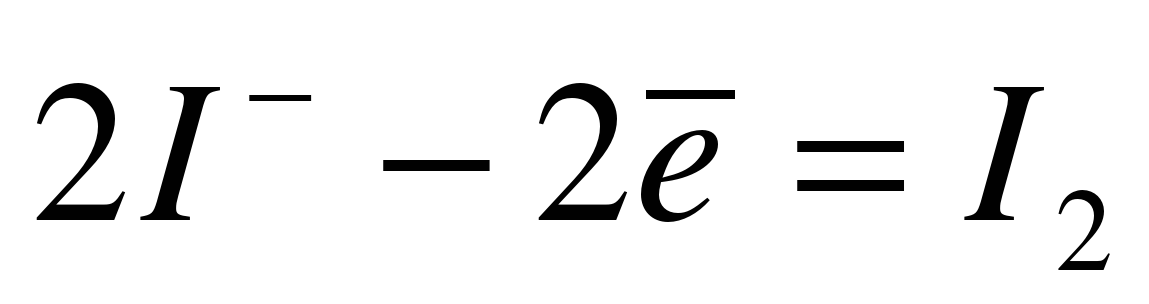
суммарное уравнение
KI + 2 Н2 О = НО2 ↑ + I2 + 2KОН Этот процесс называют электролизом. Совокупность окислительно-восстановительных процессов, протекающих в растворах или расплавах под действием электрического тока называют электролизом. Чтобы правильно определить продукты электролиза существуют правила анодных и катодных процессов. На столах учащихся лежат распечатанные правила анодных и катодных процессов. Правила анодных процессов: В первую очередь разряжаются бескислородные ионы (остатки бескислородных кислот): S– , I– , CI– , Br–. Во вторую очередь разряжаются гидроксид ионы: 4 ОН– - 4е →О2 +2 Н2О В растворе не разряжаются анионы кислородосодержащих кислотных остатков и F– Правила катодных процессов: В первую очередь на катоде разряжаются катионы металлов, стоящих в ряду напряжений металлов после водорода. Во вторую очередь разряжаются катионы водорода 2 Н+ + 2 е → Н2 Одновременно с катионами металла, стоящих в ряду напряжения металлов от алюминия до водорода. В растворах никогда не разряжаются катионы металлов, стоящих в ряду напряжения металлов до алюминия (включительно). Во время демонстрации электролиза раствора иодида калия на аноде все больше образуется свободного йода. А как вы думаете, ребята, можно ли определить массу выделившегося йода или любого другого вещества. |