Тема урока: «Газовые законы». 10 класс
Цель урока:
Образовательная: установить зависимость между двумя термодинамическими параметрами при неизменном третьем.
Развивающая: сформировать элементы творческого поиска на основе приема анализа ранее изученного материала.
Воспитательная: показать значение причинно-следственных связей в познаваемости явлений, развитие коммуникативных способностей учащихся.
Задачи урока:
Образовательные:
способствовать формированию навыков в анализе условий поставленной проблемы;
развивать умения делать выводы на основе анализа поставленной задачи;
развитие умений в построении математических действий ведущих к решению поставленной задачи;
на основе повторения ранее изученного материала углубить знания по данной теме,
способствовать развитию умений систематизировать полученные знания.
Развивающие:
развивать умения высказывать свою точку зрения, вести аргументированный разговор;
способствовать развитию навыков в умении переходить от общих законов и явлений к частным случаям(анализировать);
способствовать повышению уровня самостоятельности мышления школьников;
формирование элементов творческого поиска;
развитие абстрактного мышления.
Воспитательные:
побудить учащихся к активности;
способствовать приобретению опыта работы в команде;
создать условия для формирования навыков самооценки и самоанализа.
Оборудование:
презентация, таблицы, компьютер, проектор;
лабораторное оборудование для демонстрации опыта.
Ход урока
1.Подготовка учащихся к восприятию темы урока (5 мин.)
УЧИТЕЛЬ: На предыдущих уроках мы познакомились с уравнением состояния идеального газа. Ответьте на вопросы:
Какие параметры, характеризующие идеальный газ связывает между собой это уравнение?
Как могут изменяться данные параметры?
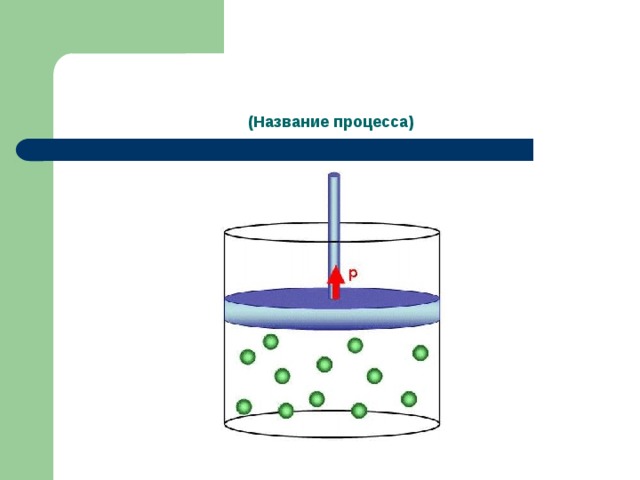
ДЕМОНСТРАЦИЯ ОПЫТА: изобарный процесс, протекающий с воздухом при изменении температуры (охлаждение и нагревание).
УЧИТЕЛЬ:
Скажите, как меняются макроскопические параметры, характеризующие воздух в колбе
при нагревании воздуха?
при охлаждении воздуха?
Какой параметр в этих процессах оставался неизменным? Почему вы так считаете?
2. Мотивация получения новых знаний ( 1 мин.)
Как мы только что убедились, с газами могут протекать процессы при которых один из параметров остается неизменным. Процессы, протекающие при неизменном значении одного из параметров, называются изопроцессами (записать термин на доске)- от греческого слова "изос"-равный. Конечно же такие процессы можно получить только в лабораторных условиях. Изопроцесс - это идеализированная модель реального процесса.
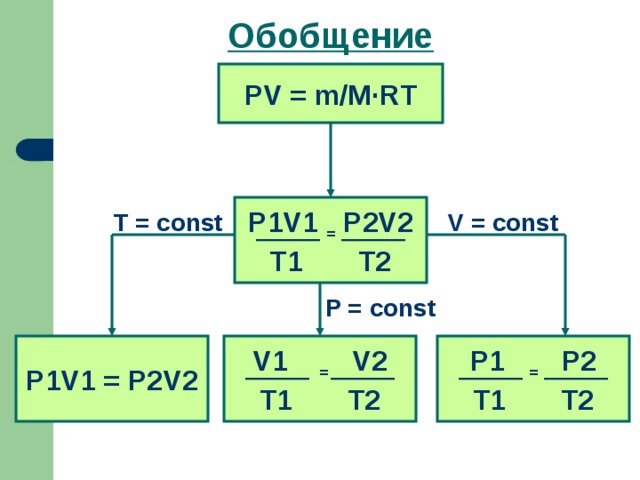
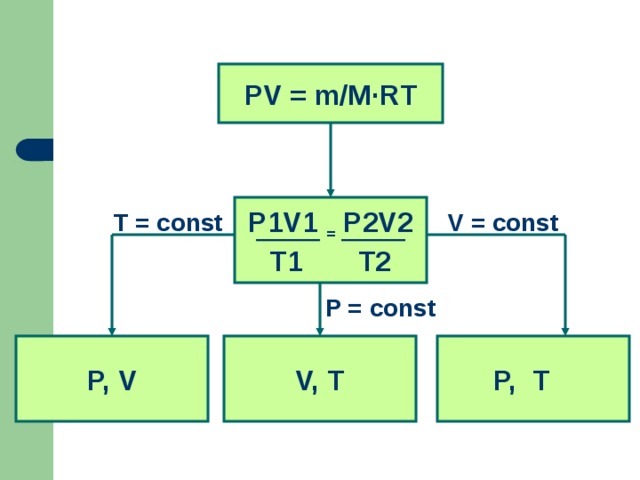
С помощью уравнения состояния идеального газа можно исследовать изопроцессы, в которых масса газа остается неизменной.
3.Постановка цели урока
УЧИТЕЛЬ:
Цель нашего урока выяснить количественные зависимости между двумя параметрами при неизменном третьем.
4.Создание проблемной ситуации (5 мин)
ВОПРОСЫ КЛАССУ:
Какие параметры могут оставаться неизменными?
Какое количество изопроцессов может происходить с газом? Перечислите их.
Как вы считаете какие вопросы мы должны рассмотреть по каждому процессу, чтобы наиболее полно охарактеризовать каждый процесс?
После обсуждения плана изучения процесса на экран выводится слайд1, обобщающий все сказанное.
5. Решение поставленной задачи на основе осмысления теоретического материала и его анализа.
Изложение нового материала
Изотермический процесс. Формулировка. История открытия закона (Закон установлен экспериментально до создания молекулярно-кинетической теории газов английским физиком Робертом Бойлем в 1660 году и французским физиком Эдмоном Мариоттом в 1676 году).
Примеры проявления закона СЛАЙД 5
Графики изотермических процессов. Анализ зависимостей на основе МКТ. СЛАЙДЫ 6, 7
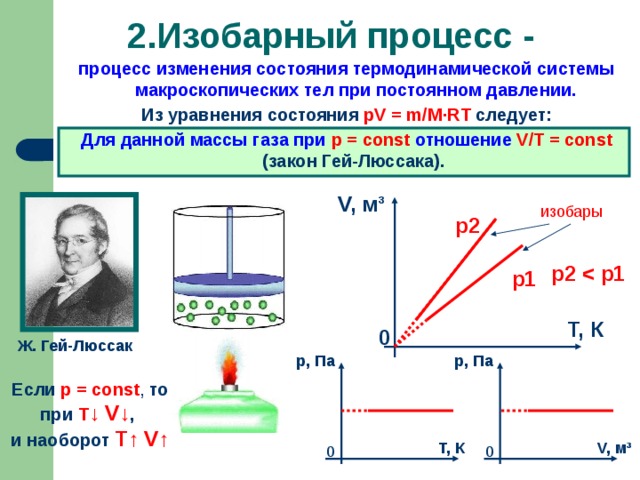
Изобарный процесс. Формулировка. История открытия (Закон установлен в 1802 году французским физиком Гей-Люссаком, который определяет объём газа при различных значениях температур в пределах от точки кипения воды. Газ содержали в баллончике, а в трубке находилась капля ртути, запирающая газ, расположенная горизонтально).
Примеры проявления закона.
Графики изобарных процессов. Анализ зависимостей на основе МКТ. СЛАЙД 9
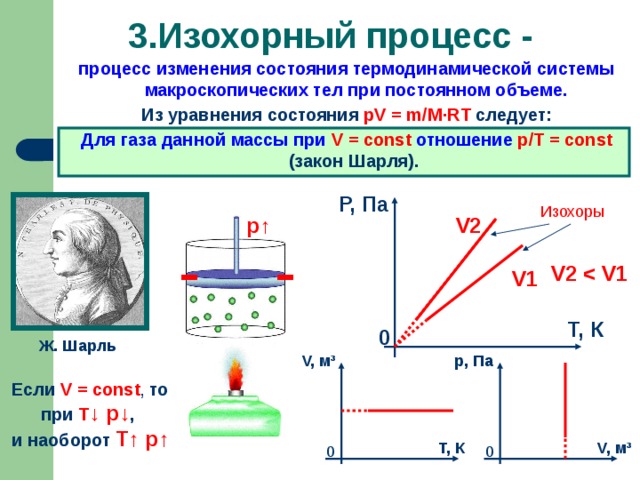
Изохорный процесс. Формулировка. История открытия (В 1787 году французский ученый Жак Шарль измерял давление различных газов при нагревании при постоянном объёме и установил линейную зависимость давления от температуры, но не опубликовал исследование. Через 15 лет к таким же результатам пришёл и Гей-Люссак и, будучи на редкость благородным, настоял, чтобы закон назывался в честь Шарля). Примеры проявления закона. СЛАЙД 10
Графики изохорных процессов. Анализ зависимостей на основе МКТ.
6. Систематизация материала и применение знаний.(8 мин.)
Учащимся предлагается заполнить таблицу для изотермического расширения. Слайд 6 Таблица заранее распечатана для каждого ученика и находится на партах. В дальнейшем вклеивается в тетрадь и используется, как справочный материал. Для самопроверки на экран выводится слайд 7. Обратить внимание учащихся на расстановку нумерации состояний газа на графиках. Уделить особое внимание объяснению связи между параметрами с точки зрения МКТ, так как этот вопрос вызывает наибольшие затруднения.
РЕШЕНИЕ ЗАДАЧ
7.Подведение итогов урока. (2 мин..)
Предложить учащимся самостоятельно определить итоги урока. Корректируя ответы учащихся , еще раз итог может подвести учитель.
УЧИТЕЛЬ: Сегодня на уроке мы познакомились с изопроцессами; проведя мысленный эксперимент и анализируя уравнение состояния идеального газа, выяснили, как взаимосвязаны два параметра при неизменном третьем.
8. Домашнее задание ( 2 мин.)
§ 65:








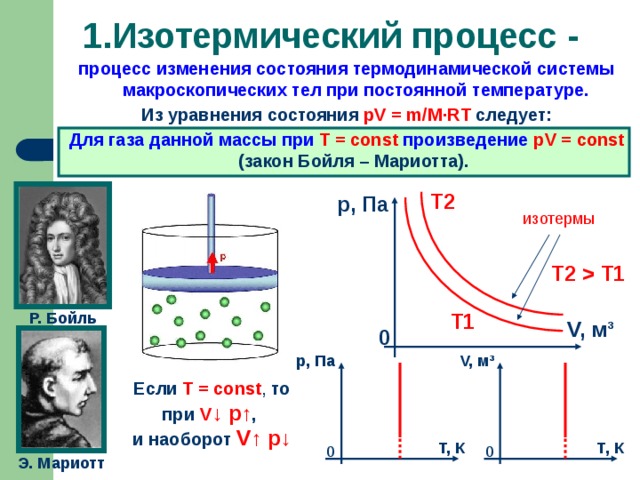 Т1 Р. Бойль Т1 V, м ³ 0 р, Па V, м ³ Если T = const , то при V ↓ p↑ , и наоборот V↑ p↓ Т, К Т, К 0 0 Э. Мариотт 6" width="640"
Т1 Р. Бойль Т1 V, м ³ 0 р, Па V, м ³ Если T = const , то при V ↓ p↑ , и наоборот V↑ p↓ Т, К Т, К 0 0 Э. Мариотт 6" width="640"