

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Фонд оценочных средств по дисциплине ООД11 Химия для специальности "Лечебное дело"
Цель фонда оценочных средств. Оценочные средства предназначены для контроля и оценки образовательных достижений обучающихся, освоивших программу учебной дисциплины ООД11.Химия. Перечень видов оценочных средств соответствует Рабочей программе дисциплины. Фонд оценочных средств включает контрольные материалы для проведения текущего контроля в форме тестовыхзаданий и промежуточной аттестации в форме тестовых заданий и практических заданий к экзамену. Структура и содержание заданий – задания разработаны в соответствии с рабочей программой дисциплины ООД11.Химия.
Просмотр содержимого документа
«Фонд оценочных средств по дисциплине ООД11 Химия для специальности "Лечебное дело"»
Государственное бюджетное профессиональное образовательное учреждение
«Саткинский медицинский колледж»
Утверждаю
Приказ №
Директор ГБПОУ
«Саткинский медицинский техникум»
__________________О.С. Галлямова
«____»______________20___г.
Фонд оценочных средств
учебной дисциплины
ООД 11 Химия
по специальности:
31.02.01 Лечебное дело
Сатка, 2023-2027
Фонд оценочных средств дисциплины ООД.11 Химия составлен в соответствии с требованиями ФГОС СПО по специальности 31.02.01 Лечебное дело
Организация-разработчик ГБПОУ «Саткинский медицинский колледж»
Разработчик: Сукшина Ю.В. – преподаватель
Рассмотрена на заседании предметно-цикловой комиссии обязательных общеобразовательных, социально-гуманитарных и общих профессиональных дисциплин.
Протокол № ___ от «___» _____________2023_г.
Председатель ________________ Р.Ф. Дмитренко
Утверждена:
Зам. директора по УР _____________А.Н. Гильмиярова
ОГЛАВЛЕНИЕ
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА………………………………………………………………..4
ПАСПОРТ ФОНДА ОЦЕНОЧНЫХ СРЕДСТВ………………………………………………4
2 КОНТРОЛЬНО-ОЦЕНОЧНЫЕ СРЕДСТВА ДЛЯ ИТОГОВОЙ АТТЕСТАЦИИ ПО УЧЕБНОЙ ДИСЦИПЛИНЕ……………………………………………………………………16
2.1. Вопросы к экзамену………………………………………………………………………..16
2.2. Задания к экзамену……………………………………………………………………...…19
3.КРИТЕРИИ ОЦЕНКИ………………………………………………………………………..32
Приложение 1……………………………………………………………………………...…...32
ШАБЛОН БЛАНКА К ЭКЗАМЕНУ…………………………………………………………..36
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ…………………………………………..37
Цель фонда оценочных средств. Оценочные средства предназначены для контроля и оценки образовательных достижений обучающихся, освоивших программу учебной дисциплины ООД11.Химия. Перечень видов оценочных средств соответствует Рабочей программе дисциплины.
Фонд оценочных средств включает контрольные материалы для проведения текущего контроля в форме тестовыхзаданий и промежуточной аттестации в форме тестовых заданий и практических заданий к экзамену.
Структура и содержание заданий – задания разработаны в соответствии с рабочей программой дисциплины ООД11.Химия.
ПАСПОРТ ФОНДА ОЦЕНОЧНЫХ СРЕДСТВ
Результатом освоения учебной дисциплины ООД.11 Химия являются предусмотренные ФГОС по специальности умения и знания, направленные на достижение следующих результатов.
Цели и планируемые результаты освоения дисциплины
1.2.1. Цели и задачи дисциплины
Формирование у студентов химической составляющей естественно-научной картины мира как основы принятия решений в жизненных и производственных ситуациях, ответственного поведения в природной среде.
Задачи дисциплины:
1) сформировать понимание закономерностей протекания химических процессов и явлений в окружающей среде, целостной научной картины мира, взаимосвязи и взаимозависимости естественных наук;
2) развить умения проводить расчеты по химическим формулам и уравнениям химических реакций, планировать и интерпретировать результаты химических экспериментов,
3) сформировать навыки проведения химических экспериментальных исследований с соблюдением правил безопасного обращения с веществами и лабораторным оборудованием;
4) развить умения анализировать, оценивать, проверять на достоверность и обобщать информацию химического характера из различных источников;
5) сформировать умения прогнозировать последствия своей деятельности и химических природных, бытовых и производственных процессов;
6) сформировать понимание значимости достижений химической науки и технологий для развития социальной и производственной сфер.
1.2.2. Планируемые результаты освоения общеобразовательной дисциплины в соответствии с ФГОС СПО и на основе ФГОС СОО
| Код и наименование формируемых компетенций | Планируемые результаты освоения дисциплины | |
| Общие | Дисциплинарные | |
| ОК 01. Выбирать способы решения задач профессиональной деятельности применительно к различным контекстам | В части трудового воспитания: - готовность к труду, осознание ценности мастерства, трудолюбие; - готовность к активной деятельности технологической и социальной направленности, способность инициировать, планировать и самостоятельно выполнять такую деятельность; - интерес к различным сферам профессиональной деятельности, Овладение универсальными учебными познавательными действиями: а) базовые логические действия: - самостоятельно формулировать и актуализировать проблему, рассматривать ее всесторонне; - устанавливать существенный признак или основания для сравнения, классификации и обобщения; - определять цели деятельности, задавать параметры и критерии их достижения; - выявлять закономерности и противоречия в рассматриваемых явлениях; - вносить коррективы в деятельность, оценивать соответствие результатов целям, оценивать риски последствий деятельности; - развивать креативное мышление при решении жизненных проблем б) базовые исследовательские действия: - владеть навыками учебно-исследовательской и проектной деятельности, навыками разрешения проблем; - выявлять причинно-следственные связи и актуализировать задачу, выдвигать гипотезу ее решения, находить аргументы для доказательства своих утверждений, задавать параметры и критерии решения; - анализировать полученные в ходе решения задачи результаты, критически оценивать их достоверность, прогнозировать изменение в новых условиях; - уметь переносить знания в познавательную и практическую области жизнедеятельности; - уметь интегрировать знания из разных предметных областей; - выдвигать новые идеи, предлагать оригинальные подходы и решения; - способность их использования в познавательной и социальной практике | - владеть системой химических знаний, которая включает: основополагающие понятия (химический элемент, атом, электронная оболочка атома, s-, p-, d-электронные орбитали атомов, ион, молекула, валентность, электроотрицательность, степень окисления, химическая связь, моль, молярная масса, молярный объем, углеродный скелет, функциональная группа, радикал, изомерия, изомеры, гомологический ряд, гомологи, углеводороды, кислород- и азотсодержащие соединения, биологически активные вещества (углеводы, жиры, белки), мономер, полимер, структурное звено, высокомолекулярные соединения, кристаллическая решетка, типы химических реакций (окислительно-восстановительные, экзо- и эндотермические, реакции ионного обмена), раствор, электролиты, неэлектролиты, электролитическая диссоциация, окислитель, восстановитель, скорость химической реакции, химическое равновесие), теории и законы (теория химического строения органических веществ А.М. Бутлерова, теория электролитической диссоциации, периодический закон Д.И. Менделеева, закон сохранения массы), закономерности, символический язык химии, фактологические сведения о свойствах, составе, получении и безопасном использовании важнейших неорганических и органических веществ в быту и практической деятельности человека; - уметь выявлять характерные признаки и взаимосвязь изученных понятий, применять соответствующие понятия при описании строения и свойств неорганических и органических веществ и их превращений; выявлять взаимосвязь химических знаний с понятиями и представлениями других естественнонаучных предметов; - уметь использовать наименования химических соединений международного союза теоретической и прикладной химии и тривиальные названия важнейших веществ (этилен, ацетилен, глицерин, фенол, формальдегид, уксусная кислота, глицин, угарный газ, углекислый газ, аммиак, гашеная известь, негашеная известь, питьевая сода и других), составлять формулы неорганических и органических веществ, уравнения химических реакций, объяснять их смысл; подтверждать характерные химические свойства веществ соответствующими экспериментами и записями уравнений химических реакций; - уметь устанавливать принадлежность изученных неорганических и органических веществ к определенным классам и группам соединений, характеризовать их состав и важнейшие свойства; определять виды химических связей (ковалентная, ионная, металлическая, водородная), типы кристаллических решеток веществ; классифицировать химические реакции; - сформировать представления: о материальном единстве мира, закономерностях и познаваемости явлений природы; о месте и значении химии в системе естественных наук и ее роли в обеспечении устойчивого развития человечества: в решении проблем экологической, энергетической и пищевой безопасности, в развитии медицины, создании новых материалов, новых источников энергии, в обеспечении рационального природопользования, в формировании мировоззрения и общей культуры человека, а также экологически обоснованного отношения к своему здоровью и природной среде; - владеть системой химических знаний, которая включает: основополагающие понятия (дополнительно к системе понятий базового уровня) - изотопы, основное и возбужденное состояние атома, гибридизация атомных орбиталей, химическая связь (" - уметь проводить расчеты по химическим формулам и уравнениям химических реакций с использованием физических величин (массы, объема газов, количества вещества), характеризующих вещества с количественной стороны: расчеты по нахождению химической формулы вещества; расчеты массы (объема, количества вещества) продукта реакции, если одно из исходных веществ дано в виде раствора с определенной массовой долей растворенного вещества или дано в избытке (имеет примеси); расчеты массовой или объемной доли выхода продукта реакции; расчеты теплового эффекта реакций, объемных отношений газов; - уметь выявлять характерные признаки и взаимосвязь изученных понятий, применять соответствующие понятия при описании строения и свойств неорганических и органических веществ и их превращений; выявлять взаимосвязь химических знаний с понятиями и представлениями других предметов для более осознанного понимания и объяснения сущности материального единства мира; использовать системные химические знания для объяснения и прогнозирования явлений, имеющих естественнонаучную природу; -уметь использовать наименования химических соединений международного союза теоретической и прикладной химии и тривиальные названия веществ, относящихся к изученным классам органических и неорганических соединений; использовать химическую символику для составления формул неорганических веществ, молекулярных и структурных (развернутых, сокращенных и скелетных) формул органических веществ; составлять уравнения химических реакций и раскрывать их сущность: окислительно-восстановительных реакций посредством составления электронного баланса этих реакций; реакций ионного обмена путем составления их полных и сокращенных ионных уравнений; реакций гидролиза, реакций комплексообразования (на примере гидроксокомплексов цинка и алюминия); подтверждать характерные химические свойства веществ соответствующими экспериментами и записями уравнений химических реакций; - уметь классифицировать неорганические и органические вещества и химические реакции, самостоятельно выбирать основания и критерии для классификации изучаемых химических объектов; характеризовать состав и важнейшие свойства веществ, принадлежащих к определенным классам и группам соединений (простые вещества, оксиды, гидроксиды, соли; углеводороды, простые эфиры, спирты, фенолы, альдегиды, кетоны, карбоновые кислоты, сложные эфиры, жиры, углеводы, амины, аминокислоты, белки); применять знания о составе и свойствах веществ для экспериментальной проверки гипотез относительно закономерностей протекания химических реакций и прогнозирования возможностей их осуществления; - уметь подтверждать на конкретных примерах характер зависимости реакционной способности органических соединений от кратности и типа ковалентной связи (" - уметь характеризовать электронное строение атомов (в основном и возбужденном состоянии) и ионов химических элементов 1 - 4 периодов Периодической системы Д.И. Менделеева и их валентные возможности, используя понятия "s", "p", "d-электронные" орбитали, энергетические уровни; объяснять закономерности изменения свойств химических элементов и образуемых ими соединений по периодам и группам; |
| ОК 02. Использовать современные средства поиска, анализа и интерпретации информации и информационные технологии для выполнения задач профессиональной деятельности | В областиценности научного познания: - сформированность мировоззрения, соответствующего современному уровню развития науки и общественной практики, основанного на диалоге культур, способствующего осознанию своего места в поликультурном мире; - совершенствование языковой и читательской культуры как средства взаимодействия между людьми и познания мира; - осознание ценности научной деятельности, готовность осуществлять проектную и исследовательскую деятельность индивидуально и в группе; Овладение универсальными учебными познавательными действиями: в) работа с информацией: - владеть навыками получения информации из источников разных типов, самостоятельно осуществлять поиск, анализ, систематизацию и интерпретацию информации различных видов и форм представления; - создавать тексты в различных форматах с учетом назначения информации и целевой аудитории, выбирая оптимальную форму представления и визуализации; - оценивать достоверность, легитимность информации, ее соответствие правовым и морально-этическим нормам; - использовать средства информационных и коммуникационных технологий в решении когнитивных, коммуникативных и организационных задач с соблюдением требований эргономики, техники безопасности, гигиены, ресурсосбережения, правовых и этических норм, норм информационной безопасности; - владеть навыками распознавания и защиты информации, информационной безопасности личности; | - уметь планировать и выполнять химический эксперимент (превращения органических веществ при нагревании, получение этилена и изучение его свойств, качественные реакции на альдегиды, крахмал, уксусную кислоту; денатурация белков при нагревании, цветные реакции белков; проводить реакции ионного обмена, определять среду водных растворов, качественные реакции на сульфат-, карбонат- и хлорид-анионы, на катион аммония; решать экспериментальные задачи по темам "Металлы" и "Неметаллы") в соответствии с правилами техники безопасности при обращении с веществами и лабораторным оборудованием; представлять результаты химического эксперимента в форме записи уравнений соответствующих реакций и формулировать выводы на основе этих результатов; - уметь анализировать химическую информацию, получаемую из разных источников (средств массовой информации, сеть Интернет и другие); - владеть основными методами научного познания веществ и химических явлений (наблюдение, измерение, эксперимент, моделирование); - уметь проводить расчеты по химическим формулам и уравнениям химических реакций с использованием физических величин, характеризующих вещества с количественной стороны: массы, объема (нормальные условия) газов, количества вещества; использовать системные химические знания для принятия решений в конкретных жизненных ситуациях, связанных с веществами и их применением; - уметь самостоятельно планировать и проводить химический эксперимент (получение и изучение свойств неорганических и органических веществ, качественные реакции углеводородов различных классов и кислородсодержащих органических веществ, решение экспериментальных задач по распознаванию неорганических и органических веществ) с соблюдением правил безопасного обращения с веществами и лабораторным оборудованием, формулировать цели исследования, предоставлять в различной форме результаты эксперимента, анализировать и оценивать их достоверность; - уметь осуществлять целенаправленный поиск химической информации в различных источниках (научная и учебно-научная литература, средства массовой информации, сеть Интернет и другие), критически анализировать химическую информацию, перерабатывать ее и использовать в соответствии с поставленной учебной задачей; - владеть системой знаний о методах научного познания явлений природы, используемых в естественных науках и умениями применять эти знания при экспериментальном исследовании веществ и для объяснения химических явлений, имеющих место в природе практической деятельности человека и в повседневной жизни; |
| ОК 04. Эффективно взаимодействовать и работать в коллективе и команде | - готовность к саморазвитию, самостоятельности и самоопределению; -овладение навыками учебно-исследовательской, проектной и социальной деятельности; Овладение универсальными коммуникативными действиями: б) совместная деятельность: - понимать и использовать преимущества командной и индивидуальной работы; - принимать цели совместной деятельности, организовывать и координировать действия по ее достижению: составлять план действий, распределять роли с учетом мнений участников обсуждать результаты совместной работы; - координировать и выполнять работу в условиях реального, виртуального и комбинированного взаимодействия; - осуществлять позитивное стратегическое поведение в различных ситуациях, проявлять творчество и воображение, быть инициативным Овладение универсальными регулятивными действиями: г) принятие себя и других людей: - принимать мотивы и аргументы других людей при анализе результатов деятельности; - признавать свое право и право других людей на ошибки; - развивать способность понимать мир с позиции другого человека; | - уметь планировать и выполнять химический эксперимент (превращения органических веществ при нагревании, получение этилена и изучение его свойств, качественные реакции на альдегиды, крахмал, уксусную кислоту; денатурация белков при нагревании, цветные реакции белков; проводить реакции ионного обмена, определять среду водных растворов, качественные реакции на сульфат-, карбонат- и хлорид-анионы, на катион аммония; решать экспериментальные задачи по темам "Металлы" и "Неметаллы") в соответствии с правилами техники безопасности при обращении с веществами и лабораторным оборудованием; представлять результаты химического эксперимента в форме записи уравнений соответствующих реакций и формулировать выводы на основе этих результатов; -уметь самостоятельно планировать и проводить химический эксперимент (получение и изучение свойств неорганических и органических веществ, качественные реакции углеводородов различных классов и кислородсодержащих органических веществ, решение экспериментальных задач по распознаванию неорганических и органических веществ) с соблюдением правил безопасного обращения с веществами и лабораторным оборудованием, формулировать цели исследования, предоставлять в различной форме результаты эксперимента, анализировать и оценивать их достоверность; |
| ОК 07. Содействовать сохранению окружающей среды, ресурсосбережению, применять знания об изменении климата, принципы бережливого производства, эффективно действовать в чрезвычайных ситуациях | В областиэкологического воспитания: - сформированность экологической культуры, понимание влияния социально-экономических процессов на состояние природной и социальной среды, осознание глобального характера экологических проблем; - планирование и осуществление действий в окружающей среде на основе знания целей устойчивого развития человечества; активное неприятие действий, приносящих вред окружающей среде; - умение прогнозировать неблагоприятные экологические последствия предпринимаемых действий, предотвращать их; - расширение опыта деятельности экологической направленности; - овладение навыками учебно-исследовательской, проектной и социальной деятельности; | - сформировать представления: о химической составляющей естественнонаучной картины мира, роли химии в познании явлений природы, в формировании мышления и культуры личности, ее функциональной грамотности, необходимой для решения практических задач и экологически обоснованного отношения к своему здоровью и природной среде; - уметь соблюдать правила экологически целесообразного поведения в быту и трудовой деятельности в целях сохранения своего здоровья и окружающей природной среды; учитывать опасность воздействия на живые организмы определенных веществ, понимая смысл показателя предельной допустимой концентрации; - уметь прогнозировать, анализировать и оценивать с позиций экологической безопасности последствия бытовой и производственной деятельности человека, связанной с переработкой веществ; использовать полученные знания для принятия грамотных решений проблем в ситуациях, связанных с химией; - уметь осознавать опасность воздействия на живые организмы определенных веществ, понимая смысл показателя предельной допустимой концентрации, и пояснять на примерах способы уменьшения и предотвращения их вредного воздействия на организм человека. |
| ПК 1.2. Обеспечивать соблюдение санитарно-эпидемиологических правил и нормативов медицинской организации; | Владение навыками проведения ежедневной влажной и генеральной уборки палат, помещений, кабинетов с использованием; дезинфицирующих и моющих средств | Уметь производить уборку помещений, в том числе с применением дезинфицирующих и моющих средств; применять разрешенные для обеззараживания воздуха оборудование и химические средства; использовать моющие и дезинфицирующие средства при дезинфекции предметов ухода, оборудования, инвентаря, емкостей многократного применения для медицинских отходов; знать правила хранения уборочного инвентаря, дезинфицирующих и моющих средств инструкции по применению моющих и дезинфицирующих средств, используемых в медицинской организации |
| ПК 2.2. Назначать и проводить лечение неосложненных острых заболеваний и (или) состояний, хронических заболеваний и их обострений, травм, отравлений; | владеть навыками отпуска и применения лекарственных препаратов, включая наркотические лекарственные препараты и психотропные лекарственные препараты, в случае возложения на фельдшера отдельных функций лечащего врача пациентам, нуждающимся в лечении и обезболивании; реализации лекарственных препаратов и медицинских изделий при оказании первичной доврачебной медико-санитарной помощи; | Уметь применять лекарственные препараты, специальные продукты лечебного питания и медицинские изделия при заболеваниях и (или) состояниях, опровождающихся угрозой жизни пациента, с учетом возрастных особенностей, в том числе по назначению врача; Знать методы применения лекарственных препаратов, медицинских изделий и лечебного питания при заболеваниях и (или) состояниях у детей и взрослых |
| ПК 4.2. Проводить санитарно-гигиеническое просвещение населения | Владеть навыками проведения мероприятий по формированию здорового образа жизни у населения; проведения индивидуального и группового профилактического консультирования населения, в том числе несовершеннолетних | Уметь проводить работу по реализации программ здорового образа жизни, проводить индивидуальные (групповые) беседы с населением в пользу здорового образа жизни, по вопросам личной гигиены, гигиены труда и отдыха, здорового питания, по уровню физической активности формировать общественное мнение в пользу здорового образа жизни, мотивировать население на здоровый образ жизни или изменение образа жизни, улучшение качества жизни. Знать рекомендации по профилактике заболеваний. |
2. КОНТРОЛЬНО-ОЦЕНОЧНЫЕ СРЕДСТВА ДЛЯ ПРОМЕЖУТОЧНОЙ АТТЕСТАЦИИ ПО УЧЕБНОЙ ДИСЦИПЛИНЕ
4.1 Вопросы для экзамена
Предмет, задачи, значение химии
Периодический закон и периодическая система Д. И. Менделеева
Строение атома
Виды химической связи. Валентность, степень окисления
Кристаллические решетки. Чистые вещества и смеси.
Виды дисперсных систем. Сущность процесса растворения
Способы выражения концентрации растворов
Скорость химических реакций . Катализ
Классификация химических реакций. Тепловой эффект реакций.
ОВР. Электролиз. Коррозия металлов
Химическое равновесия . Смещение химического равновесия
Диссоциация электролитов в водных растворах
Реакции ионного обмена в водных растворах
Гидролиз солей
Водород, галогены: положение в периодической системе, свойства, соединения
Кислород: положение в положительной системе, свойства, оксиды и пероксиды
Сера: аллотропия, свойства, нахождение в природе, применение, соединения
Азот: свойства, нахождение в природе, применение, получение, основные соединения
Фосфор: свойства, нахождение в природе, аллотропия, свойства, соединения
Углерод: аллотропия, свойства, применение, получение, соединения
Кремний: аллотропия, свойства, применение, получение
Щелочные металлы: общая характеристика, свойства, применение, получение, соединения
Щелочноземельные металлы: общая характеристика, свойства, применение, получение
Алюминий: свойства, применение, получение, соединения
Переходные элементы( серебро, марганец,медь, цинк, хром, ртуть ) : особенности строения, свойства, соединения
Предмет органической химии. Классификация органических соединений
Теория химического строения органических соединений. Изомерия
Строение метана
Строение и номенклатура углеводородов ряда метана
Химические свойства алканов
Получение и применение алканов
Циклопарафины
Этилен: гомологический ряд, изомерия и номенклатура
Химические свойства, применение и получение алкенов
Понятие о диеновых углеводородах
Природный каучук
Ацетилен и его гомологи
Арены: строение, свойства, применение
Гомологи бензола. Понятие о ядохимикатах
Природный и попутный нефтяной газы. Нефть
Переработка нефти. Коксохимическое производство
Строение и номенклатура предельных одноатомных спиртов
Химические свойства спиртов
Применение и получение спиртов
Многоатомные спирты
Фенолы: строение, свойства, применение, получение
Альдегиды и кетоны: строение , свойства, применение, получение
Одноосновные карбоновые кислоты
Жирные высокомолекулярные кислоты
Строение и свойства сложных эфиров
Жиры. Понятие о СМС
Строение и свойства рибозы, дезоксирибозы, сахарозы
Крахмал
Целлюлоза. Ацетатное волокно
Амины: строение , свойства, применение, получение
Понятие о азотосодержащих гетероциклах
Аминокислоты
Белки
Нуклеиновые кислоты
Общее понятие химии высокомолекулярных соединений
Полимерные материалы
Синтетические волокна
Синтетический каучук
Биологически активные соединения
Химия в повседневной жизни
Химия в быту и производственной деятельности человека
Основы лабораторной практики в профессиональных лабораториях
Химический анализ проб воды
Жесткость воды: виды, способы устранения
Химический контроль качества продуктов питания
Химический анализ проб почвы
Области использования удобрений в зависимости от качественного состава почвы
Задания для проведения экзамена по ООД 11 Химия
Задание 1: выберите один верный ответ.
Верные ответы выделены жирным шрифтом!
1.На какие ионы диссоциирует HCl:
а. H+ и Сl-
б.H- и Сl+
в. HCl-
г. Не диссоциирует
2.Общая формула алканов:
а.CnH2n
б. CnH2n+2
в. CnH2n-2
г. CnH2n-6
3. К неорганическим соединениям относят:
а. Н2О
б. СН4
в. С2Н2
г. С2Н4
4.Укажите химическую реакцию, которая относится к реакциям разложения:
а. CaCO3 = CaO + CO2
б. 2NaOH + CuSO4 = Cu(OH)2 + Na2SO4
в. 2H2 + O2 = 2H2O
г. CuSO4 + Fe = FeSO4 + Cu
5.К какому типу относится данная химическая реакция CuSO4 + Fe = FeSO4 + Cu
а. разложение
б. соединение
в. обмен
г. замещение
6.Процесс диссоциации азотной кислоты можно выразить уравнением диссоциации:
а. HNO3 = H+ + 3NO-
б. HNO3 = 3H+ + 3NO-
в. HNO3 = H+ + NO3-
г. HNO3 = H- + NO3-
7.Все общие свойства оснований обусловлены наличием:
а.анионов кислотного остатка
б. катионов водорода
в. гидроксид-ионов
г. катионов металлов
8.К какому классу неорганических соединений относится Са(OH)2?
а.оснóвные соли
б. оснóвные оксиды
в. основания
г. амфотерные гидроксиды
9. К какому классу неорганических соединений относится P2O5?
а. кислородосодержащая кислота
б. несолеобразующий оксид
в. кислотный оксид
г. средняя соль
10. Какова формула дигидрофосфата натрия?
а. Na3PO4
б. Na2HPO4
в. NaH2PO4
г. NaPO2
11. Формула кислотного оксида, соответствующего кислоте H3PO4:
а. P2O5
б. P2O3
в. PН3
г. Н3PO3
12. Какое соединение является представителем кислородосодержащих кислот?
а. H2SO3
б. HCl
в. Н2S
г. SO2
13.Укажите ряд, содержащий только кислотные оксиды:
а. Na2O, СаО, СО2
б. SO2, CuO, CrO3
в. Mn2O7, CuO, CrO3
г. SO3, СО2, P2O5
14.Какое из веществ при растворении в воде образует кислоту:
а. NaCl
б. СаО
в. SO3
г. NH3
15.Может быть красным, черным или белым:
а. кислород
б. азот
в. сера
г. фосфор
16.Формула оксида углерода (II):
а. CO
б. H2CO3
в. CO2
г. C2H2
17.Формула озона:
а. O
б. O2
в. O3
г. N2
18.Какое из перечисленных веществ является простым?
а. хлорид натрия
б. вода
в. кислород
г. оксид кальция
19.Оксиды – это:
а. сложные вещества, состоящие из атомов нескольких химических элементов, один из которых неметалл
б. сложные вещества, состоящие из атомов двух химических элементов, один из которых кислород
в. сложные вещества, состоящие из атомов нескольких химических элементов, один из которых металл
г. сложные вещества, состоящие из атомов нескольких химических элементов, один из которых простое вещество
20. Молекула оксида алюминия (III) имеет формулу:
а. Al3O4
б. AlCl3
в. Al2O3
г. AlI3
21. Какое из перечисленных веществ является простым?
а. оксид меди (II)
б. поваренная соль
в. хлорид цинка
г. азот
22. Запись 2MgО означает:
а. два моль оксида магния
б. два атома вещества оксида магния
в. две молекулы вещества магния и две молекулы вещества кислорода
г. два атома магния и один атом кислорода
23.Из приведенных ниже веществ выберите электролит:
а. раствор сахара
б. раствор поваренной соли
в. бензин
г. растительное масло
24. Из приведенных ниже частиц укажите катион:
а. К0
б. H2
в. S2–
г. Na+
25. Частица, имеющая отрицательный заряд, называется:
а. анион
б. катион
в. атом
г. молекула
26. Литий имеет порядковый номер 3. Укажите электронную конфигурацию атома лития:
а. 1s22s2
б. 1s22s1
в. 1s1
г. 1s22s22p2
27.Положительно заряженный электрод:
а. катод
б. анод
в. соленоид
г. гидрат
28. Какая из приведенных ниже электронных конфигураций соответствует атому кислородa?
а. 1s22s22p2
б. 1s22s22p6
в. 1s22s22p4
г. 1s22s22p63s2
29.Качественная реакция на серную кислоту:
а. H2SO4 + KOH = ...
б. H2SO4 + BaCl2 = ...
в. H2SO4 + Сu = ...
г. H2SO4 + Na2O = ...
30.Вещество, ускоряющее ход реакции, но при этом не расходующееся:
а. ингибитор
б. катализатор
в. индикатор
г.полимер
31.Атом фосфора имеет конфигурацию:
а. 1s22s22p63s23p3
б. 1s22s22p5
в. 1s22s22p63s23p64s2
г. 1s22s22p63s23p5
32.Летучее водородное соединение азота имеет формулу:
а. NH2
б. N2H4
в. NH3
г. NО2
33.Графит является аллотропным видоизменением:
а. кислорода
б. углерода
в. фосфора
г. азота
34. Примером щелочи служит:
а. Cu(OH)2
б. Mg(OH)2
в. KOH
г. CaO
35.Формула питьевой соды:
а. NaCl
б. NaHCO3
в. Na2SO4
г. K2CO3
36. По какой формуле можно рассчитать концентрацию раствора?
а. 
б. 
в.
г.
37. Реакции, при которых из одного сложного вещества образуются 2 и более простых или сложных, но более простого состава, вещества, называются реакциями:
а. замещения
б. обмена
в.соединения
г. разложения
38. Какое уравнение химической реакции соответствует схеме:
сульфат меди (II) + гидроксид натрия = гидроксид меди (II) + сульфат натрия
а. CuSO4 + NaOH = CuOH + NaSO4
б. Cu2SO4 + 2NaOH = 2Cu(OH)2 + Na2SO4
в. CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
г. Cu2SO4 +2NaOH = 2CuOH + Na2SO4
39. Тритий - этоизотоп:
а. титана
б. водорода
в. хлора
г. гелия
40. Как называются электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка:
а. оксиды
б. соли
в. кислоты
г. основания
41. 2Н2+ О2= 2 Н2О - это реакция:
а. Разложения
б. Соединения
в. Обмена
г. Замещения
42. CaCO3 →CaO + CO2 – реакция:
а. Обмена
б. Соединения
в. Разложения
г. Замещения
43.Электронная конфигурация наружного электронного слоя атома углерода в возбужденном состоянии:
а. 3s23p2
б. 2s22p2
в. 2s12p3
г. 1s22s22p2
44.Формулы только основных солей указаны в ряду:
а. CuCl2, NaHSO3, (AlOH)Cl2
б.Ca(HCO3)2, ZnS, (FeOH)Cl
в. (FeOH)NO3, (CuOH)2CO3, MgOHCl
г. CuCl2, MgOHCl, NaHSO3
45. К органическим соединениям относят:
а. H2O
б. HNO3
в. CH4
г. CuCl2
46. Горизонтальный ряд элементов, расположенных по возрастанию порядкового номера:
а. Период
б. Группа
в. Подгруппа
47. Связь, характерная для неметаллов одинакового строения:
а. Неполярная
б. Ионная
в. Водородная
г. Металлическая
48. Вещества, при растворении проводящие электрический ток:
а. Неэлектролиты
б. Коллоиды
в. Электролиты
г.Суспензии
49. Жесткая вода содержит ионы:
а. Ca2+ , Mg2+
б. Na+ , Li+
в. Al3+ ,Ga3+
г. Н+, Ва2+
50. Самый активный окислитель:
а. хлор
б. бром
в. фтор
г. иод
51. Жидкий металл при комнатной температуре:
а. Ртуть
б. Железо
в. Кальций
г. Барий
52. Какая из кислот является двухосновной?
а. НNО2
б.Н2СО3
в.Н3ВО3
г. НСl
53.На какие ионы диссоциируетNaOH?
а. Na+ , OH-
б. Na- , OH+
в. NaOH+
г. не диссоциирует
54. Имеет кислую реакцию среды:
а.HNO3
б.Na2О
в.ВаСl2
г. NaOH
55. Разрушение металлов и сплавов под действием окружающей среды:
а. Коррозия
б. Электролиз
в. Гидролиз
г.Дегидратация
56. Атом углерода в органических соединениях всегда имеет валентность:
а. I
б. II
в. IV
г. не имеет постоянной валентности
57.Масса вещества рассчитывается по формуле:
а. m= ν *М
б. m= M / ν
в. m= ν/ M
г. m= ν2
58. Вещества, при растворении не проводящие электрический ток:
а. Неэлектролиты
б. Коллоиды
в. Электролиты
г. Суспензии
59. Тяжелая вода содержит:
а. протий
б. тритий
в. дейтерий
г. все перечисленное верно
60. Периодический закон химических элементов сформулировал:
а. Менделеев
б. Бутлеров
в. Берцеллиус
г. Ломоносов
61. Какие металлы относятся к щелочно-земельным:
а. Na, Mg, Al;
б. K, Li, Na;
в. Be, Mg, Ca
г. Нg, Cd, Zn
62. Какие металлы относятся к щелочным:
а. Na, Mg, Al;
б. K, Li, Na;
в. Ca, Sr, Ba
г. Нg, Cd, Zn
63.Каким из следующих элементов могут соответствовать ионы с зарядом+ 3?
а. Ca
б. O
в. Fe
г. F
64.Формула основания:
а. HNO3
б. Ca(OH)2
в.N2O5
г. Н2О
65.Карбонат кальция – это:
а.оксид
б. кислота
в. соль
г.щелочь
66.Какой из кислот соответствует название «сернистая кислота»:
а. Н2S
б. Н2S2О3
в. Н2SО3
г. Н2SО4
67. Какие из следующих веществ являются кристаллогидратами?
а. К2SO3
б. 
в.
г. AlOH)Cl2
68. Знак химического элемента железо:
а.F
б.Fe
в.Ge
г. Ga
69. Смесью является:
а. вода
б. сахар
в. соляная кислота
г. иод
70. По какой формуле можно рассчитать массовую долю растворенного вещества?
а.
б.
в. 
г.m= ν/ M
71.Общая формула алканов:
а.CnH2n
б. CnH2n+2
в. CnH2n-2
г.CnH2n-6
72. Изсинтез - газа получают:
а. Этанол
б. Метанол
в. Пропанол
г. Бутанол
73. Общая формула альдегидов:
а. СnH2n+1OH
б. R – COOH
в. R – COH
г. CnH2n-6
74. В реакцию «серебряного зеркала» вступает:
а. HCOH
б.C 2H2
в.C2H5OH
г. С2Н4
75.Тип гибридизации атомов С в ацетилене:
а. sp3
б. sp2
в. sp
76.Реакции гидрирования соответствует схема:
а. … +H2O→C2Н5ОН
б. …+Н2→С3Н8
в. …→С2Н4+Н2
г. …→С2Н4+Н2О
77.Валентный угол НСН в ацетилене:
а. 10928
б. 120
в. 180
г. 1600
78.Для приготовления антифризов применяют:
а. этанол
б. этилацетат
в. этиленгликоль
г. метан
79. К органическим соединениям относят:
а. H2O
б. HNO3
в. CH4
г. СО
80 Реакции брожения характерны для:
а. Спиртов
б. Альдегидов
в. Углеводов
г. Кетонов
81.Углеводород, содержащий тройную связь:
а. С4Н6
б. С4Н8
в. С4Н10
г. Все перечисленное верно
82. Общая формула алкенов:
а. СnH2n+2
б. СnH2n-6
в. СnН2n
г. . R – COOH
83.Метанол получают из:
а. При брожении глюкозы
б.Из Этилена
в. Из синтез – газа
г. Из метана
84.Общая формула алкинов:
а. CnH2n
б.CnH2n+2
в. CnH2n-2
г. . СnH2n-6
85. Органические вещества сгорают до:
а. Углерода и водорода
б. Кислорода и водорода
в. Углекислого газа и воды
г. Угарного газа и воды
86. Теорию химического строения органических соединений сформулировал:
а. Берцеллиус
б. Бутлеров
в. Лебедев
г. Ломоносов
87. Реакция дегидратации характерна для вещества, формула которого:
а. С3Н6
б. С2Н5ОН
в. С3Н8
г. С4Н10
88. Атом углерода в органических соединениях всегда имеет валентность:
а. I
б. II
в. IV
г. Валентность переменная
89. В реакцию «Серебрянного зеркала» не вступает:
а. НСОН
б. НСООН
в. СН3СООН
г. СН3СОН
90. Формула этана:
а. СH4
б. C2H6
в.C3H8
г. С2Н4
91. Формула этилена:
а. С2Н6
б. С2Н4
в. С2Н2
г. C3H8
92. Для алканов наиболее характерны реакции:
а. присоединения
б. замещения
в. полимеризации
г. дегидратации
93. Гомологом этилена является:
а. этан
б. ацетилен
в. бутен-1
г. метан
94.Натуральный каучук получают из:
а. Гевеи
б. Дуба
в. Сосны
г. Березы
95. Формула уксусной кислоты:
а. СН3СООН
б. С2Н5ОН
в. С6Н12О6
г. СН3СОН
96.Присоединение галогеноводородов к алкенам происходит по правилу:
а. Марковникова
б. Менделеева
в. Бутлерова
г. Лебедева
97. Реакции замещения характерны для:
а. Метана
б. Этилена
в. Ацетилена
г. Бутилена
98. Пространственная изомерия характерна для:
а. Алканов
б. Алкенов
в. Алкинов
г. Аренов
99.Общая формула карбоновых кислот:
а. R- OH
б. R-COOH
в. R- COH
г. R- O- R1
100. В результате реакции брожения образуется:
а. Этан
б. Этаналь
в. Этанол
г.Этен
101. Для автогенной сварки используют:
а. Ацетилен
б. Метан
в. Этан
г. Этилен
102. Формула бензола:
а.СН4
б.С 2H5OH
в.C6H6
г. С6Н12О6
103.Первичная переработка нефти:
а. Пиролиз
б. Крекинг
в. Перегонка
г. Возгонка
104. Спирты, содержащие 2 гидроксогруппы, называют:
а. Диолы
б. Триолы
в. Тетраолы
г. Гидратированные
105. Для получения этилового эфира муравьиной кислоты необходимо взять:
а. НСООН и СН3ОН
б. СН3СООН и СН3ОН
в. НСООН и С2Н5ОН
г. НСООН и СН3СООН
106. Вещество, которое можно обнаружить по запаху:
а. глицерин
б. глюкоза
в. уксусная кислота
г. фруктоза
107. Общая формула спиртов:
а. CnH2n+2
б. R-COH
в.R-OH
г. R- O- R1
108.Спирты, содержащие 3гидроксогруппы называют:
а. Диолы
б. Триолы
в. Тетраолы
г. Гидратированные
109. Карбоксильную группу содержат:
а. Спирты
б. Альдегиды
в. Карбоновые кислоты
г. Кетоны
110.Подсластитель вин и лимонадов:
а.Метанол
б. Метан
в. Глицерин
г.Этанол
111.В качестве моторного топлива используют:
а.Метанол
б. Уксусную кислоту
в. Фенол
г. Анилин
112. В состав валидола входит:
а.Изовалерьяновая кислота
б.Пальмитиновая кислота
в. Олеиновая кислота
г. Линолевая кислота
113. Для сохранности анатомических препаратов используется:
а. Формалин
б. Уксус
в. Бензол
г. Фенол
114.Диметилпропан относится к классу углеводородов, общая формула которого:
а. CnH2n+2
б. CnH2n -2
в. CnH2n
г. CnH2n+1
115.Какой вид изомерии имеют алканы:
а. положения двойной связи
б. углеродного скелета
в. пространственная
г. межклассовая
116. Число σ-связей в молекуле хлорметана:
а. 1
б. 2
в.3
г. 4
117. Валентный угол в молекулах алканов составляет:
а. 109028
б. 1800
в. 1200
г. 104,50
118.Пропан взаимодействует с:
а. бромом
б. хлороводородом
в. водородом
г. гидроксидом натрия (р-р).
119.Алкан, молекула которого содержит 6 атомов углерода, имеет формулу:
а. C6H14
б. C6H12
в. C6H10
г. C6H6
120. Углеводород с формулой СН3 - СН3 относится к классу:
а. алкинов
б. алкенов
в. алканов
г. аренов
121. Гомологом гексана является:
а. С6Н12
б. С7H16
в. С6Н6
г.С7Н14
122.Тип реакции С2Н5ОН = C2H4 +H2O:
а. замещение;
б. гидрирование;
в. дегидратация;
г. присоединение
123.Водородная связь образуется между молекулами:
а. алканов;
б. алкенов;
в. алкинов;
г. спиртов.
124. Функциональную группу – ОН содержат молекулы:
а. диэтилового эфира и бензола;
б. фенола и ацетилена;
в. пропанола и фенола;
г. этанола и этилена
125. В промышленности этанол получают в результате реакции между:
а. C2H5Cl + H2O;
б. C2H4 + H2O;
в. C2H2 + H2O;
г. CH3COOC2H5 + H2O.
126. Гомологом этилового спирта является:
а. пропанол;
б. пропилен;
в. этилен;
г. бензол.
127Характерной реакцией на многоатомные спирты является взаимодействие с:
а.Н2
б. Cu
в. Ag2O(NH3)p-p
г. Cu(OH)2
128Для распознавания фенола используют:
а. аммиачный раствор оксида серебра
б. раствор хлорида железа (III)
в. свежеприготовленный гидроксид меди (II)
г. металлический цинк и калий
129.Альдегиды получают окислением:
а. бензола;
б. спиртов;
в. ацетилена;
г. нитросоединений
130. 40 % раствор муравьиного альдегида называется:
а. бутаналь;
б. пропаналь;
в. формалин;
г. пентаналь.
131. Гомологом уксусной кислоты является:
а. С2Н5СООН;
б. С3Н7СОН;
в. С4Н9ОН;
г. С2Н5СI.
132. Продукт реакции этерификации:
а. вода
б. диэтиловый эфир
в. бутанол
г. уксусная кислота
133. Продуктом взаимодействия уксусной кислоты с метанолом является:
а. Н─СОО─СH2─СH3
б. СН3─СОО─СН3
в.СН3─СH2─О─СН3
г. СН3─СH2─СООН
134. Отличить муравьиную кислоту от уксусной можно с помощью:
а. лакмуса
б. аммиачного раствора оксида серебра
в. гидроксида меди (II)
г. карбоната натрия
135. Промышленный способ получения анилина основан на реакции:
а. гидратации (реакция Кучерова)
б. восстановления (реакция Зинина)
в. нитрования (реакция Коновалова)
г. дегидратации (по правилу Зайцева)
136. Какая связь является пептидной?
а. -CO-NH2
б. -COO–+NН3-
в. -СО-NН-
г. -СО-О-
137. Сколько аминокислот входит в состав белка?
а. 20
б. 26
в. 48
г. 150
138. Денатурация – это процесс:
а. нарушение естественной структуры белка
б. восстановления естественной структуры белка
139. Отметьте вещество, в молекулах которого пептидная связь:
а. крахмал
б. белок
в. сложный эфир
г. углевод
140. Карбоксильную группу содержат молекулы:
а. аминоуксусной кислоты;
б. фенола;
в. формальдегида;
г. этанола.
150. С помощью общего анализа воды устанавливаются:
а. жесткость
б. органолептика.
в. кислотность
г. все перечисленное верно
151. К основным способам умягчения воды относят:
а.термическую обработку,
б. химическую обработку,
в. ионный обмен
г. все перечисленное верно
152. Некарбонатная жесткость определяется содержанием в воде кальциевых и магниевых солей сильных кислот:
а. сульфатов,
б.хлоридов,
в. нитратов
г. все перечисленное верно
153. Жесткость воды бывает:
а. общей
б. временной
в. постоянной
г. все перечисленное верно
154. Кислоту, пролитую на пол, нейтрализуют:
а. содой
б. водой
в.более слабой кислотой
г. щелочью
155. Щелочь, пролитую на пол , нейтрализуют:
а. содой
б. водой
в. борной кислотой
г. все перечисленное верно
156. Хранят в сосуде, не пропускающем ультрафиолет, под слоем керосина или другого инертного по отношению к этим металлам вещества:
а. щелочные и щелочноземельные металлы
б. соли сильных кислот
в. элементы подгруппы железа
г. алюминий
157. Наиболее распространенные первичными минералами почвы являются:
а.кварц,
б. полевые шпаты,
в. амфиболы (роговые обманки) и слюды
г. все перечисленное верно
158. Среди вторичных минералов почвы различают :
а. минералы простых солей,
б.минералы гидроокисей и окисей,
в. глинистые минералы
г. все перечисленное верно
159. По содержанию щелочноземельных и щелочных оснований почвообразующие породы делятся на:
а. засоленные,
б.Карбонатные
в. выщелоченные
г. все перечисленное верно
160. Острые отравления, нарушения обмена веществ, аллергия, нервные расстройства, злокачественные новообразования вызывают:
а. Нитраты, нитриты
б. стронций- 90
в. цезий -137
г все перечисленное верно
161. Острые и хронические пищевые отравления, поражение сердечно-сосудистой, мочеполовой и нервной систем вызывают:
а. нитраты, нитриты
б. стронций- 90
в. цезий -137
г. соединения тяжелых металлов
162. Делает почву кислой:
а. селитра
б. мочевина
в. кальциевая сера
г. все перечисленное верно
163. Способствуют накоплению большого количества нитратов:
а. калиевые удобрения
б. фосфорные
в. азотные
г. органические удобрения
164. Преимущества перегноя:
а. отсутствие токсичности;
б. улучшение консистенции грунта;
в. безопасность для растений и людей;
г. все перечисленное верно
165. Преимущества птичьего помета:
а. ускорение созревания плодов;
б.повышение урожайности, действие на протяжении 3 лет после внесения в почву
в.улучшение иммунитета растений, отсутствие токсичности;
г. все перечисленное верно
166. Наиболее пригоден для подкормки растений, нуждающихся в большом количестве магния:
а навоз
б. кроличий помет
в. конский навоз
г. птичий помет
167.Плюсы кроличьего помета:
а. удобство транспортировки;
б.богатый химический состав;
в. высокая биологическая ценность, отсутствие паразитов и семян сорняков
г. все перечисленное верно
168.Биогумус- это:
а. навоз, переработанный червями
б. перегной
в. компост с добавлением минеральных удобрений
г. все перечисленное верно
169. К сидератам (зеленым удобнениям) относят:
а. бобовые культуры;
б. гречиху;
в.зерновые и горчицу
г. все перечисленное верно
170. Для мульчирования почвы используют:
а. ил (сапропель)
б.костную муку
в. древесные опилки
г. все перечисленное верно
Задание 2
Написать молекулярные формулы веществ, если в молекуле содержится 15 , 20, 34 атома углерода и вещество алкин.
Написать молекулярную формулу вещества, если в его молекуле содержится 20, 24,30 атомов водорода и вещество –алкен
2.3.Написать молекулярную формулу вещества, если в его молекуле содержится 30, 20, 40 атомов водорода и вещество –алкан
2.4. Написать молекулярную формулу вещества, если в молекуле содержится 25 , 23, 32 атома углерода и вещество алкан
Задание 3:Написать уравнения реакций, протекающих по схеме:
3.1.С2Н4 → С2Н2 → СН3СОН →СН3СООН → СН3СООС2Н5
3.2 СаС2→С2Н2→ СН3СОН → СН3СООН →СН3СООС3Н7
3.3. С6Н12О 6 → С2Н5ОН → C2H5Cl → C2H5OH→ HCOOC2H5
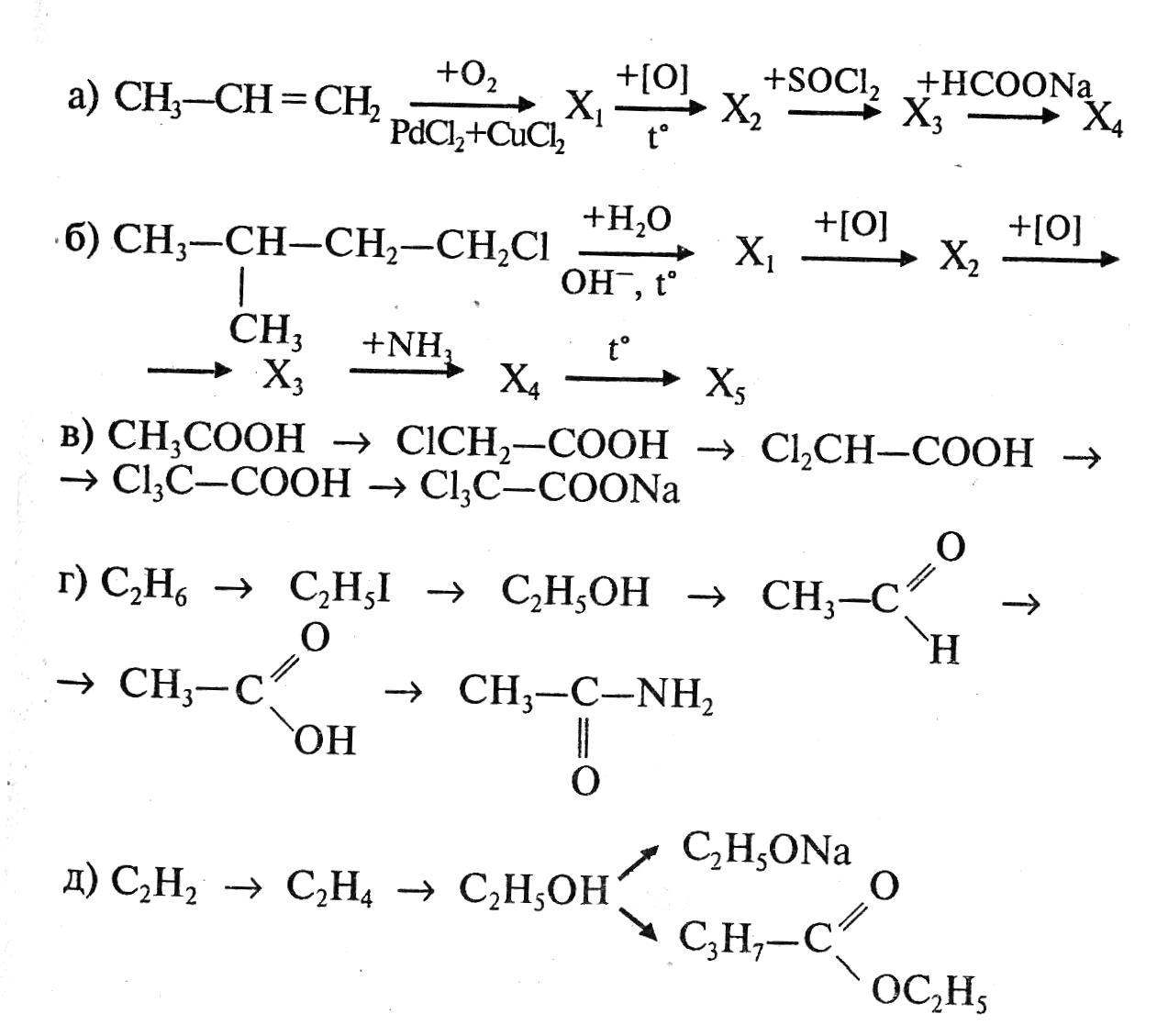
3.4.
Задание 4: Из приведенных химических формул веществ: H2SO4, Fe(ОН)3,FeO, HNO3,КОН, CuO, CO, Cu(OH)2, P2O5, KNO3, Fe2O3,H3PO4, CaCO3, CO2, NaOH, HCl, K2SO4, SO2 MgO, FeCl3, CaO выпишите оксиды, гидроксиды (основания), кислоты, соли. Дайте название.
Эталоны ответов задания № 2, 3, 4
Задание 2
2.1 Написать молекулярные формулы веществ, если в молекуле содержится 15 , 20, 34 атома углерода и вещество алкин.
СnH2n-2
n=15, 15*2-2 = 28
С15Н 28,
С20Н 38
С34Н 66
Написать молекулярную формулу вещества, если в его молекуле содержится 20, 24,30 атомов водорода и вещество –алкен
Сn H2n
2n = 20, n= 20/2 = 10
C10 H20
C12H24
C15 H30
Написать молекулярную формулу вещества, если в его молекуле содержится 30, 20, 40 атомов водорода и вещество –алкан
Сn H2n+2
n= 30
2n+ 2 = 30
2n = 28
n= 14
C14H30
C9H20
C19H40
2.4 Написать молекулярную формулу вещества, если в молекуле содержится 25 , 23, 32 атома углерода и вещество алкан
Сn H2n+2
n= 25
2* 25+ 2 = 52
C25H52
C23H48
C32H66
Задание 3:Написать уравнения реакций, протекающих по схеме:
3.1.С2Н4 → С2Н2 → СН3СОН →СН3СООН → СН3СООС2Н5
С2Н4 → С2Н2 + Н2

2 СН3 СОН + О2 2 СН3СООН
СН3 СОН + О2 2 СН3СООН
(КMnO4, K2Cr2O7 + H2SO4)

 СН3СООН + С 2Н5ОН СН3СОО С 2Н5 +H2O
СН3СООН + С 2Н5ОН СН3СОО С 2Н5 +H2O
Катализатор минеральные кислоты Н+
3.2 СаС2→С2Н2→ СН3СОН → СН3СООН →СН3СООС3Н7
![]()

2 СН3СОН + О2 2 СН3СООН
СН3СОН + О2 2 СН3СООН
(КMnO4, K2Cr2O7 + H2SO4)
С
 Н3СООН + С 3Н7ОН СН3СОО С 3Н7 +H2O
Н3СООН + С 3Н7ОН СН3СОО С 3Н7 +H2O
Катализатор минеральные кислоты Н
3


 .3. С6Н12О 6 С2Н5ОН C2H5ClC2H5OHHCOOC2H5
.3. С6Н12О 6 С2Н5ОН C2H5ClC2H5OHHCOOC2H5
С 6Н12О6 ферменты 2 С2Н5ОН + 2 СО2
6Н12О6 ферменты 2 С2Н5ОН + 2 СО2
C2H5OH+ HСl → C2H5Cl+ H2O
C2H5Cl+ H2O→ C2H5OH+ HСl
C 2H5OH + HCOOH→ HCOOC2H5 +H2O
2H5OH + HCOOH→ HCOOC2H5 +H2O

3.4.
C 2H2+ H2 C2H4
2H2+ H2 C2H4
C 2H4+ H2O C2H5OH
2H4+ H2O C2H5OH
2C2H5OH+ 2Na→ 2C2H5ONa + H2
C
 2H5OH + C3H7COOH C3H7COO C2H5 + H2O
2H5OH + C3H7COOH C3H7COO C2H5 + H2O
Задание 4
Из приведенных химических формул веществ: H2SO4,FeO, HNO3, КОН, CuO, CO, Cu(OH)2, P2O5 KNO3, Fe2O3, CaCO3, CO2, NaOH, HCl, K2SO4, H3PO4, SO2, Fe(ОН)3,MgO, FeCl3, CaO выпишите оксиды, гидроксиды (основания), кислоты, соли. Дайте название.
Оксиды:
FeO- оксид железа (II)
CuO- оксид меди (II)
CO- оксид углерода (II)
P2O5 – оксид фосфора (V)
Fe2O3- оксид железа (III)
CO2- оксидуглерода (IV)
SO2 - оксид серы (IV)
CaO- оксид кальция
MgO- оксид магния
Гидроксиды:
Cu(OH)2- гидроксид меди (II)
NaOH- гидроксид натрия
КОН- гидроксид калия
Fe(ОН)3 – гидроксид железа (III)
Кислоты
HNO3 - азотная кислота
HCl- соляная кислота
H3PO4- ортофосфорная кислота
H2SO4- серная кислота
Соли
KNO3- нитрат калия
CaCO3- карбонат кальция
K2SO4- сульфат калия
FeCl3- хлорид железа (III)
5. КРИТЕРИИ ОЦЕНКИ ЭКЗАМЕНА
Ответить на 30 вопросов тестовых заданий. Выберите один верный ответ из предложенных. Один верный ответ - один балл. Максимальное количество баллов- 30.
2.Написать молекулярную формулу вещества. Верно написанное задание – 5 баллов.
3.Написать уравнения реакций, протекающих по схеме. Верно выполненное задание– 20 баллов.
4.Составить формулы солей, образованных кислотами. Максимальное количество баллов- 15.
Максимальное количество баллов за 3 задания: 70
| 63-70 баллов | 90-100% | Отлично |
| 56-62 баллов | 80-89 % | Хорошо |
| 49-55 баллов | 70-79% | Удовлетворительно |
| Менее 48 баллов | Менее 70 % | Неудовлетворительно |
Оценки объявляются в день проведения экзамена
Шаблон бланка для экзамена
ГБПОУ «Саткинский медицинский колледж»
Рассмотрено предметной комиссией «Утверждаю»
«____» _____________2023год Зам. директора по учебной работе
Председатель комиссии «____»________________2023г од
Экзамен ООД 11 .Химия
Предлагается ответить на следующие задания:
Ответить на 30 вопросов тестовых заданий. Выберите один верный ответ из предложенных. Один верный ответ - один балл. Максимальное количество баллов- 30.
Задание 2
Написать молекулярные формулы веществ, если в молекуле содержится …. углерода и вещество алкин.
Задание 3: Написать уравнения реакций, протекающих по схеме:
….. → ….. → …… →….. → …..
Задание 4Напишите формулы солей, образованных ….. и следующими кислотами: ……………..
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
Основная литература
Анфиногенова, И. В. Химия: учебник и практикум для среднего профессионального образования / И. В. Анфиногенова, А. В. Бабков, В. А. Попков. — 2-е изд., испр. и доп. — Москва: Издательство Юрайт, 2022. — 291 с.
Дополнительные источники
Химия. 10 класс. Углублённый уровень : учебник/ В.В. Еремин, Н.Е. Кузьменко, В.И. Теренин, А.А. Дроздов, В.В. Лунин; под ред. В.В. Лунина. – М.: Просвещение, 2022. – 446, [2] c.: ил.
Химия. 11 класс. Углублённый уровень : учебник/ В.В. Еремин, Н.Е. Кузьменко, А.А. Дроздов, В.В. Лунин; под ред. В.В. Лунина. – М.: Просвещение, 2022. – 478, [2] c.: ил.
Черникова Н. Ю., Мещерякова Е. В. Решаем задачи по химии самостоятельно: учебное пособие / Н. Ю. Черникова, Е. В. Мещерякова — Санкт-Петербург: Лань, 2022. — 328 с.
Резников В. А. Сборник упражнений и задач по органической химии: учебное пособие / В.А. Резников — Санкт-Петербург: Лань, 2021. — 226 с.
Капустина А. А., Хальченко И. Г., Либанов В. В. Общая и неорганическая химия. Практикум / А. А. Капустина, И. Г. Хальченко, В.В. Либанов— Санкт-Петербург: Лань, 2020. — 152 с.












