Просмотр содержимого документа
«Фосфор и его соединения»

«Элемент жизни и мысли» А.Е.Ферсман

1.Разбавленная азотная кислота взаимодействует с
1)Гидроксидом кальция 2)Сульфатом меди 3)оксидом кремния 4)соляная кислота
2) Какое вещество является восстановителем в реакции
NH 3 + O 2 N 2 + H 2 O
3.Отрицательная степень окисления у азота в соединении...
1)N 2 2)KN0 3 3)NH 3 4)N0 2
4. Составьте уравнения реакций, при помощи которых можно осуществить преврашения
N 2 NH 3 (NH 4 ) 2 SO 4 NH 3

То я камень философский,
То огонь холодный я,
То цвет белый, красный, черный
Представляю я.
А в России появился,
Светоносцем объявился.

Тема:
Фосфор и его соединения

Прав ли был Артур Конан –Дойл ?

Фосфор. Строение атома,
аллотропия, свойства и
применение фосфора.

АЛЛОТРОПНЫЕ МОДИФИКАЦИИ
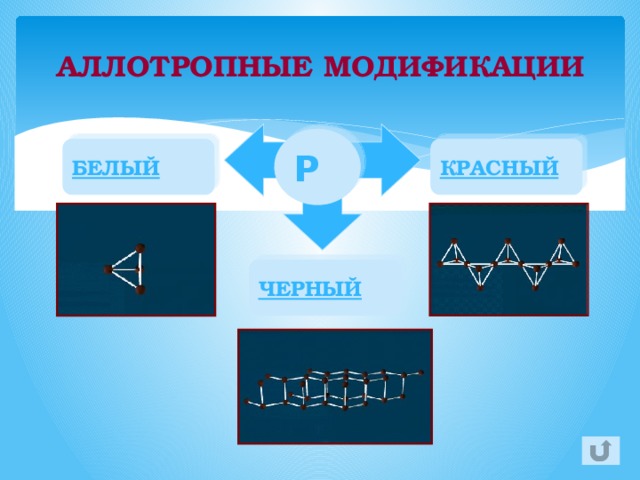
АЛЛОТРОПНЫЕ МОДИФИКАЦИИ
Р
БЕЛЫЙ
КРАСНЫЙ
ЧЕРНЫЙ
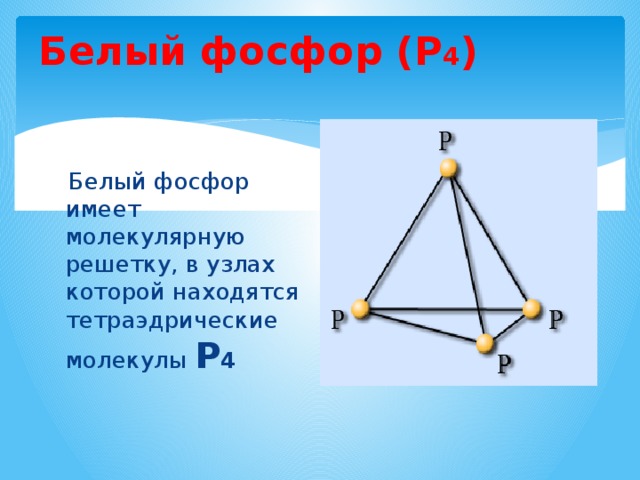
Белый фосфор (Р 4 )
Белый фосфор имеет молекулярную решетку, в узлах которой находятся тетраэдрические молекулы Р 4
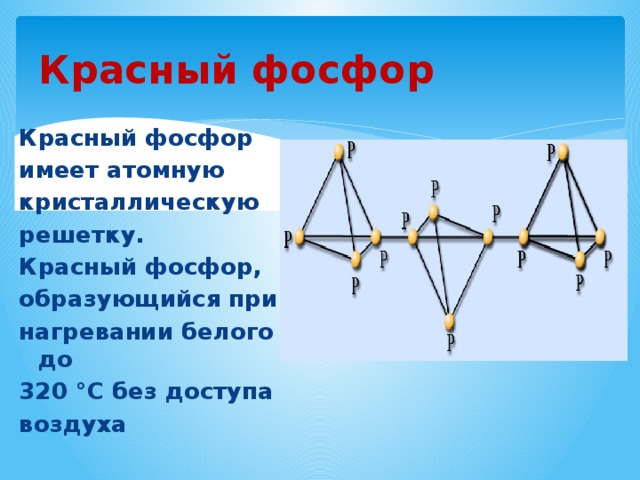
Красный фосфор
Красный фосфор
имеет атомную
кристаллическую
решетку.
Красный фосфор,
образующийся при
нагревании белого до
320 °С без доступа
воздуха

Черный фосфор
- Черный фосфор имеет атомную кристаллическую решетку.
- Образуется при нагревании белого фосфора без
доступа воздуха.
- Ромбическая модификация черного фосфора построена из гексагональных колец Р6, упакованных в слои, причем кольца не являются плоскими.

Белый фосфор (Р 4 )
вещество с желтоватый
оттенком
- легко режется ножом
- в воде не растворяется,
- растворяется в сероуглероде.
- Светится в темноте,
- при t=40 ºС в измельченном
состоянии воспламеняется.
- сильный ЯД
- В лаборатории хранит под слоем воду

Красный фосфор
- аморфное вещество
- без запаха,
- красно-бурого цвета,
- не ядовит .
- не огнеопасен
- в воде и сероуглероде не растворим.
- не светится

Черный фосфор
- полимерное вещество с металлическим блеском, похож на графит,
- без запаха,
- жирный на ощупь.
- нерастворим в воде и в органических растворителях.
- не ядовит .
- не огнеопасен
- в воде и сероуглероде не растворим.
- не светится

ХИМИЧЕСКИЕ СВОЙСТВА
Ca + P =
P + O 2 =
3Ca 0 + 2P 0 = Ca +2 3 P -3 2
4P 0 + 5O 0 2 = 2P +5 2 O -2 5

- Ca 3 P 2 +6 HCL =3CaCl 2 +2PH 3

Взаимодействие оксида фосфора (V) с водой.
Р 2 О 5 +3 Н 2 О = 2Н 3 РО 4

Применение фосфора
Производство
спичек
Медицина
Химическое
производство
Сельское
хозяйство
Производство
моющих средств
Металлургическое
производство
Зажигательные
бомбы, дымовые
завесы

Открытие фосфора
Гамбургский алхимик
Хеннинг Бранд
1669 год

Выберите правильный ответ
В каком соединении фосфор
проявляет
степень окисления -3?
А) Н 3 РО 4
Б) РН 3
В) HРO 3

Выберите правильный ответ
- С каким веществом реагирует фосфор образуя фосфид:
А) водой
Б) водородом
В) магнием

СПАСИБО ЗА УРОК!













































