Гидролиз соли − это взаимодействие ее ионов с водой, приводящее к появлению кислотной или щелочной среды, но не сопровождающееся образованием осадков или газов.
Уравнение гидролиза соли записывают в два этапа:
1) диссоциация соли в растворе − необратимая реакция (α = 1)
2) гидролиз иона соли (его взаимодействие с водой) − обратимая реакция (α
Этапы 1 и 2 складывать нельзя!
Отметим, что соли, образованные катионами щелочей и анионами сильных кислот гидролизу не подвергаются, они лишь диссоциируют при растворении в воде. В растворах таких солей как KCl, NaNO3, Na2SO4, BaI2 среда нейтральная.
Гидролиз солей по аниону
В случае взаимодействия аниона растворенной соли с водой процесс называется гидролизом соли по аниону:
1)KNO2 =K+ +NO2− (диссоциация)
2) NO2 + H2O 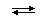 HNO2 + OH− (гидролиз)
HNO2 + OH− (гидролиз)
Диссоциация соли KNO2 протекает полностью, а реакция гидролиза аниона NO2− в очень небольшой степени (для 0,1М раствора − на 0,0014%), однако этого оказывается достаточно, чтобы раствор стал щелочным (среди продуктов гидролиза присутствует ион OH−).
Гидролизу подвергаются анионы только слабых кислот (в данном примере − нитрит-ион NO2− , отвечающий слабой азотистой кислоте HNO2). Анион слабой кислоты обладает способностью отщеплять катион водорода от молекулы воды, образуя молекулу соответствующей кислоты и оставляя в растворе гидроксид-ион OH−.
Степень протекания гидролиза увеличивается в ряду анионов:
F−, NO2−, CH3COO−, SO32−, ClO−, CN−, CO32−, PO43−, S2−, SiO44−.
Примеры реакций гидролиза анионов:
А)СO32− +H2O 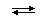 HСO3− +OH−
HСO3− +OH−
б)PO43− +H2O 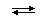 HPO42− +OH−
HPO42− +OH−
в)S2− +H2O 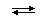 HS− +OH−
HS− +OH−
(обратите внимание, что в уравнениях обратимого гидролиза фигурирует только одна молекула воды!).
Ионы CO32−, PO43− и S2− подвергаются гидролизу в большей степени, чем NO2−: в их 0,1М растворах − на 5%, 37% и 58% соответственно. Причина этого состоит в том, что сила соответствующих кислот в указанном ряду (азотистая − угольная по второй ступени − ортофосфорная по третьей ступени − сероводородная по второй ступени) убывает. Поэтому растворы солей Na2CO3, K3PO4 и BaS будут сильнощелочными (рН 7).
Таким образом, соли, образованные катионом сильного основания и анионом слабой кислоты, подвергаются гидролизу по аниону и создают в растворе щелочную среду.
Гидролиз солей по катиону
В случае взаимодействия катиона растворенной соли с водой процесс называется гидролизом соли по катиону:
1)Ni(NO3)2 =Ni2+ +2NO3− (диссоциация)
2) Ni2+ + H2O 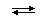 NiOH+ + H+ (гидролиз)
NiOH+ + H+ (гидролиз)
Диссоциация соли Ni(NO3)2 протекает нацело, гидролиз катиона Ni2+ − в очень малой степени (для 0,1М раствора − на 0,001%), но этого оказывается достаточно, чтобы среда стала кислотной (среди продуктов гидролиза присутствует ион H+).
Гидролизу подвергаются катионы только малорастворимых основных и амфотерных гидроксидов и катион аммония NH4+. Катион металла, отщепляя от молекулы воды гидроксидный фрагмент, освобождает катион водорода H+ (точнее − катион оксония H3O+).
В соответствии с протонной теорией гидролиз по катиону рассматривают следующим образом: диссоциация соли при водит к образованию гидратированныхкатионов и анионов. Гидратированные катионы металлов (за исключение катионов щелочей) в водном растворе обладают кислотными функциями − отдают протоны молекулам воды:
Ni2+ · H2O + H2O 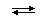 NiOH+ + H3O+
NiOH+ + H3O+
В результате раствор становится кислотным (избыток катионов оксония H3O+).
Катион аммония в результате гидролиза образует слабое основание − гидрат аммиака и катион водорода (катион оксония):
NH4+ + H2O 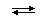 NH3 · H2O + H+
NH3 · H2O + H+
Степень гидролиза катионов увеличивается в ряду
Ni2+, La3+, Mn2+, NH4+, Co2+, Zn2+, Cd2+, Cu2+, Fe2+, Pb2+, Al3+, Sc3+, Cr3+, Fe3+.
Другие примеры (в 0,1М растворах):
а) Zn2+ + H2O 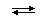 ZnOH+ + H+ (α = 0,05%)
ZnOH+ + H+ (α = 0,05%)
б) Cr3+ + H2O 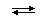 CrOH2+ + H+ (α = 3,3%)
CrOH2+ + H+ (α = 3,3%)
в) Fe3+ + H2O 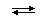 FeOH2+ + H+ (α = 22,8%)
FeOH2+ + H+ (α = 22,8%)
Соли, образованные катионами, сильно подверженными гидролизу (такие как Sn2+ или Bi3+), удается растворить только при добавлении кислоты; при растворении в чистой воде гидроксокатионов получается настолько много, что соответствующая основная соль выпадает в осадок:
SnCl2 + H2O = Sn(Cl)OH + HCl
Bi(NO3)3 + H2O = Bi(NO3)2OH↓ + HNO3
Итак, соли, образованные катионом малорастворимого основного или амфотерного гидроксида и анионом сильной кислоты, подвергаются гидролизу по катиону и образуют в растворе кислотную среду.
Гидролиз по катиону и аниону
Соли, образованные катионами малорастворимых основных или амфотерных гидроксидов и анионами слабых кислот (например сульфиды или ортофосфаты), малорастворимы в воде и обсуждать их гидролиз не имеет смысла.
Наоборот, некоторые фториды и ацетаты этих катионов хорошо растворимы в воде; они гидролизуются по катиону и аниону (в разной степени). Среда раствора определяется тем ионом соли, у которого степень гидролиза выше (в большинстве случаев выше степень гидролиза катионов и среда раствора слабокислотная).
Например, гидролиз фторида меди(II) в 0,1М растворе:
CuF2 = Cu2+ + 2F− Cu2+ + H2O 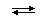 CuOH+ + H+ (α = 0,068%)
CuOH+ + H+ (α = 0,068%)
F− + H2O 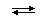 HF + OH− (α = 0,0012%)
HF + OH− (α = 0,0012%)
Преобладает кислотная среда, так как степень гидролиза по катиону выше.
То же наблюдается в растворах солей аммония − фторида аммония NH4F (среда кислотная), ацетата аммония NH4CH3COO (среда практически нейтральная из-за одинаковой степени гидролиза по катиону и по аниону) и цианида аммония NH4CN (среда щелочная).
Многие соединения, синтезируемые "сухим" способом − например карбонат железа(II), сульфид алюминия − при попытке получения обменной реакцией в водном растворе подвергаются полному необратимому гидролизу с образованием основных солей или гидроксидов, а также соответствующих кислот или кислотных оксидов:
а)2Fe2+ +2CO32− +H2O=Fe2CO3(OH)2↓+CO2↑
б) 2Al3+ + 3S2− + 6H2O = 2Al(OH)3↓ + 3H2S↑
Если карбонат железа(II) FeCO3, полученный "сухим путем" или взятый в виде минерала сидерит, при внесении в воду осаждается без видимого взаимодействия, то сульфид алюминия при контакте с водой мгновенно разлагается:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Гидролиз бинарных соединений
Многие вещества, относящиеся к классу бинарных соединений и не являющиеся солями, не могут существовать в водном растворе, поскольку подвергаются полному необратимому гидролизу:
Mg3N2 +8H2O=3Mg(OH)2 +2NH3 ·H2O
CaC2 +2H2O=Ca(OH)2 +C2H2
SCl2O2 + 2H2O = H2SO4 + 2HCl
Поскольку гидролиз бинарных соединений протекает необратимо, следует оберегать их от контакта с водой и влажным воздухом.

























