Генетические методы исследований в тератологии
Генетические методы исследований в тератологии
Основным методом, позволяющим выяснить ключевые моменты этиологии и патогенеза врожденных пороков развития, является экспериментальный, и не вызывает сомнения, что общие закономерности возникновения пороков у человека и экспериментальных животных одни и те же. Вопросам экспериментальной тератологии посвящены многочисленные статьи как отечественных, так и зарубежных ученых. В клинической тератологии применение этого метода крайне ограничено и в настоящее время имеются лишь публикации о тератологических исследованиях на яйцеклетках человека и первых опытах развития in vitro зародышей человека при искусственном оплодотворении.
В тератологии человека применяются клинические и генетические методы исследования. Комплекс этих методов необходим как для диагностики порока, так и для определения типа его наследования и величины генетического риска.
К генетическим методам, применяемым в клинической практике, относятся: а) генеалогический, б) цитогенетический, в) популяционно-статистический, г) близнецовый, д) морфологический.
Генеалогический метод (анализ родословных) в ряде случаев помогает установить тип наследования порока. В каждом случае родословная должна охватывать не менее 4 поколений, быть по возможности полной и включать все данные, которые могут представлять интерес в отношении рассматриваемого вопроса.
Наличие аналогичного поражения в нескольких поколениях одной семьи у родителей и их детей позволяет предполагать аутосомно-доминантный тип передачи. Именно так установлено, например, наследование синдрома ЕЕС (первые буквы английских терминов, обозначающих основные клинические признаки). Появление сходных пороков у разнополых сибсов, родители которых здоровы,— веский аргумент в пользу аутосомно-рецессивного наследования. Кровное родство родителей, как и эндогамность брака (родители родом из одной деревни или из соседних деревень), при прочих равных условиях также свидетельствует об аутосомно-рецессивном типе передаче. Поэтому при составлении родословной следует выяснить как девичью фамилию матери (жены), так и место рождения обоих родителей. Если тот или иной порок наблюдается только у мужчин или только у женщин, родословные позволяют полагать либо о наследовании, сцепленном с Х-хромосомой (Х-сцепленном доминантном наследовании, если пороки отмечаются только у женщин, и Х-сцепленном рецессивном, когда все пораженные мужчины), либо о наследовании, ограниченном полом. Наличие других детей с пороками развития, спонтанные аборты, мертворождения, гибель детей в неонатальном периоде, бесплодные браки — все это должно найти отражение в родословной, поскольку генетическое решение принимается на основании полного генеалогического анализа, а все выше перечисленные факторы могут в той или иной степени влиять на это решение. Анализ родословных позволяет также установить порядок рождения ребенка с пороком, исходы предшествующих (и последующих) беременностей, что имеет значение как для суждения о причинах пороков, так и для расчета эмпирического риска повторения при пороках неясного генеза или пороках мультифакториального происхождения.
Иногда генеалогический анализ позволяет даже судить о времени первого появления мутантного гена и его возрасте в популяции [Li W.‚1976]. Особое значение приобретает анализ родословных в изолятах, где частота эндогамных браков, способствующих гомозиготизации рецессивных генов, особенно высока [Эфроимсон, 1968].
Цитогенетический метод в тератологии сводится к определению полового хроматина или хромосомного набора ребенка (плода) с врожденными пороками или его родителей.
Определение полового хроматина основано на феномене гетерохроматизации Х-хромосом: все Х-хромосомы, кроме од ной, инактивируются и в интерфазных ядрах принимают вид хроматиновых глыбок округлой или треугольной формы, лежащих на периферии ядра. Половой хроматин обычно определяют в эпителии слизистой оболочки рта (или влагалища). Для этого соскоб слизистой оболочки окрашивают ацетоорсеином или любой ядерной краской. В норме у женщин частота хроматинположительных ядер составляет 20-40%, у мужчин 1-3%. Принципиально половой хроматин можно определять и в гистологических препаратах, например в ядрах эпителия канальцев почек.
Отсутствие полового хроматина у женщин может указывать либо на моносомию Х (45, Х), либо на набор половых хромосом Х (46, ХY). Наличие полового хроматина по женскому типу у мужчин и двух и более телец хроматина у мужчин и женщин свидетельствует о полисомии Х.
Исследование хромосомного набора проводят в метафазных пластинках лимфоцитов и фибробластов, культивируемых в искусственных условиях. Для культивирования лимфоцитов в стерильных условиях берут кровь в количестве 0,2 мл и помещают в питательную среду, куда вводят фитогемаглютинин – специфический стимулятор деления клеток. Через 60-70 ч в культуру вводят колхицин, блокирующий деление на стадии метафазы, спустя 1,5-2 ч клетки подвергают гипотонической обработке и фиксируют. Для культивирования фибробластов берут небольшой участок кожи (около 0,3 см а у трупов – кусочки ткани любого органа (обычно почки или гонады) в количестве не менее 0,2 г. Культивирование фибробластов отличается главным образом тем, что рост клеток происходит спонтанно, без участия митогенов. Время от взятия тканей до получения метафазных пластинок – от 5 до 30 дней. Исключение составляют эмбриональные фибробласты, растущие значительно быстрее. Культивирование трупных тканей оказывается успешным обычно в тех случаях, когда от момента смерти прошло не более 12 ч (при хранении трупа в холодильнике этот срок может быть продлен до 1 сут).
В зависимости от целей исследования можно применять либо обычную окраску метафаз по Романовскому – Гимзе, при которой каждая хромосома в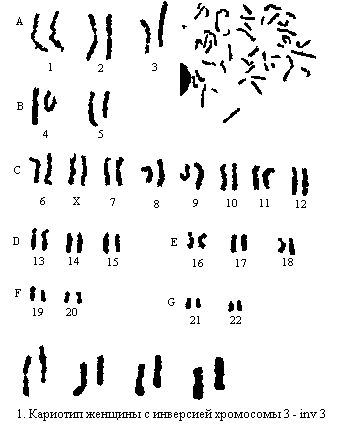 ыглядит гомогенной, либо дифференциальное окрашивание с помощью флюорохромов, протеаз или денатурирующих методов. Предложенный М. Seabгight (1972) метод обработки препаратов хромосом трипсином нашел наибольшее применение в цитогенетической практике (рис. 1).
ыглядит гомогенной, либо дифференциальное окрашивание с помощью флюорохромов, протеаз или денатурирующих методов. Предложенный М. Seabгight (1972) метод обработки препаратов хромосом трипсином нашел наибольшее применение в цитогенетической практике (рис. 1).
В последние годы широкое распространение получил метод исследования прометафазных хромосом. При этом способе об работки удается выявить значительно большее число дисков и, следовательно, уточнить точки поломок при структурных перестройках хромосом. Этот же метод необходим при цитогенетических исследованиях больных с синдромами, для которых установлена связь с микроделециями хромосом (синдромы аниридин-нефробластомы, Прадера – Вили, Лангера – Гидеона и т. д.). Наконец, в части случаев исследование прометафазных хромосом позволяет обнаружить перестройки, не выявляемые при анализе метафазных хромосом [Залетаев Д.О., 1985].
Технически получение прометафазных хромосом достигается введением метотрексата, ингибирующнго синтез тимидиновой кислоты и вводимого в конце S-периода.
Существует значительное число специальных цитогенетических методов, направленных на выявление определенных изменений хромосом (выявление фрагильной Х-хромосомы при подозрении на синдром Мартина—Белла, окраска 6-11 для установления природы мелкой кольцевой гоносомы у больных с аномалиями половых хромосом и т. д.).
Анализ хромосом проводят в световом микроскопе при увеличении в 2000 раз. для анализа хромосом, окрашенных флюорохромами используют люминесцентный микроскоп.
В любом случае анализ хромосом позволяет судить о наличии или отсутствии их патологии, хотя разрешающая способность методов дифференциальной окраски значительно выше, чем обычных.
Популяционно-статистический метод предполагает установление частоты тех или иных пороков развития (и в какой-то мере частот мутантных генов) в определенной географической зоне. Естественно, распределение генотипов в изолятах, где частота кровнородственных браков достаточно велика, например, будет существенно отличаться от их распределения в безвыборочной популяции, для которой характерны преимущественно случайные браки (панмиксия). Эти данные нужны не только для представления о путях формирования популяции и о ее генетическом грузе, но и для определения риска при некоторых пороках мультифакториального генеза, поскольку величина риска зависит от популяционной частоты пороков.
Статистические методы используются в тератологии очень широко. Так, данные о возрасте родителей при рождении детей с пороками развития позволяют в определенной мере судить об этиологии пороков: увеличение возраста обоих супругов характерно для аутосомньтх трисомий, увеличение возраста отцов — один из критериев распознавания новых доминантных мутаций [Jones К. еt аl., 1975].
Статистические методы применяются также для установления распределения рождения детей с теми или иными пороками по месяцам года, сезонам и т. д. или для выяснения корреляции частоты того или иного порока с каким-либо внешним агентом (эпидемия гриппа или гепатита). Объем выборки, необходимый для того, чтобы получить заключение, и методы расчета приведены в специальных руководствах [Рокицкий П. Ф., 1974].
Близнецовый метод – традиционный метод генетических исследований пороков развития [Канаев И. И., 1959]. Близнецы могут быть как конкордантны по пороку развития (когда у обоих найден аналогичный порок), так и дискордантны (когда порок обнаруживается лишь у одного из них). От ношения между числом конкордантных и дискордантных пар в зависимости от зиготности не только позволяют судить, связаны ли данные пороки с изменениями генетического материала или вызваны средовыми факторами, но и рассчитать коэффициент наследуемости. Надежность близнецовых исследований зависит от объема выборки, в связи, с чем применение этого метода в современной клинической тератологии ограничено: генетика частых форм пороков (где можно найти достаточное число близнецовых пар) изучена достаточно полно, рождение же близнецов, у одного (или обоих) из которых имеются не обычные типы пороков, наблюдается очень редко.
Морфологический метод используют для исследования различных видов материала: патологоанатомического, эмбриологического, операционного и реже – биопсийного.
Вскрытию трупов с врожденными пороками должно предшествовать тщательное наружное исследование, поскольку вопрос о необходимости стерильного взятия тканей для определения кариотипа должен быть решен до эвисцерации. Показаниями к такому исследованию служат наличие у пробанда множественных пороков, часть из которых определяется уже при наружном осмотре, и изменения дерматоглифики. При наружном осмотре, кроме традиционных в патологической анатомии осмотра кожных покровов и слизистых оболочек, взвешивания и измерений, особое внимание, как и при осмотре Живых детей, уделяют микроаномалиям и особенностям развития.
Данные наружного осмотра позволяют судить и о многих пороках висцеральных органов. Например, гипотелоризм, особенно в сочетании с монголоидным разрезом глазных щелей, обычно свидетельствует о пороках ЦНС аринэнцефалической группы; запавшая брюшная стенка часто наблюдается при диафрагмальных грыжах; инфантильный поликистоз почек с выбуханием боковых отделов брюшной стенки, группа пороков мочевой системы, при которых отсутствует экскреция мочи, сопровождается комплексом пороков лица, определяемых как «facies Potter», и т. п.
В настоящее время большое внимание уделяется исследованию абортусов1 Исследование абортусов имеет большое значение для практического здравоохранения, поскольку установление причин прерывания беременности и нарушений развития эмбриона и плода создает основу для выработки мер профилактики самопроизвольных абортов (СА) и антенатальной охраны плода. Кроме того, постоянный контроль за частотой СА у достаточно большой группы населения с углубленными морфологическими и цитогенетическими исследованиями может оказать большую помощь в уточнении данных об уровне мутационного процесса у населения, о влиянии факторов внешней среды на внутриутробный плод и о фенотипических проявлениях эмбрио- и фетопатий, обусловленных различными факторами. Более того, в настоящее время широко используются методы пренатального исследования состояния развивающегося плода, В случаях установления аномального развития беременность может быть прервана, а плод для уточнения диагноза подлежит патологоанатомическому исследованию.
Исследования абортусов принципиально не отличаются от патологоанатомических исследований, однако они имеют ряд особенностей и так же, как исследования трупов детей, умерших в перинатальном периоде, должны быть комплексными, включающие клинические и генетические методы.
Макроскопическое исследование зародышевых мешков, эмбрионов и плодов длиной меньше 80 мм проводят в чашках Петри с помощью микроскопа МБС-I или бинокулярной лупы. Лупой пользуются и при изучении органов плодов более старшего возраста. В качестве секционного инструментария удобнее пользоваться скальпелем, ножницами и пинцетом, применяемыми в офтальмологии. Наряду с исследованием эмбриона и плода тщательному осмотру подлежат внезародышевые органы – оболочки (водная, хориальная, отпадающая), аллантоисная ножка, желточный мешок, пуповина, плацента. Фиксируется топографическое положение эмбриона по отношению к ворсинчатому хориону. После наружного исследования эмбрионы размером меньше 20-30 мм изучают на серийных тотальных гистотопограммах, сделанных в сагиттальной или фронтальной плоскостях. Более крупные э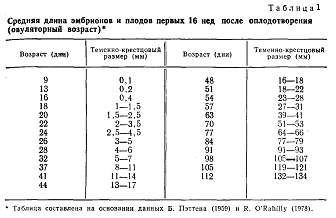 мбрионы и плоды подлежат аутопсии с полной эвисцерацией органов и с после дующим гистологическим исследованием. Возраст эмбрионов и ранних плодов наиболее удобно определять по табл. 1. Начиная с 5-го месяца беременности целесообразнее пользоваться тремя показателями возраста плода: овуляторным сроком беременности, теменно-пяточной длиной и общей массой плода. При сроке беременности 5 мес средняя длина плода составляет 23-25 см, масса – 260-316 г; в б мес – соответственно 29-31 см и 552-630 г; в 7 мес – 35-37 см и 971-1045 г [ Поттер Э., 1971]. Дефицит общей массы у немацерированных эмбрионов и ранних плодов свидетельствует об общей гипоплазии. У поздних плодов (после 20 нед) о гипоплазии можно говорить и в случаях мацерации. Учитывая значительную роль в пренатальной гибели зародышей гипоплазии плаценты, особенно в сочетании с тромбозом, инфарктами и преждевременной отслойкой, необходимо во всех случаях определять плодово-плацентарный показатель (ППК) — отношение массы плаценты к массе плода. ППК для плодов 10 нед равен 2; для плодов 12 нед – 1,67; 14 нед – 1,5; 16-0,88; 18-0,75; 20-0,6; 22- 0,42; 24-0,36; к 28 нед ППК равен 0,25-0,30 [Javert С., 1957].
мбрионы и плоды подлежат аутопсии с полной эвисцерацией органов и с после дующим гистологическим исследованием. Возраст эмбрионов и ранних плодов наиболее удобно определять по табл. 1. Начиная с 5-го месяца беременности целесообразнее пользоваться тремя показателями возраста плода: овуляторным сроком беременности, теменно-пяточной длиной и общей массой плода. При сроке беременности 5 мес средняя длина плода составляет 23-25 см, масса – 260-316 г; в б мес – соответственно 29-31 см и 552-630 г; в 7 мес – 35-37 см и 971-1045 г [ Поттер Э., 1971]. Дефицит общей массы у немацерированных эмбрионов и ранних плодов свидетельствует об общей гипоплазии. У поздних плодов (после 20 нед) о гипоплазии можно говорить и в случаях мацерации. Учитывая значительную роль в пренатальной гибели зародышей гипоплазии плаценты, особенно в сочетании с тромбозом, инфарктами и преждевременной отслойкой, необходимо во всех случаях определять плодово-плацентарный показатель (ППК) — отношение массы плаценты к массе плода. ППК для плодов 10 нед равен 2; для плодов 12 нед – 1,67; 14 нед – 1,5; 16-0,88; 18-0,75; 20-0,6; 22- 0,42; 24-0,36; к 28 нед ППК равен 0,25-0,30 [Javert С., 1957].
При анализе клинических и анамнестических данных особое внимание необходимо уделять исходу предыдущих беременностей, в том числе рождению детей с врожденными пороками, срокам, в которые произошли аборты, наличию гинекогических заболеваний (инфантильная матка, перенесенные острые и хронические аднекситы, фибромиомы матки), расстройству менструальной функции, экстрагенитальньтм заболеваниям (гормональные расстройства, гипертоническая болезнь, пороки сердца), течению беременности (токсикоз, инфекции), профессиональным вредностям.
Цитогенетические исследования необходимо проводить во всех случаях Пустых плодных мешков и множественных пороков развития, а также при наличии локальных пороков у эмбрионов и ранних плодов. Забор материала для культивирования и последующего цитогенетического исследования производят не позже чем через 24 ч после производства аборта в условиях стерильного хранения абортуса. для этих целей у немацерированных абортусов стерильно берут ворсинчатый хорион, отделенный механическим путем от децидуальной ткани, конечности, почки.
Пороки развития у абортусов классифицируются по той же схеме, что и у новорожденных, однако они имеют ряд особенностей.
1. Поскольку в момент прерывания беременности не все органы могут быть сформированы, одни и те же анатомические структуры в зависимости от срока беременности могут расцениваться как физиологическая норма или как порок развития. Например, щель между носовыми и верхнечелюстными отростками можно назвать пороком лишь у эмбрионов длиной свыше 14 мм (старше б нед), локализацию почки в тазу – тазовой эктопией у плодов длиной свыше 30 мм (старше 8 нед), петлю кишки в полости пуповины – грыжей у плодов свыше 55 мм (старше 10 нед), диагноз гидроцефалии достоверен у плодов, теменно-крестцовый размер которых превышает 25 см (возраст свыше 5 мес). И таких примеров множество. Из сказанного очевидно, что непременным условием диагностики пороков развития у абортусов является знание временных и морфологических характеристик формирования органов.
2. Удельный вес пороков развития у абортусов, особенно спонтанных, намного выше, чем в группе детей, умерших в перинатальном периоде. По данным К. Мiller (1970), В. Роland и J. МiIIег (1973), все спонтанные абортусы в возрасте 4 нед оказываются порочно развитыми, у абортусов 5-б нед этот показатель составляет 58-66%, у 7 эмбрионов и плодов – 30-35%, и лишь около 3% плодов имеют пороки развития в случаях СА на 17-28-й неделе беременности.
3. Пороки развития у абортусов чаще, чем у детей, умерших в перинатальный период, сочетаются с аномалиями последа.
4. Нозологические формы пороков у абортусов и их частота значительно отличаются от аналогичных показателей у детей, умерших в перинатальном периоде. Так, у них чаще наблюдаются энцефалоцеле, олигодактилия, эвентрация органов брюшной стенки и грыжи пуповины, расщелины губы и неба, анэнцефалия. Ацефалы и парацефалы, составляющие 2-5% всех спонтанных абортусов, после 27-й недели беременности наблюдаются практически только у асимметричных близнецов. Кро ме того, у абортусов встречаются пороки развития, не известные у новорожденных, например апрозопия.
5. Одним из существенных морфологических различий на рушений развития абортусов по сравнению с пороками развития у детей, умерших в перинатальном периоде, является отсутствие фенотипических критериев диагностики большинства синдромов как хромосомной так и нехромосомной этиологии. Это связано с тем, что полный комплекс фенотипических проявлений, необходимых для диагноза, ко времени гибели эмбриона или раннего плода еще не успевает развиться, или к этому времени многие пороки еще недостаточно выражены, как, например, большинство аномалий лица и пороки развития головного мозга. Кроме того, фенотипический спектр синдромов множественных врожденных пороков, по-видимому, значительно шире, чем тот, который мы наблюдаем у новорожденных или детей более старшего возраста. до перинатального периода до нашиваются лишь те зародыши, которые не имели эмбриолетальных пороков (например, грубых нарушений внезародышевых провизорных органов или биохимических дефектов, несовместимых с внутриутробным развитием). Этим во многом и объясняется тот факт, что хромосомные болезни у детей практически всегда проявляются комплексом множественных врожденных пороков, в то время как у самопроизвольных аборту сов локальные пороки сопровождаются аберрациями хромосом в 41,5 % случаев [ Кулаженко В. П., 1979].
Список литературы
1. Бутомо И. В., Прозорова М. В., Воронцова Н. В. Множественные врожденные пороки развития у новорожденного, обусловленные частичной трисомией длинного плеча хромосомы 6//Вопр. охр. iеат. — 1987. — № 6. — С. 66—69
2. Залетаев Д. В. Хромосомная патология у детей с олигофренией и множественными признаками дисморфогенеза: Автореф. дис. канд. мед, наук. — М., 1985. —24 с.
3. Лазюк Г. И. Патологическая анатомия и дифференциальный диагноз хромосомных болезней, обусловленных изменениями в системе аутосом: Авто реф. дис. докт. мед, наук. — Каунас, 1974.— 46 с.
4. Лазюк Г. И., Лурье И. В., Черствой Е. Д. Наследственные синдромы множественных врожденных пороков развития. — М.: Медицина, 1983. —204 с.
5. Лурье И. В., Румянцева Н. В., Подлещук Л. В. и др. Генетика частичных трисомий. Сообщение I. Трисомия 29//Генетика. — 1986, №6. — С. 1033— 1039.
6. Тератология человека. Руководство для врачей/Кирилл-Т35 лова И. А., Кравцова Г. И., Кручинский Г. В. и др.; Под ред. Г. И. Лазюка.— изд., перераб. и доп.—М.: Медицина, 1991.—480с.: ил.
7. Савенко Л. А. Значение генетических исследований, акушерского анамнеза и особенностей течения беременности для определения риска рождения ребенка с пороками развития: Автореф. дис. кацд. мед. наук. — М., 1975. — 33 с.
8. Сотникова Е. Н. Медико-генетическое консультирование и принципы формирования «групп риска» в детской онкологии: Автореф. двс. докт. мед. наук. — М., 1987. —48 с.
1 Абортус – продукт зачатия, отделившийся от материнского организма в первые 27 нед беременности (считая от превого дня последней ментсруации) в результате аборта.
13






 ыглядит гомогенной, либо дифференциальное окрашивание с помощью флюорохромов, протеаз или денатурирующих методов. Предложенный М. Seabгight (1972) метод обработки препаратов хромосом трипсином нашел наибольшее применение в цитогенетической практике (рис. 1).
ыглядит гомогенной, либо дифференциальное окрашивание с помощью флюорохромов, протеаз или денатурирующих методов. Предложенный М. Seabгight (1972) метод обработки препаратов хромосом трипсином нашел наибольшее применение в цитогенетической практике (рис. 1).  мбрионы и плоды подлежат аутопсии с полной эвисцерацией органов и с после дующим гистологическим исследованием. Возраст эмбрионов и ранних плодов наиболее удобно определять по табл. 1. Начиная с 5-го месяца беременности целесообразнее пользоваться тремя показателями возраста плода: овуляторным сроком беременности, теменно-пяточной длиной и общей массой плода. При сроке беременности 5 мес средняя длина плода составляет 23-25 см, масса – 260-316 г; в б мес – соответственно 29-31 см и 552-630 г; в 7 мес – 35-37 см и 971-1045 г [ Поттер Э., 1971]. Дефицит общей массы у немацерированных эмбрионов и ранних плодов свидетельствует об общей гипоплазии. У поздних плодов (после 20 нед) о гипоплазии можно говорить и в случаях мацерации. Учитывая значительную роль в пренатальной гибели зародышей гипоплазии плаценты, особенно в сочетании с тромбозом, инфарктами и преждевременной отслойкой, необходимо во всех случаях определять плодово-плацентарный показатель (ППК) — отношение массы плаценты к массе плода. ППК для плодов 10 нед равен 2; для плодов 12 нед – 1,67; 14 нед – 1,5; 16-0,88; 18-0,75; 20-0,6; 22- 0,42; 24-0,36; к 28 нед ППК равен 0,25-0,30 [Javert С., 1957].
мбрионы и плоды подлежат аутопсии с полной эвисцерацией органов и с после дующим гистологическим исследованием. Возраст эмбрионов и ранних плодов наиболее удобно определять по табл. 1. Начиная с 5-го месяца беременности целесообразнее пользоваться тремя показателями возраста плода: овуляторным сроком беременности, теменно-пяточной длиной и общей массой плода. При сроке беременности 5 мес средняя длина плода составляет 23-25 см, масса – 260-316 г; в б мес – соответственно 29-31 см и 552-630 г; в 7 мес – 35-37 см и 971-1045 г [ Поттер Э., 1971]. Дефицит общей массы у немацерированных эмбрионов и ранних плодов свидетельствует об общей гипоплазии. У поздних плодов (после 20 нед) о гипоплазии можно говорить и в случаях мацерации. Учитывая значительную роль в пренатальной гибели зародышей гипоплазии плаценты, особенно в сочетании с тромбозом, инфарктами и преждевременной отслойкой, необходимо во всех случаях определять плодово-плацентарный показатель (ППК) — отношение массы плаценты к массе плода. ППК для плодов 10 нед равен 2; для плодов 12 нед – 1,67; 14 нед – 1,5; 16-0,88; 18-0,75; 20-0,6; 22- 0,42; 24-0,36; к 28 нед ППК равен 0,25-0,30 [Javert С., 1957].

















