Просмотр содержимого документа
«Идеалдык газ абалынын тендемеси»
Сабактын аты: Физика
Сабактын мөөнөтү: 45
Сабактын темасы: Идеалдык газ.Кагылышуу саны, эркин жол жүрүүнүн
орточо узундугу.
Сабактын максаты:
a) Билим берүүчүлүк: Идеалдык газ жөнүндө түшүнүк берүү. Эркин жол жүрүүнүн орточо узундугу тууралуу окуучуладын билимин кеңейтүү.
б ) ϴнүктүрүүчүлүк: Окуучулардын ой жүгүртүүсүн жана элестөөсүн өркүндөтүү.
В ) Тарбия берүүчүлүк: Окуучулардын адамдык сапатын өркүндөтүү, адептүүлүккө үйрөтүү.
Сабактын жүрүшү: Саламдашуу;
Окуучулардын катышуусуна көз салуу.
Yй тапшырма: Теманы суроо жооп аркылуу бышыктоо
Сабактын формасы: Аралаш
Сабактын жабдылышы: сүрөттөр, окуу китептери, кроссворд.
Жаңы теманы түшүндүрүү:
Идеалдык газ. Кагылышуу саны, эркин жол жүрүүнүн
орточо узундугу.
Катуу жана суюк заттардан айырмаланып газ өз формасын да, көлөмүн да сактабайт.
Сейректелген газдарда молекулалардын ортосундагы аралык, молекулалардын өз өлчөмдөрүнө караганда көп эсе чоңдук кылат.Ошондуктан, молекулалардын өз ара аракеттешүү күчү жокко эсе жана молекулалардын кинетикалык энергиясы, алардын өз ара аракеттешүүсүнүн потенциалдык энергиясынан бир кыла чоң болуп эсептелет.
Мындай учурда газдын молекулаларын өтө кичинекей катуу шарчалар деп кароого болот. Ал молекулалардын ортосунда тартышуу күчтөрү жокко эсе да, алардын бири бири менен кагылышуу убактысын өтө кыска деп эсептөөгө болот.
Реалдык газадардагы молекулалардын өз ара аракеттешүү күчтөрү өтө татаал.
Ошондуктан жөнөкөй болсун үчүн реалдык газдын ордуна анын физикалык модели катары идеалдык газ алынат.
Молекулалардын арасындагы өз ара аракеттешүү күчү жокко эсе болгон газ идеалдык газ деп аталат.
Газдагы басым.
Басым ,бул басым күчүнүн аянт бирдигине болгон катышы экендиги белгилүү.
Газдын басымы манометр менен ченелет. Газдагы басым эмне себептен пайда болот деген суроо туулат. Молекулалык кинетикалык теориянын негизинде газдын атомдору менен молекулалары хаотикалык кыймылда болгон соң, алар өз ара бири-бирине менен урунушат, өзү турган же жайланышкан идиштин капталдарына урунушат.
Айрым молекуланын , же атомдун урунушуу күчү аз, бирок көп молекуланын урунушуусу сезилээрлик өлчөмдө болот да ошол себептен газда басым пайда болот.
Газдын басымы төмөндөгүдөй формула менен аныкталат:
P=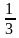
 m
m
Жогорудагы формула идеалдык газдын кинетикалык теориясынын негизги теңдемеси деп аталат. Аны төмөнкүчө өзгөртүп түзсөк болот:
P=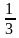
 m
m
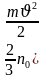 )
)
Мында Е = – бир молекуланын алга жылуу кыймылынын орточо кинетикалык энергиясы деп аталат.
– бир молекуланын алга жылуу кыймылынын орточо кинетикалык энергиясы деп аталат.
Эгер молекуланын орточо кинетикалык энергиясы  =
= экенин эске алсак, анда Р=
экенин эске алсак, анда Р= 
 .
.
Мына ушул формулалар газдын молекулалык –кинетикалык теорисынын негизги теңтемелери болуп эсептелет.
Газдын кыймыл ылдамдыктар ар кандай. Ири молекулалар жайыраак, ал эми майдалары чоңураак ылдамдык менен кыймылдашат. Ошондуктан орточо квадраттык ылдамдык түшүнүгү 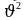 пайда болгон.
пайда болгон.
Yй тапшырма: мисал иштөө, теманы окуп келүү.
Жыйынтыктоо.







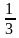
 m
m
 m
m
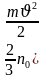 )
) – бир молекуланын алга жылуу кыймылынын орточо кинетикалык энергиясы деп аталат.
– бир молекуланын алга жылуу кыймылынын орточо кинетикалык энергиясы деп аталат. =
= экенин эске алсак, анда Р=
экенин эске алсак, анда Р= 
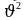 пайда болгон.
пайда болгон. 

















