Муниципальное бюджетное общебразовательное учреждение «Заревская основная школа»
Исследовательский проект по теме
«Оценка и анализ качества питьевой воды
из разных источников»

Выполнил:
ученица 9 класса
МБОУ «Заревская ОШ»
Старостенкова Ксения
Руководитель проекта:
учитель химии
Моисеенкова Татьяна Анатольевна
2020-2021
Оглавление
Введение
Теоретическая часть:
1. Исторические сведения о воде.
Практическая часть:
2. Оценка и анализ качества питьевой воды из разных источников.
2.1. Органолептические показатели воды.
2.2. Определение качества воды методами химического анализа.
Заключение
Список литературы
Приложения
Введение
Вода занимает большую часть нашей планеты, около 70%, и является основой жизни на земле. Без воды невозможно существование всего живого. Даже мы, люди, состоим на 60-70% из воды. Вода, как универсальный растворитель, не может быть заменена ни одним другим веществом, способным обеспечить в полном объеме выполнение всех физиологических функций. Но, как только речь заходит о возможности напоить человечество, то ее оказывается совсем немного. И все это из-за дефицита пресной воды.
Человеческому телу необходима чистая вода, состоящая на 100% из молекул H2O. Но большая часть воды является загрязненной. По данным ВОЗ (Всемирная Организация Здравоохранения), около 80% всех инфекционных болезней в мире связано с низким качеством питьевой воды. Загрязнение водоемов промышленными и бытовыми стоками стало мировым бедствием. Над проблемой очистки и обеззараживания воды работают ученые многих стран, Россия не является исключением.
Актуальность. Использование водных ресурсов представляет собой острую проблему для населения.
Что касается технологий и методов водоочистки, то они производятся устаревшим оборудованием с несоблюдением технологических норм. Немаловажную роль играет несоблюдение элементарных норм личной гигиены.
Использование такой воды может привести к многочисленным опасным заболеваниям. В первую очередь это кишечные инфекции бактериальной природы, к которым относятся холера, брюшной тиф, паратифы А и Б, дизентерия, различные энтериты и энтероколиты.
Было принято решение проверить ситуацию с питьевой водой в нашем районе.
Новизна данного проекта заключается в том, что впервые сделана попытка использовать полученные данные в дальнейшей его реализации.
Проблема. Выбор качественной питьевой воды.
Практическая значимость. Применение данных, полученных в результате нашего исследования, в жизни.
Цель. Провести оценку и анализ качества питьевой воды из разных источников, довести полученные данные до сведения населения.
Задачи:
подобрать необходимый методический материал для исследований;
выбрать наиболее подходящие образцы для работы;
выявить источники наиболее пригодной для использования питьевой воды;
обобщить и оформить результаты в виде таблиц;
дать устные рекомендации населению по использованию питьевой воды.
Объект исследования: Дер. Печерская Буда, дер. Козловка.
Предмет исследования: Пробы воды, отобранные из различных источников (дистиллированная вода, вода из крыницы в деревне Козловка, вода из-под крана в деревне Печерская Буда).
Сроки реализации проекта: сентябрь-февраль 2021 г. (среднесрочный проект)
В проекте были использованы следующие методы:
1. Органолептический метод исследования:
содержание взвешенных частиц – фильтрование;
цвет (окраска) – сравнение на белом фоне;
прозрачность воды – измерение высоты столба воды, с использованием шрифта Снеллена;
запах – определяемый органолептическим методом исследования характера и интенсивности запаха воды при 20°С, с помощью обоняния на основании шкалы силы запаха.
2. Метод химического анализа:
водородный показатель (pH) – индикаторная бумага;
определение карбонатной жесткости воды – индикатор;
обнаружение общего железа – перекись водорода и роданид калия.
Теоретическая часть
1. Исторические сведения о воде
С давнего времени высшие умы человечества задавали себе вопрос: в чём суть воды, какое значение она имеет в человеческой жизни? Первое научное открытие в данной области, которое до нас дошло, называется «Учение о четырёх стихиях».

Оно было написано в четвёртом веке до н. э. древнегреческим философом Аристотелем. В состав четырёх стихий входят земля, огонь, вода и воздух. Причём вода служит источником холода и влаги. В последующее время вода все также приковывала к себе внимание лучших ученых умов своего времени. До восемнадцатого века н. э. это вещество считалось отдельным химическим элементом.
И лишь пока учёный Франции Антуан Лавуазье (известный отечественным школьникам прежде всего тем, что одновременно с нашим выдающимся ученым М.В. Ломоносовым открыл закон сохранения и превращения энергии, о том, кому отдать первенство дискуссии ведутся и по сей день) в 1783 году не повторил эксперименты английского учёного Кавендиша. Опыты заключались в рассоединении воды при помощи электрического тока. Лишь француз смог выявить то, что вода может распадаться на водород и кислород. Поэтому он сделал вывод, что вода является окисью водорода. Данный факт ложится в основу последующих опытов воды.
Но до определения химического состава воды, над её физическими свойствами раздумывали многие великие учёные. Так, Галилео Галилей впервые начал размышлять о том, почему лёд в момент паводков не тонет и плывёт по рекам? Ведь в принципе, твёрдое вещество должно иметь высокую плотность и тяжеловесность, по сравнению с жидким веществом. К тому же, каким образом рыбы могут жить под водой в зимнее время? Они вмерзаются в слои льда? Оказалось, что причиной является способность воды к увеличению плотность только до -3,98С. Ниже этого значения вода теряет свою плотность. По этой причине под слоями льда, которые покрывают в зимнее время водоёмы, вода сохраняет положительную температуру, из-за чего там живут рыбы и другие млекопитающие. Этот фактор знают рыболовы. Закон четырёх градусов доказал и обосновал в 1772 году физик из Франции Делюк.
Всё, что затрагивает термометры, люди, ассоциируют в своём сознании с фамилиями учёных «Кельвин» и «Цельсий». Однако всем интересно будет узнать то, что мысль принять точки плавления и кипения воды в качестве опорных в шкале термометра, сначала посетили немецкого учёного Гюйгенса. Это произошло уже в 1615 г.
Начало девятнадцатого века было ознаменовано изобретением парового транспорта, который помогал приводить в движение первые из железнодорожных составов. Физики из Франции П. Дюлонг и Д. Араго провели изучение взаимосвязи между давлением насыщенного водного пара и температурой воды. Дмитрий Менделеев, популярный создатель периодической таблицы химических элементов, в течение 1891-1897 годов вывел формулу, в которой плотность воды зависит от её температуры. И уже в 1932 г. Учёные из Америки Г. Юрии и Э. Уошберн сделали открытие «тяжёлой воды». Это изотопный вид воды, где лёгкий атом водорода сменяется на тяжёлый «дейтерий». Данная разновидность воды в природе не наблюдается, однако эти научные исследования помогают открыть новые перспективы в промышленности современного мира, в том числе и разработках уникальных нано технологий.
Казалось бы, в наше время учеными открыто уже практически все, и школьникам, осваивающим азы премудрости, некуда больше стремиться. Но это далеко не так, ведь знания человечества подобны шару, и чем больше люди узнают нового, тем больше становится граница соприкосновения их знаний с неизвестным. Вот почему, выполняя домашние задания, например, по учебнику русского языка 5 класса Ладыженской, сегодняшние пятиклассники закладывают фундаментальную базу для того, чтобы вырасти в настоящих исследователей в будущем.
Практическая часть.
2. Оценка и анализ качества питьевой воды из разных источников.
2.1. Органолептические показатели воды.
1) Содержание взвешенных частиц
Данный показатель качества воды определяется фильтрованием определенного объема воды и последующим высушиванием осадка на фильтре. Для анализа возьмем 200 мл воды. Фильтр перед работой взвесим (рис.1). Отфильтруем воду (рис. 2). После фильтрования осадок с фильтром высушим до постоянной массы и взвесим.

Рисунок 1. Определение массы бумажного фильтра (перед работой).




Рисунок 2. Фильтрование воды.
Содержание взвешенных частиц в испытуемой воде определяется по формуле
(m1-m2) * 1000/V, мг/л.
Где m1 – масса бумажного фильтра с осадком взвешенных частиц, мг;
m2 – масса бумажного фильтра до опыта, мг;
V – объем воды для анализа, мл.
Результаты расчетов:
1. Дистиллированная вода.
m1 = 1,0 мг; m2 = 1,0 мг, V = 200 мл
(m1-m2) * 1000/V = (1,0 – 1,0) *1000/200 = 0 мг/л
2. Вода из крыницы.
m1 = 1,8 мг; m2 = 1,0 мг, V = 200 мл
(m1 – m2) * 1000/V = (1,8 – 1,0) * 1000/200 = 4 мг/л
3. Водопроводная вода (из-под крана)
m1 = 4,5 мг, m2 = 1,0 мг, V = 200 мл
(m1-m2) * 1000/V = (4,5 – 1,0) *1000/200 = 17,5 мг/л
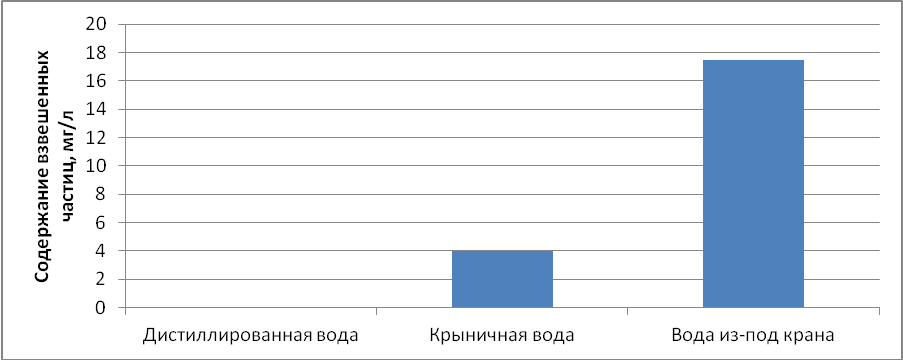
Наибольшее количество взвешенных частиц обнаружено в воде из под крана (17,5 мг/л), у воды из крыницы (4 мг/л), дистиллированная вода без примесей (0 мг/л). Результаты представлены на гистограмме 1 «Содержание взвешенных частиц».
Гистограмма 1. Содержание взвешенных частиц
2) Цвет (окраска)
При загрязнении водоема вода может иметь окраску, не свойственную цветности природных вод. Для источников хозяйственно-питьевого водоснабжения окраска не должна обнаруживаться в столбике высотой 20 см.
Для определения цветности воды был взят стеклянный сосуд и лист белой бумаги. В сосуд набрали воду и на белом фоне бумаги определили цвет воды (рис. 3).

Рисунок 3.Окраска воды слева направо: дистиллированная вода, вода из крыницы, вода из-под крана.
Весе три вида воды оказались бесцветными.
3) Прозрачность воды
Прозрачность воды зависит от нескольких факторов: количество взвешенных частиц глины, песка микроорганизмов, содержание химических соединений.
Всемирная Организация Здравоохранения (ВОЗ) используют единицу измерения мутности NTU (Nephelometric Turbidity Unit – Нефелометрический Блок Мутности, англ.). Соотношение между основными единицами измерения мутности следующее:
1 FTU(ЕМФ)=1 FNU=1 NTU.
ВОЗ по показаниям влияния на здоровье мутность не нормирует, однако с точки зрения внешнего вида рекомендует, чтобы мутность была не выше 5 NTU (нефелометрическая единица мутности), а для целей обеззараживания – не более 1 NTU.
Мера прозрачности – высота столба воды, при которой можно наблюдать опускаемую в воду белую пластину определенных размеров (диск Секки) или различать на белой бумаге шрифт определенного размера и типа (шрифт Снеллена). Результаты выражаются в сантиметрах:
Прозрачная – более 30
Маломутная – от 25 до 30
Средней мутности – от 20 до 25
Мутная – от 10 до 20
Очень мутная – менее 10
Для определения прозрачности воды был использован прозрачный мерный цилиндр с плоским дном, в который налили воду.
Подложили под цилиндр на расстоянии 4 см от дна бумагу с надписью, высота символов которой 2 мм (рис. 4) и сливали воду до тех пор, пока сверху через слой воды не стал четко читаться этот шрифт. Измерив высоту столба оставшейся воды линейкой, выразили степени прозрачности в см. Чем больше высота столба, тем выше степень прозрачности.

Рисунок 4. Надпись на бумаге, высота символа 2 мм.
Результаты измерений:
1. Дистиллированная вода: читается хорошо на расстоянии 30 см.
2. Крыничная вода: читается с трудом на расстоянии 30 см и хорошо на расстоянии 17 см.
3. Вода из-под крана: читается хорошо на расстоянии всего лишь 4 см (рис. 5).
Дистиллированная вода прозрачная (30 см), вода из крыницы мутная (17 см), вода из-под крана очень мутная (4 см) (табл.1).
Таблица 1. Характеристика воды по прозрачности (мутности)
| Образец | Прозрачность | Единица измерения, см |
| Дистиллированная вода | прозрачная | 30 |
| Вода из крыницы | мутная | 17 |
| Вода из-под крана | очень мутная | 4 |

Рисунок 5. Определение прозрачности воды.
4) Запах.
Запах воды обусловлен наличием в ней пахнущих веществ, которые попадают в неё естественным путем и со сточными водами. Определение запаха основано на органическом исследовании характера и интенсивности запаха воды при 20°С.
Как видно в таблице 2, в дистиллированной воде запаха не было обнаружено, вода из крыницы пахнет свежестью, вода из под крана имеет затхлый запах.
Запахи естественного происхождения:
А – Ароматический - Огуречный, цветочный;
Б – Болотный - Илистый, тинистый;
Г – Гнилостный - Фекальный, сточный;
Д – Древесный - Запах мокрой щепы, древесной коры;
З – Землистый - Прелый, запах свежевспаханной земли, глинистый;
П – Плесневый - Затхлый, застойный;
Р – Рыбный - Запах рыбьего жира, рыбный;
С – Сероводородный - Запах тухлых яиц;
Т – Травянистый - Запах скошенной травы, сена;
Н – Неопределенный - Запахи естественного происхождения, не попадающие под предыдущие определения.
Интенсивность запаха по ГОСТ 3351-74 оценивают в шестибальной шкале:
0 - Запахи не ощущаются – «нет»;
1 - Запахи не ощущаются потребителем, но обнаруживаются при лабораторном исследовании – Интенсивность «Очень слабая»;
2 - Запахи замечаются потребителем, если обратить на это его внимание – Интенсивность «Слабая»;
3 - Запахи легко замечаются и вызывают неодобрительные отзывы о воде – «Заметная»;
4 - Запахи обращают на себя внимание и заставляют воздержаться от питья – «Отчетливая»;
5 - Запахи настолько сильные, что делают воду непригодной к употреблению – Интенсивность «Очень сильная».
Таблица 2. Характеристика воды по запаху
| Образец | Характер запаха | Интенсивность запаха |
| Дистиллированная вода | Нет | 0 |
| Вода из крыницы | Н (скорее запах свежести) | 2 |
| Вода из под крана | П | 4 |
2.2. Определение качества воды методами химического анализа
1) Водородный показатель (pH)
Питьевая вода должна иметь нейтральную реакцию (pH – около 6). Значение pH воды водоемов хозяйственного, культурно-бытового назначения регламентируется в пределах 6-9 pH.
pH в исследуемой воде мы оценили с помощью универсальной индикаторной бумаги, сравнивая её окраску со шкалой (рис. 6), (рис. 7).
Растворы и жидкости в отношении их кислотности считаются:
- нейтральными при рН = 7
- кислыми при pH
- щелочными при рН 7

Рисунок 6. Определение pH воды ри помощи универсальной индикаторной бумаги.
Результаты:
1. Кислотность дистиллированной воды – 7 рН (нейтральная).
2. Кислотность крыничной воды – 8 рН (щелочная).
3. Кислотность водопроводной воды – 9 рН (щелочная). (рис. 8)

Рисунок 7. Шкала окраски универсальной индикаторной бумаги

Рисунок 8. Окраска индикаторной бумаги.
2) Определение карбонатной жесткости воды
Различают общую, временную и постоянную жесткость воды.
Общая жесткость обусловлена присутствием растворимых соединений кальция и магния в воде.
Временная жесткость иначе называется устранимой, или карбонатной. Она обусловлена наличием гидрокарбонатов кальция и магния.
Постоянная жесткость (некарбонатная) вызвана присутствием других растворимых солей кальция и магния.
Для определения карбонатной жесткости нальем в колбу 5 мл анализируемой воды и добавим 2-3 капли фенолфталеина (рис. 9). Возникновение розовой окраски говорит о наличии карбонат-ионов. Если окраска не появляется, то карбонат-ионы в пробе отсутствуют (рис. 10).

Рисунок 9. Добавление в образец фенолфталеина.
Результаты (рис. 10):
1. Дистиллированная вода – ионы отсутствуют.
2. Крыничная вода – присутствует небольшое количество ионов.
3. Водопроводная вода – ионы присутствуют.
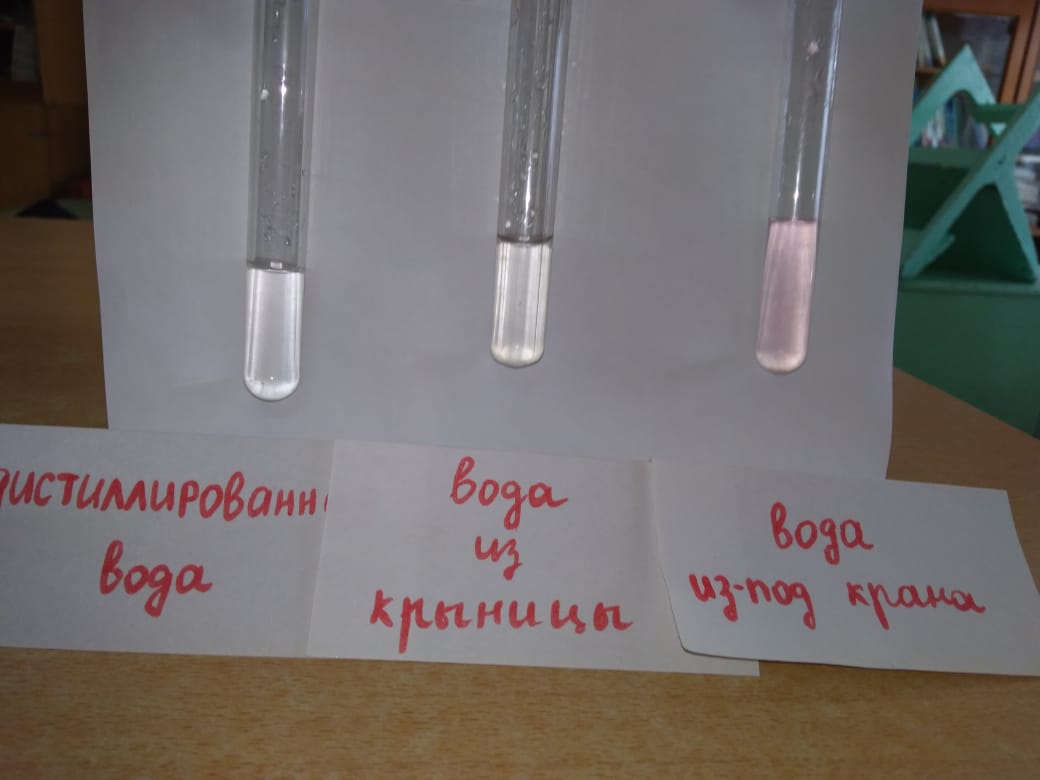
Рисунок 10. Карбонатная жесткость в пробах воды.
3) Обнаружение общего железа
Предельно допустимая концентрация общего железа в воде водоемов и питьевой воде составляет 0,3 мг/л, это лимитирующий показатель вредности. Поместим в пробирку 10 мл исследуемой воды, прибавим одну каплю концентрированной азотной кислоты, несколько капель раствора перекиси водорода и примерно 0,5 мл раствора роданида калия (рис. 11):
MH4NCS+ROH = KNCS+NH3+H2O.


Рисунок 11. Добавление в образцы химических веществ.
При содержании железа 0,1 мг/л появляется розовое окрашивание, а при более высоком – красное.
Результаты (рис. 12):
1. Дистиллированная вода – розового оттенка почти нет (содержание железа Fe близко к 0 мг/л).
2. Крыничная вода – насыщенный розовый оттенок (содержание железа Fe от 0,1 до 0,2мг/л).
3. Водопроводная вода – темно-розовый оттенок (содержание железа Fe – ближе к 0,2 мг/л).
Опытным путем было выяснено, что во всех пробах содержание общего железа не превысила предельно-допустимую концентрацию в 0,3 мг/л (гистограмма 2 «Содержание общего железа»).
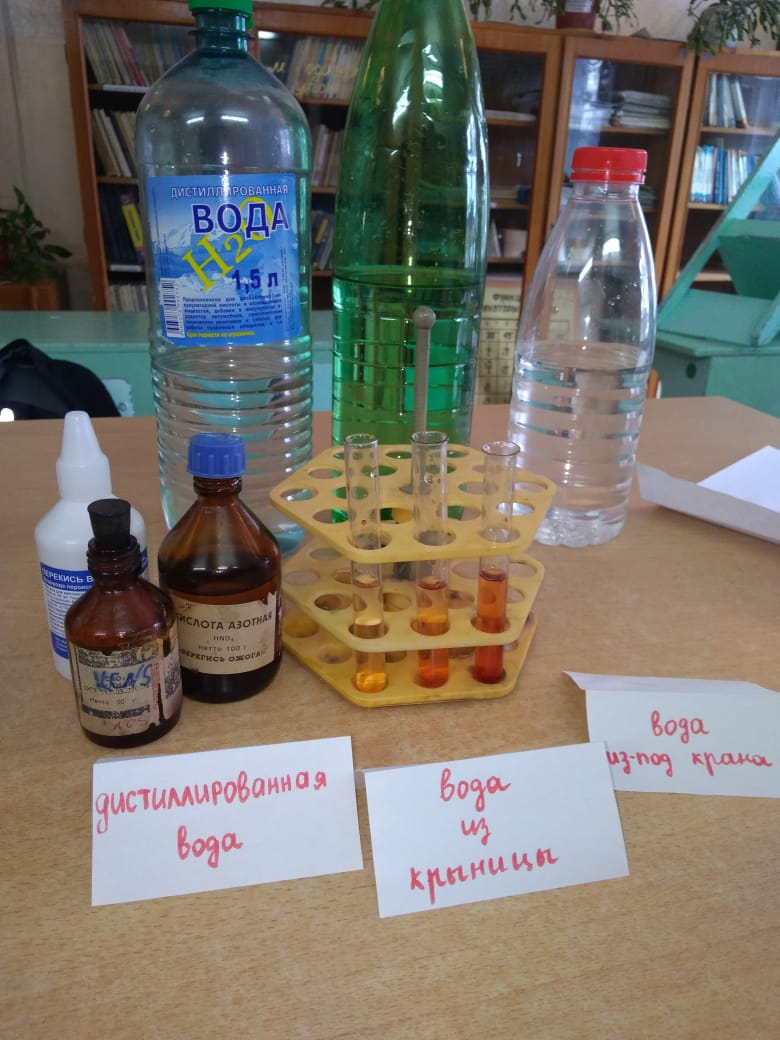

Рисунок 12. Обнаружение общего железа в пробах воды.
Гистограмма 2. Содержание общего железа.
Дистиллированная вода
Крыничная вода
Водопроводная вода
Заключение
Исследованы три образца питьевой воды из разных мест Хиславичского района.
Подобраны два основных метода исследования, которые позволили определить пригодность воды.
Для эксперимента выбраны три образца: крыничная вода, вода из-под крана и для сравнения дистиллированная вода.
Наибольшее количество взвешенных частиц, карбонат-ионы, общее железо – содержит образец водопроводной воды. Этот образец наименее пригодный для питья и приготовления пищи. Небольшое количество перечисленных веществ содержится в воде из крыницы.
Обобщенные результаты представили в таблицах 3 и 4.
Таблица 3. Определение органолептических показателей питьевой воды
| Источник воды | Содержание взвешенных частиц, мг/л | Цвет | Прозрачность, см | Запах | Интенсивность запаха |
| Дистиллированная вода | 0 | Бесцветная | Прозрачная | Нет | 0 |
| Крыничная вода | 4 | Бесцветная | Мутная | Н - свежий | 2 |
| Водопроводная вода | 17,5 | Бесцветная | Очень мутная | П - плесневый | 4 |
| Норма | Менее 10 | Бесцветная | Прозрачная, маломутная | Нет, либо свежий | 0-1 |
Таблица 4. Определение качества воды методами химического анализа
| Источник воды | Водородный показатель | Карбонатная жесткость воды | Содержание общего железа, (мг/л) |
| Дистиллированная вода | pH = 7 (нейтральная) | Ионы отсутствуют | Ближе к 0 |
| Крыничная вода | pH = 8 (щелочная) | Ионы присутствуют в незначительном количестве | От 0 до 0,1, ближе к 0,1 |
| Водопроводная вода | pH = 9 (щелочная) | Ионы присутствуют | От 0,1 до 0,2 ближе к 0,2 |
| Норма | pH = 7 | Ионы отсутствуют | Не более 0,3 мг/л |
Отработаны методики исследования и получены навыки исследовательской работы с лабораторным оборудованием, химическими реактивами.
Полученные при исследовании данные свидетельствуют о низком качестве водопроводной воды.
Жителям я рекомендую обращать особое внимание на качество питьевой воды, а также использовать кипячение и дополнительные системы очистки воды (фильтры-кувшины, проточные фильтры и т.д.).
Список литературы
Гусева Н.Е., Проскурина И.Н. Разработка химического эксперимента с экологическим содержанием // Химия в школе – 2002. – №10 – С. 72
Исаев Д.С. Анализ загрязнений воды // Химия в школе. – 2001. – №5 – С. 77
Химия и экология 8-11 классы: материалы для проведения учебной и внеурочной работы по экологическому воспитанию / сост. Г.А. Фадеева, В.А. Попова. Волгоград: Учитель, 2004.
Харьковская Н.Л., Асеева З.Г. Анализ воды из природных источников // Химия в школе. – 1997. – №3 – С. 72
Шабрева Е.В. Современные экологические проблемы с точки зрения химика // Химия в школе. – 1997. – №1 – С.14
Шестакова Л.Г., Коробейникова Л.А. Мониторинг родников на межпредметной основе // Химия в школе. – 2000. – №5 – С. 52
Интернет-источники













































