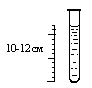© 2021, Цыганкова Татьяна Геннадиевна 585 5


СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Инструкционные карты практических работ профпробы «Вода – самая удивительная жидкость на свете!»
Инструкционные карты содержат требования к технике безопасности, четкое описание алгоритма выполняемых опытов и иллюстрации, что дает возможность обучающимся ясно видеть цель работы. Инструкционные карты составлены в соответствии с требования к программам профессиональных проб.
Просмотр содержимого документа
«Инструкционные карты практических работ профпробы «Вода – самая удивительная жидкость на свете!»»

Инструкционные карты
практических работ
профпробы
«Вода – самая удивительная
жидкость на свете!»
Цыганкова Т.Г.
Инструкционные карты практических работ составлены для проведения профпробы «Вода – самая удивительная жидкость на свете!». ТОГБПОУ «Котовский индустриальный техникум». Котовск, 2018 г., 18 с.
Инструкционные карты содержат требования к технике безопасности, четкое описание алгоритма выполняемых опытов и иллюстрации, что дает возможность обучающимся ясно видеть цель работы. Инструкционные карты составлены в соответствии с требования к программам профессиональных проб.
ТОГБПОУ «Котовский индустриальный техникум», 2018г.
ТРЕБОВАНИЯ К ТЕХНИКЕ БЕЗОПАСНОСТИ
1. ТРЕБОВАНИЯ БЕЗОПАСНОСТИ ПЕРЕД НАЧАЛОМ РАБОТЫ
В лаборатории учащиеся должны работать в белых халатах.
Работу проводить индивидуально, соблюдать тишину.
Проверить наличие необходимого оборудования и реактивов для данной работы.
Предварительно повторить теоретический материал соответствующей главы и ознакомиться с содержанием лабораторной работы.
Уяснить и точно соблюдать порядок и последовательность операций, указанных в руководстве.
Соблюдать все меры предосторожности, указанные в инструкции или сообщенные преподавателем устно.
Внимательно следить за ходом опыта. В случае неудачной постановки опыта и прежде, чем его повторить, следует установить причину; в сомнительных случаях обращаться к преподавателю.
Все работы в учебной химической лаборатории проводят под непосредственным руководством преподавателя.
В лаборатории должны быть инструкции по соблюдению правил техники безопасности при выполнении различных видов работ.
За каждым учащиеся закрепляют постоянное место на рабочем столе, снабженное лабораторными принадлежностями.
К работе в лаборатории допускаются учащиеся, прошедшие инструктаж по технике безопасности и получившие допуск к занятиям. В журнале инструктажа делается соответствующая запись, а учащиеся расписываются в том, что ознакомлены с правилами.
Для обеспечения пожарной безопасности постоянно должны находиться сухой песок, асбестовое одеяло, огнетушители.
Для оказания первой доврачебной помощи в лаборатории должна быть аптечка.
2. ПРИ ПОЛЬЗОВАНИИ РЕАКТИВАМИ НЕОБХОДИМО
ЗНАТЬ СЛЕДУЮЩИЕ ПРАВИЛА
Растворы и твердые вещества для проведения опытов необходимо брать в таком количестве и такой концентрации, как это указано в инструкции. Если нет указаний о дозировке реактивов для данного опыта, то брать их надо в возможно меньшем количестве: 5-7 капель раствора и один микрошпатель твердого вещества.
Все склянки с растворами и сухими веществами держать закрытыми, открывать их только во время употребления.
Не путать пробки от склянок, а также пипетки для взятия реактивов.
Исследуемые растворы наливать в пробирки только при помощи пипеток. При пользовании пипетками нужно следить за тем, чтобы кончик пипетки не касался внутренних стенок пробирки. В случае загрязнения пипетки следует промыть ее дистиллированной водой.
Излишек реактива не высыпать и не выливать обратно в сосуд, из которого он был взят, ибо таким образом можно загрязнить содержимое.
Реактивы общего пользования не уносить на рабочие места; соблюдать порядок в расстановке как реактивов общего назначения, так и реактивов в штативах индивидуального пользования.
Просыпанные и пролитые реактивы необходимо сразу убрать, а стол вымыть и протереть.
Нельзя пробовать вещества на вкус. Все реактивы в той или иной степени ядовиты.
Остатки солей серебра, ртути, а также концентрированных кислот и щелочей выливать в специальные емкости, находящиеся в вытяжных шкафах.
Растворы кислот и щелочей готовить в тонкостенной посуде; кислоту вливать в воду малыми порциями при перемещении.
При разбавлении кислот их приливать в воду, а не наоборот.
Пролитую кислоту или щелочь засыпать песком, а затем убрать совком и щеткой. Загрязненное место нейтрализовать содой, если пролита кислота, или слабый раствор уксусной кислоты, если пролита щелочь.
Запрещается выливать в канализацию растворы кислот и щелочей без нейтрализации.
3. ТЕХНИКА БЕЗОПАСНОСТИ ПРИ РАБОТЕ
В ХИМИЧЕСКОЙ ЛАБОРАТОРИИ
Лабораторный стол необходимо содержать в чистоте и порядке, не загромождать лишними предметами. Портфели и сумки убирать в столы.
Посуда должна быть всегда вымыта; не проводить опыты в загрязненной посуде.
Аккуратно обращаться со стеклянной химической посудой. Остатки разбитой посуды убирать с помощью совка и щетки.
Все работы, связанные с выделением ядовитых, летучих и неприятнопахнущих веществ, проводить в вытяжном шкафу.
Не выполнять дополнительных опытов без разрешения преподавателей.
При определении запаха веществ отверстие сосуда держать на расстоянии 25-30 см от лица, направляя к себе струю газа поступательными движениями ладони от отверстия к лицу.
При наливании реактивов не наклоняться над сосудом во избежание попадания брызг или частиц на лицо или одежду.
При нагревании пробирки не держать ее отверстие к себе или в сторону товарищей.
Горячие предметы можно ставить только на асбестовый картон или асбестовую сетку.
Запрещается хранить и пользоваться легковоспламеняющими жидкостями (бензин, спирт, ацетон и др.) вблизи огня.
В случае воспламенения горючих жидкостей быстро погасить горелку, выключить электроприборы, отставить сосуды с огнеопасными веществами и тушить: накрыть асбестовым или обычным одеялом либо засыпать песком.
Опасны для здоровья пары ртути. Поэтому, если разбит ртутный термометр или пролита ртуть, о случившемся необходимо сообщить преподавателю и принять меры к ее ликвидации.
Запрещается принимать пищу в химической лаборатории и пить воду из лабораторной посуды.
4. ТРЕБОВАНИЯ БЕЗОПАСНОСТИ ПО ОКОНЧАНИИ РАБОТЫ
Все записи наблюдений делать сразу же после окончания опыта в лабораторном журнале.
После окончания работы вымыть использованную посуду и привести в порядок рабочее место.
О всех несчастных случаях немедленно сообщить преподавателю или лаборанту.
5. первая помощь при несчастных случаях в лаборатории
При ранении стеклом убедиться, что в ранке не осталось стекла, быстро протереть ранку ватой, смоченной спиртом, смазать йодом и забинтовать.
При термических ожогах на обоженное место наложить повязку из марли, смоченной концентрированным раствором перманганата калия, или смазать это место мазью от ожогов. Если нет перманганата калия и мази, рекомендуется присыпать питьевой содой и приложить бинт, смоченный холодной водой.
В случае ожога лица, рук кислотой или щелочью обмыть пораженное место большим количеством воды, а затем:
при ожоге кислотами обмыть 2%-ным раствором питьевой соды и раствором KMnO4;
при ожоге щелочами обмыть 1% раствором уксусной или лимонной кислоты. Наложить повязку из бинта, смоченного спиртом.
При попадании кислоты или щелочи в глаза промыть их большим количеством воды, а затем:
при попадании кислоты промыть разбавленным раствором питьевой соды;
при попадании щелочи – 1%-ным раствором борной кислоты.
Если необходимо, то пострадавшего после оказания первой помощи немедленно доставить в медпункт или поликлинику.
Аптечка для оказания первой помощи в лаборатории
1.Бинты.
2.Борная кислота, 2%-ный раствор.
3.Вазелин.
4.Вата.
5. Вишневского мазь.
6. Гидрокарбонат натрия, 1%-ный раствор.
7. Глицерин.
8. Йод, 3%-ный спиртовой раствор.
9. Лейкопластырь.
10. Мензурка для приема лекарств.
11. Нашатырный спирт.
12. Перманганат калия, 2%-ный раствор.
13. Пипетка.
14. Пинцет.
15. Резиновая трубка (жгут) длиной 40 см.
16. Стеклянная ванночка для промывания глаз.
ЗАНЯТИЕ №1
ПРОФЕССИОГРАММА ЛАБОРАТ-ЭКОЛОГ
С первых шагов своего развития человек был неразрывно связан с природой. Он всегда находился в зависимости от ее ресурсов и был вынужден считаться с особенностями образа жизни зверей, рыб и птиц. Представления древнего человека об окружающей среде не носили научного характера, но с течением времени послужили источником накопления экологических знаний.
Многие ученые пытались объяснить процессы питания и роста живых организмов, связь между растениями, животными и человеком. Как самостоятельная наука экология сформировалась к началу XX века.
Термин "экология" был предложен немецким ученым-биологом Эрнестом Геккелем.
В настоящее время экология занимает далеко не последнее место среди других наук. И ее влияние на нашу жизнь велико, т. к. сфера экологии охватывает все структуры нашей планеты, везде - от микромира до космоса.
Экология - изучает состояние воды, земли, воздуха, растений, животных, а также влияние продуктов питания на здоровье людей. Проводит анализ веществ: устанавливает химический состав вещества, определяет свойства вещества. По итогам исследований проводит расчеты. Результаты заносит в журнал.
Лаборант-Эколог должен знать:
Основы общей, аналитической и физической химии;
Правила техники безопасности при проведении лабораторных исследований;
Методы анализа и методики проведения расчетов по их результатам;
Государственные стандарты на анализируемые вещества;
Правила наладки лабораторного оборудования.
Должен уметь:
Налаживать и подготавливать к работе лабораторное оборудование;
Проводить исследование химических и физико-химических свойств вещества;
Оформлять лабораторную документацию.
Профессионально важные качества лаборанта-эколога:
Тонкое цветоразличение;
Обонятельная и осязательная чувствительность;
Точная координация кистей рук;
Хорошая зрительная память;
Аккуратность;
Педантичность.
Медицинские противопоказания:
Заболеваниями органов дыхания;
Сердечно-сосудистой системы;
Органов пищеварения;
Почек и мочевыводящих путей;
Нервной системы;
Кожи с локализацией на кистях рук.
Родственные профессии:
лаборант медицинского анализа,
лаборант химико-бактериологического анализа,
лаборант.
Основные источники загрязнения природных вод
Основной причиной современной деградации природных вод Земли является антропогенное загрязнение. Загрязнение гидросферы, особенно поверхностных вод, огромно и происходит давно. Загрязнение водных систем представляет большую опасность, чем загрязнение атмосферы.
Общая масса загрязнителей гидросферы в мире огромна - около 15 млрд. тонн в год. Под загрязнением водоемов понимается снижение их биосферных функций в результате поступления повышенных концентраций вредных веществ.
Процессы регенерации (самоочищения) протекают в водной среде медленнее, чем в воздухе. Периодичность полного обмена массы воды, которая близка к периоду естественной очистки, составляет: Мировой океан - 2500 лет, подземные воды - 1400 лет, воды озер - 17 лет, воды рек - 16 дней, в живых организмах - несколько часов. В атмосфере периодичность естественной очистки воздуха составляет 8-10 дней.
Источники загрязнения водоемов:
Сточные воды промышленных предприятий;
Сточные воды коммунального хозяйства городов и других населенных пунктов;
Стоки систем орошения, поверхностные стоки с полей и других сельскохозяйственных объектов;
Атмосферные выпадения загрязнителей на поверхность водоемов и водосборных бассейнов.
В воде, как растворителе, увеличивается глубина протекания химических реакций. При этом получаются новые (вторичные) соединения, еще более токсичные, чем первичные.
Виды основных загрязнений океана и континентальных вод планеты:
биологическое,
химическое,
физическое.
Биологическое загрязнение
Сброс в воды водоемов большого количества ряда органических веществ, способных к брожению. Их происхождение различно: сточные городские и промышленные воды, содержащие пищевые продукты и фекалии, сточные воды сахарных заводов и целлюлозно-бумажных комбинатов и т.д. Многие биогенные вещества дают животноводческие комплексы. Чрезмерное обогащение биогенами водоемов приводит к их эвтрофикаци, т.е резкому повышению биопродуктивности. При этом начинается массовое размножение фитопланктона. "Цветение" воды и постепенное отмирание массы водорослей становится источником вторичного загрязнения. Далее водоем медленно «умирает» из-за расходования всех запасов кислорода.
Химическое загрязнение
К наиболее опасным загрязнителям этого вида относятся: соли тяжелых металлов (свинца, ртути, железа, меди). Иногда концентрация ионов этих металлов в теле рыб в 10 раз превышает исходную их концентрацию в водоеме.
Нитраты поступают в воды водоемов через удобрения, а фосфаты - как синтетические моющие средства (CMC). Присутствие CMC в воде придает ей неприятный вкус и запах. Там, где в водоемах течение быстрое, образуется пена. Если концентрация CMC в воде 1 мг/л - гибнет планктон, а если 5 мг/л - происходят заморы рыб. CMC замедляют естественное самоочищение водоемов. Из других химических загрязнителей можно назвать фенолы, пестициды и другие органические яды.
Другим загрязнителем являются нефть и нефтепродукты. Общее загрязнение ими Мирового океана превысило 10 млн. т в год. По оценкам специалистов, нефтью уже загрязнена 1/5 часть акватории Мирового океана. Если пятно нефти небольшое
(до 10 м2), то оно исчезает с поверхности за 24 часа, образуя эмульсию, а тяжелые фракции нефти оседают на дно.
Если размер нефтяного пятна больше, чем 10 м 2, то нефтяная пленка приводит к гибели живых организмов, млекопитающих и птиц; нарушает процессы фотосинтеза, и газообмен между гидросферой и атмосферой.
Физическое загрязнение
Сброс в поверхностные водоемы нерастворенных материалов (глин, как отходов производства при разработке карьеров и шахт). Оседая на дно, глинистая тонкодисперсная фракция может погубить выметанную икру рыб. Видом физического загрязнения является охота. Использование патронов, дроби (сплав свинца и сурьмы) влечет загрязнение этими веществами. Подсчитано, что если 2 млн. охотников сделают хоть 1 выстрел, то выпустят 32 т свинца. Свинец способен накапливаться в водоемах.
К этому виду загрязнения относится и тепловое загрязнение. Подогретая вода от ТЭЦ и других предприятий, поступая в водоем, приводит к повышению температуры воды в нем. Из химии известно, что растворимость газа в воде уменьшается с ростом температуры. Это приводит к уменьшению кислорода в воде. Дыхание биоценозов ухудшается, нарушается равновесие в таких водоемах. Начинают бурно размножаться болезнетворные микроорганизмы и вирусы.
Показатели качества вод
Органолептические (температура, цветность, запах, вкус, мутность, прозрачность, пенистость);
Общесанитарные (водородный показатель, растворенный кислород, биохимическое потребление кислорода;
Санитарно-токсикологические (микробиологические и паразитологические показатели, определение состава воды).
ВОДА – САМАЯ УДИВИТЕЛЬНАЯ ЖИДКОСТЬ НА СВЕТЕ
Что же такое вода? Каковы ее физические свойства, строение, благодаря которым, как писал академик В.И.Вернадский: «…она стоит особняком в истории нашей планеты. Нет природного тела, которое могло бы сравниться с ней по влиянию на ход основных, самых грандиозных геологических процессов. Нет земного вещества-минерала, горной породы, живого тела, которое ее не заключало бы. Все земное вещество ею проникнуто и охвачено.»
ВОДА – Н2О (оксид водорода) – простейшее устойчивое соединение водорода с кислородом.
Некоторые факты о воде:
Количество Воды на поверхности Земли оценивается в 75%;
ПРЕСНЫЕ ВОДЫ в реках, озерах, болотах и водохранилищах составляют 1,9% всего объема воды;
Масса ледников Антарктики, Антарктиды и высокогорных районов – 2%, примерно столько же имеется подземных вод, причем только небольшая их часть – пресные;
В Атмосфере находится примерно 1,3х10¹³ т ВОДЫ;
ВОДА входит в состав минералов и горных пород, присутствует в почве;
ВОДА является обязательным компонентом всех живых организмов.
Основные свойства воды:
Замерзшая вода расширяется на 9% по отношению к прежнему объему. Поэтому лед всегда легче не замершей воды и всплывает вверх. К тому же лед, как и вода, хороший теплоизолятор, поэтому редкий водоем промерзает до дна, и морским животным не очень холодно;
Вода сжимается при охлаждении, но при +4 наступает придел, тут она снова расширяется, хотя температура продолжает понижаться;
Из всех жидкостей, кроме ртути, у воды самое большое поверхностное натяжение;
Вода – лучший растворитель в мире;
Чистая дистиллированная вода почти не электропроводна, но электропроводность водных растворов, например, солей – высокая.
По массе в состав воды входит 88,81% кислорода и 11,19% водорода;
Вода кипит при температуре 100°C и замерзает при 0°C;
Показатель переломления воды равен 1,33;
Скорость звука в воде – 1483 м/с;
Прозрачная, бесцветная, текучая, без запаха.
Значение воды для человека:
Увлажняет кислород для дыхания;
Регулирует температуру тела;
Помогает организму усваивать питательные вещества;
Защищает жизненно важные органы;
Смазывает суставы;
Помогает преобразовать пищу в энергию;
Участвует в обмене веществ;
Выводит различные отходы из организма.
Для нормальной работы всех систем человеку необходимо как минимум 2 литра воды в день. Без воды смерть наступит через 5 ДНЕЙ.
Тело человека почти на 70% состоит из воды, а соленость внеклеточной жидкости соответствует содержанию соли в морской воде.
В теле взрослого человека содержится около 45-55л воды. Кровь состоит из воды на 83%, мышцы – на 75%, мозг – на 85%, сердце – на 75%, кости – на 22%, легкие – на 86%, почки – на 83%, глаза – на 95%.
Применение воды:
Приготовление растворов: в медицине, в пищевой промышленности, в строительстве, в сельском хозяйстве;
Получение водорода;
В паровых турбинах;
Синтез газа;
В системах охлаждения;
Для получения оснований, кислот, органических веществ;
Экологически чистое топливо;
В быту: для стирки, приготовления пищи…
Использование воды:
Водопользование:
Рыбное хозяйство;
Гидроэнергетика (ГЭС);
Речной транспорт;
Купание в реке;
Рыбалка на берегу с удочкой.
РЕЗУЛЬТАТ: водопользователи загрязняют воду, ухудшают ее качество.
Водопотребление:
Промышленность;
Сельское хозяйство;
Коммунальное хозяйство (вода в квартире), полив улицы.
РЕЗУЛЬТАТ: потребление воды становится меньше, т.е. уменьшается ее
количество, но и меняется качество воды из-за стоков.
Основные показатели качества питьевой воды:
Органолептические (мутность, цветность, вкус, запах);
Радиологические;
Бактериологические (общее микробное число, общие колиформные бактерии);
Химические (pH, перманганатная окисляемость, общая жесткость воды, минерализация (сухой остаток), фенольный индекс, ПАВ и др., содержание анионов (нитратов, нитритов, сульфатов, цианидов, хлоридов и гидрокарбонатов), содержание алюминия, бария, бериллия, бора, железа, кадмия, марганца, меди, молибдена, мышьяка, никеля, ртути, селена, свинца, стронция, хрома и цинка).
Очистка воды, доступная каждому:
Кипячение – не лучший, но достаточно широко применяемый способ. Требует систематической очистки стенок сосуда для кипячения.
Серебряная вода – способ дешевый и доступный.
Отстаивание воды – вода отстаивается в ведре в течении нескольких часов. Неплохое осветление. Удаление хлора происходит лишь с 1/3 глубины воды, требуется дальнейшее кипячение.
Получение талой воды – один из доступных и наиболее дешевых способов. Получается достаточно идеальная во всех отношениях вода.
Органолептические свойства воды
Прозрачность – наличие в воде взвешенных частиц (золы), химических примесей, солей. Вода должна быть такой прозрачной, чтобы через ее слой в 30 см можно было прочесть шрифт определенного размера.
Цветность (окраска) – наличие в воде гуминовых веществ (из почвы), размножающихся водорослей, сточных вод. Цветность – не более 200 сравнивают со шкалой стандартных растворов
Мутность – наличие твердых частиц в виде взвеси. Определяют фотометрически.
Запах и вкус может определяться в воде наличием органических веществ растительного происхождения (землистый, травянистый, болотистый). Запах и вкус бывает естественный по происхождению (наличие в воде отмирающих организмов, влияние берегов, почв, грунтов) и искусственный (наличие сельскохозяйственных и промышленных сточных вод). Запах и привкус не более 2 баллов.
ХИМИЧЕСКАЯ ПОСУДА И ЛАБОРАТОРНОЕ ОБОРРУДОВАНИЕ
Классификация химической посуды
По материалу:
посуда из обычного стекла: бутыли для хранения растворов, мензурки и др.;
посуда из специального химически и термически стойкого стекла: пробирки, стаканы, круглодонные колбы и др.;
посуда из кварца: колбы, пробирки, стаканы, выпарительные чашки и др.;
посуда из фарфора: стаканы, тигли, выпарительные чашки, ступки и др.
По назначению
посуда общего назначения: посуда, которая всегда должна быть в лаборатории и без которой нельзя провести большинство работ (пробирки, воронки, стаканы, конические колбы, плоскодонные колбы, и др.);
посуда специального назначения: посуда, которая употребляется для какой-либо цели (дефлегматоры, холодильники, насадки, круглодонные колбы и др.);
мерная посуда: посуда, предназначенная для измерения объемов жидкостей (мерные цилиндры, пипетки, бюретки, мерные колбы и др. ).
Оборудование:
Термометры применяют для измерения температуры. Бывают: ртутные, спиртовые, без шлифа, со шлифом.
Штативы с набором держателей (лапок), колец и муфт служат для закрепления на них посуды и различных приборов
Газовые горелки применяют для нагревания. Бывают различной мощности нагрева
Электрическая сушилка. Применяют для высушивания мытой лабораторной посуды (колбы, химические стаканы и т.д.)
Центрифуга - устройство, служащее для разделения сыпучих тел или жидкостей различного удельного веса и отделения жидкостей от твердых тел путем использования центробежной силы
Весы: Технические весы (точность 2 цифры после запятой), Аналитические весы (точность 4-5 цифр после запятой (в зависимости от модели весов)).
Практическая работа №1
Определение мутности воды
Цель работы: определить мутность воды в исследуемых пробах.
Мутность воды обусловлена содержанием взвешенных в воде мелкодисперсных примесей -нерастворимых частиц различного происхождения. Мутности воды обуславливают и некоторые другие характеристики воды:
наличие осадка, который может отсутствовать быть незначительным, заметным, большим, очень большим.
Материалы и оборудование:
Пробирки стеклянные высотой 10-12 см, лист тёмной бумаги, пробы воды.
Ход работы:
|
| 1. Заполните пробирку водой до высоты 10–12 см. |
|
| 2. Определите мутность воды, рассматривая пробирку сверху на тёмном фоне при достаточном боковом освещении (дневном, искусственном). Выберете подходящее значение из приведённых в таблице показаний мутности воды. |
|
|
|
Таблица 1
| Мутность воды | |
| Мутность не замечена (отсутствует) |
|
| Слабо мутная |
|
| Мутная |
|
| Очень мутная |
|
Практическая работа №2
Определение вкуса воды
Цель работы: определить вкус воды в исследуемых пробах.
Материалы и оборудование:
Колбы, термометр, пробы воды.
Ход работы:
Исследование воды на вкус возможно только в отношении воды заведомо безвредной!
Воду, безопасную в санитарном отношении исследуют с сыром виде. Любую другую -после кипячения и последующего охлаждения до 18-200С. В колбу ёмкостью 150-200мл налить исследуемую воду до 2/3 объёма. Определить температуру воды исследуемой пробы с помощью термометра. Затем подготовленную пробу набрать в рот маленькой порцией (10-15 мл) и держать 10-15 секунд не проглатывая.
Оценку вкуса воды дают по вкусовому ощущению, а также по пятибалльной шкале интенсивности вкуса (таблица №1).
Согласно существующим нормам интенсивность вкуса воды при температуре 200С не должна превышать 2 баллов.:
Таблица №1: Оценка интенсивности вкуса воды.
| №п/п | Оценка в баллах | Характеристика вкуса |
| 1 | 0 | отсутствует |
| 2 | 1 | очень слабый |
| 3 | 2 | слабый |
| 4 | 3 | заметный |
| 5 | 4 | отчётливый |
| 6 | 5 | очень сильный |
Результаты исследования вкуса воды занести в таблицу №2.
Таблица №2: Результаты исследования вкуса воды.
| Номер пробы | Показатели оценки | |
| Вкусовое ощущение | Интенсивность вкуса | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Практическая работа №3
Определение запаха воды
Цель работы: определить запах воды в исследуемых пробах.
Материалы и оборудование:
Колбы с притёртой пробкой, термометр, пробы воды.
Ход работы:
В колбу с притёртой пробкой ёмкостью 200мл налить исследуемую воду до 2/3 объёма. Измерить с помощью термометра температуру исследуемой пробы. Закрыть колбу пробкой и сильно встряхнуть вращательным движением в закрытом состоянии. Затем открыть и сразу же определить обонянием характер и интенсивность запаха.
Дать оценку характера и интенсивности запаха по пятибальной шкале ( Таблица №1). Согласно существующим нормам интенсивность запаха воды при температуре 200С не должна превышать 2 баллов.:
Таблица №1: Оценка интенсивности запаха воды.
| №п/п | Оценка в баллах | Характеристика запаха |
| 1 | 0 | отсутствует |
| 2 | 1 | очень слабый |
| 3 | 2 | слабый |
| 4 | 3 | заметный |
| 5 | 4 | отчётливый |
| 6 | 5 | очень сильный |
Результаты исследования запаха воды занести в таблицу №2.
Таблица №2: Результаты исследования запаха воды.
| Номер пробы | Показатели оценки | |
| Характер запаха | Интенсивность запаха | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Практическая работа №4
Определение прозрачности воды
Цель работы: определить прозрачность воды в исследуемых пробах.
Прозрачность определяется по высоте столба воды через которую можно прочитать текст, напечатанный стандартным шрифтом. Высота столба воды измеряемая в см указывает на степень её прозрачности.
Прозрачность воды зависит от количества механических взвешенных нерастворимых в воде частичек (мути), химических соединений, присутствующих микроорганизмов.
Материалы и оборудование:
Бесцветный цилиндр с плоским дном с градуировкой через 1см, пробы воды.
Ход работы:
Исследуемую воду взболтать и налить в специальный градуированный цилиндр высотой 30 см. Под цилиндр поместить печатный шрифт ( газета, книга) и попытаться различить буквы через столб воды в цилиндре. Если вода мутная шрифт прочесть не удаётся, воду сливаем в подготовленную чашу до тех пор пока буквы шрифта станут различимыми. Отметить высоту столба воды в цилиндре (можно линейкой), при котором возможно чтение шрифта.
Питьевая вода должна иметь прозрачность не ниже 30 см. При прозрачности 20-30 см высоты водного столба, вода признаётся слабо мутной. Мене 10 см очень мутной.
Результаты исследования прозрачности воды занести в таблицу №1.
Таблица №1: Результаты исследования прозрачности воды.
| Номер пробы | Показатели оценки | |
| Характеристика прозрачности | Прозрачность, см | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Практическая работа №5
Определение цветности воды
Цель работы: определить цветность воды в исследуемых пробах.
Цветность воды зависит от присутствующих в воде химических веществ, измеряющих цвет, либо от наличия в воде микроорганизмов. В соответствии с гигиеническими требованиями питьевая вода не должна иметь цветность и содержать не различимых невооружённым глазом водных организмов и поверхностную плёнку.
Материалы и оборудование:
Пробирки стеклянные высотой 10-12 см, плотные фильтры, воронка, мерный стакан, пробы воды, белый лист бумаги( в качестве фона).
Ход работы:
Провести фильтрование образца пробы воды с помощью воронки и фильтра в мерный стакан.
|
| 2. Заполните пробирку водой до высоты 10–12 см. |
|
| 3. Определите цветность воды, рассматривая пробирку сверху на белом фоне при достаточном боковом освещении (дневном, искусственном). Отметьте наиболее подходящий оттенок из приведённых в табл. 1 либо заполните свободную графу в таблице. |
Таблица №1
| Цветность воды | |
| Слабо-желтоватая | Коричневатая |
| Светло-желтоватая | Красно-коричневатая |
| Желтая | Другая (укажите какая) |
| Интенсивно-желтая |
|
ЗАНЯТИЕ №1
ОЧИСТКА СТОЧНЫХ ВОД
Сточные воды – это воды, отводимые системой труб или каналов (система канализации)
после использования в процессе бытовой или производственной деятельности человека.
Они также образуются в результате выпадения осадков и стока поливомоечных вод на территориях населенных мест и промышленных предприятий.
Виды сточных вод:
бытовые (хозяйственно-фекальные);
производственные (промышленные);
дождевые (атмосферные);
городские (представляют собой смесь бытовых и промышленных сточных вод).
Виды очистки сточных вод:
механические,
физические,
физико-химические,
химические,
биологические.
Механические методы очистки
Здесь производится предварительная очистка, поступающих на очистные сооружения, сточных вод с целью подготовки их к биологической очистке. На механическом этапе происходит задержание нерастворимых примесей.
Сооружения для механической очистки сточных вод:
решётки (или УФС — устройство фильтрующее самоочищающееся) и сита;
песколовки;
первичные отстойники;
фильтры;
септики.
Отбросы с решёток вывозят в места обработки твёрдых бытовых и промышленных отходов. Затем стоки проходят через песколовки, где происходит осаждение мелких частиц (песок, шлак, битого стекла т. п.) под действием силы тяжести, и жироловки, в которых происходит удаление с поверхности воды гидрофобных веществ путём флотации. Песок из песколовок обычно складируется или используется в дорожных работах.
Первичные отстойники предназначены для осаждения взвешенной органики. Это железобетонные резервуары глубиной три-пять метров, радиальной или прямоугольной формы. В их центры снизу подаются стоки, осадок собирается в центральный приямок проходящими по всей плоскости дна скребками, а специальный поплавок сверху сгоняет все более лёгкие, чем вода, загрязнения в бункер.
Физические методы очистки воды
Такие методы способны убрать из воды грубодисперсные частицы, микрочастицы, взвеси, коллоиды, растворенные газы, соли тяжелых металлов, микробиологическое загрязнение.
Ультрафиолетовое излучение способно убить все микроорганизмы, находящиеся в воде. Длина волны уф-излучения эффективно разрушает клетки болезнетворных бактерий. Такой эффект делает УФ-излучатель одним из самых эффективных стерилизаторов воды.
Метод осмотического давления. Под действием осмотического давления вода, содержащая загрязнения, проникает сквозь специальную полимерную мембрану. Полимерная мембрана в фильтре обратного осмоса пропускает только молекулы воды и кислорода, задерживая молекулы всех посторонних растворенных веществ, а также бактерии и вирусы. Обратно осмотический фильтр не будет работать, если в водопроводе давление меньше 2,5-3 атм.
Физико-химические методы очистки:
Аэрация;
флотация;
сорбция;
центрифугирование;
ионообменная и электрохимическая очистка;
гиперфильтрация;
нейтрализация;
экстракция;
выпаривание и кристаллизация;
коагуляция.
Метод основанный на эффекте флотации, хорошо освобождает воду от мелкодисперсных и коллоидных частиц. Газ пропускается сквозь жидкую массу стоков. При этом каждый пузырек газа под действием молекулярных сил "слипается" с частицей загрязнения. Пузырьки скапливаются на поверхности в виде пены, которую несложно убрать механическим способом.
В электрохимическом методе очистки воды или коагуляции используется явление оседания коллоидных частиц при воздействии постоянного тока.
Химические методы очистки
Химические способы очистки воды построены на использовании химических взаимодействий между различными элементами и соединениями. Реагенты подбираются строго по результатам химического анализа воды. Реагенты вступают в химические реакции с загрязнениями, полностью разлагая их, переводя в безопасную для человека форму, либо в твердый осадок, задерживаемый фильтром.
Настроить химический фильтр (выбрать реагенты) можно очень точно - так, что удаляться из воды будут только вредные примеси. При этом очищенная вода не будет "мертвой", стерильной - в ней останутся соли, необходимые для поддержания водно-солевого баланса в организме человека.
Биологические методы очистки
Биологическая очистка предполагает очистку растворенной части загрязнений сточных вод (органические загрязнения, биогенные вещества - азот и фосфор) бактериями и простейшими или дождевыми червями, которые называются активным илом или биопленкой.
Могут использоваться как аэробные, так и анаэробные микроорганизмы.
На данный момент основными типами биологической очистки являются активный ил (аэротенки) биофильтры и метантенки (анаэробное брожение).
Также в биологической очистке, после аэротенков существует вторичные отстойники в которых находятся илососы, предназначенные для удаления активного ила со дна вторичных отстойников и возврат в аэротенки. Лишний ил выводится из системы.
Дезинфекция сточных вод
Для обеззараживания биологически очищенных сточных вод, наряду с ультрафиолетовым облучением применяется также обработка хлором в течение 30 минут. Поскольку хлор довольно токсичен и представляет опасность, очистные предприятия многих городов России уже активно рассматривают другие реагенты для обеззараживания сточных вод, такие как гипохлорит, и озонирование.
Практическая работа №6
Определение температуры и плотности воды.
Цель работы: определить температуру и плотность воды в исследуемых пробах.
Материалы и оборудование:
Цилиндры ёмкостью 100 мл, термометр, ареометр, пробы воды.
Ход работы:
Исследуемой водой наполняют мерный цилиндр и определяют её температуру, погружая нижнюю часть термометра в воду и через 5 минут снимают отчёт показаний. Температура измеряется в градусах Цельсия. Температура исследуемой пробы должна быть 200С.
В цилиндр с анализируемой пробой воды осторожно опускают чистый сухой ареометр. Погружать ареометр в жидкость следует осторожно, не выпуская его из рук до тех пор, пока не станет очевидным, что он плавает. При этом ареометр должен находиться в центре цилиндра и ни в коем случае не касаться стенок и дна цилиндра.
Отсчёт производят по делениям шкалы ареометра через 3-4 минуты после погружения по нижнему мениску жидкости. После определения плотности ареометр моют, вытирают и убирают в специальный футляр.
Результаты исследования температуры и плотности воды занести в таблицу №1.
Таблица №1: Результаты исследования температуры и плотности воды.
| Номер пробы | Показатели оценки | |
| Температура воды | Плотность воды, г/см2 | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Практическая работа №7
Определение содержание вредных органических веществ в исследуемой пробе воды.
Цель работы: Определить содержание вредных органических веществ в исследуемой пробе воды.
Материалы и оборудование:
Перманганат калия 5% раствор, штатив с пробирками, спиртовка, спички, пробиркодержатель, исследуемая пробы воды.
Ход работы:
В пробирку наливаем 5 мл исследуемой пробы воды. Приливаем одну каплю 5% раствора перманганата калия. Зажимаем пробирку в пробиркодержателе. Зажигаем спиртовку. Осторожно нагреваем пробирку по всей поверхности над пламенем спиртовки. Исчезновение окраски в исследуемой пробе воды указывает на присутствие органических веществ в ней.
Изменение или исчезновение окраски в исследуемой пробе воды занести в таблицу №1.
Таблица №1.
|
Исследуемая проба воды |
Окраска перманганата калия |
| Дистиллированная вода |
|
| Водопроводная вода |
|
| Речная вода |
|
Практическая работа №8
Определение содержания йода в исследуемой пробе воды.
Цель работы: определить содержания йода в исследуемых пробах воды.
Материалы и оборудование:
Штатив с пробирками, мерный цилиндр, стеклянная палочка, стеклянная трубочка, йодистый калий, буферный раствор, крахмал (клейстер заранее приготовленный), гипосульфат натрия (серноватистокислый натрий или фиксаж), пробы воды для исследований.
Ход работы:
В пробирку поместить йодистый калий, добавить буферный раствор, налить исследуемые пробы воды. Содержимое пробирки перемешать.
Затем добавить несколько капель предварительно приготовленного крахмала (клейстер). Содержимое пробирки перемешать. Цвет пробы в пробирке должен стать синим.
Чтобы вода стала прозрачной необходимо добавить гипосульфат нартия (Na2S2O3 х 5H2O).
Вывод: посинение пробы свидетельствует о содержании йода в воде.
Практическая работа №9
Определение реакционной среды исследуемых проб воды с помощью индикаторов.
Цель работы: определить pH реакционной среды исследуемых проб воды с помощью индикаторов.
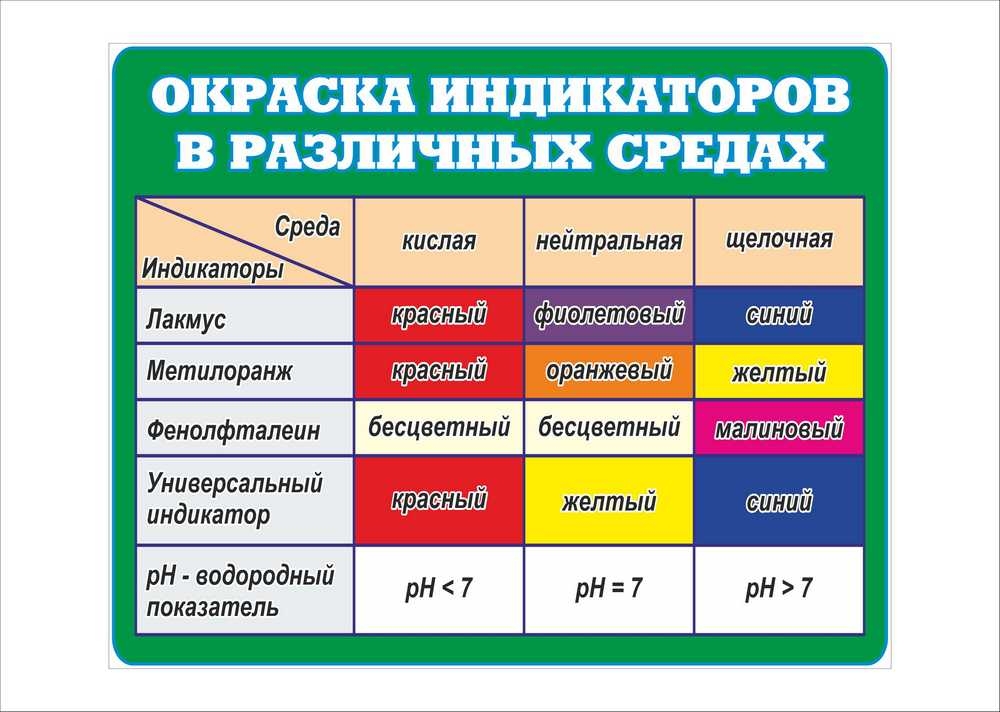
Вещества, обладающие способностью менять свою окраску в присутствии кислот и щелочей, называются индикаторами и применяются для определения реакционной среды. Среда может быть кислой, щелочной и нейтральной. Этими веществами пропитывают фильтровальную бумагу. Существует много видов различных индикаторных бумаг (словосочетание «лакмусовая бумажка»), точнее индикаторов, которыми пропитывают бумагу (лакмус, фенолфталеин, метиловый оранжевый и т.д.). Для определения кислотности или щелочности среды можно пользоваться бумажкой, пропитанной раствором любого индикатора.Для удобства оценки среды введено выражение рН (читается «пэ-аш»). рН называется водородным показателем. Это понятие ввёл датский химик Сёренсен в 1909 году: буква «р» - начальная буква датского слова potenz – математическая степень, буква «Н» - символ водорода.
Материалы и оборудование:
Штатив с пробирками, индикаторы: универсальная лакмусовая бумага, метилоранжевый, фенолфталеин, пробы воды для исследований.
Ход работы:
Необходимо окунуть узкую полоску бумаги в исследуемую пробу воды на две-три секунды. Сравнить с прилагаемой цветовой шкалой и вычислить значения.
В нейтральном растворе при 25°С рН = 7. В кислых растворах рН 7, чем больше щёлочность раствора, тем его значение больше.
Вывод: чем меньше рН, тем больше концентрация ионов Н+, т. е. выше кислотность среды, и наоборот, чем больше рН, тем меньше концентрация ионов Н+, т. е. выше щёлочность среды.
Параметры индикаторной бумаги: измерение pH от 1 до 14. Индикаторная бумага может иметь вид полосок, рулонов, в коробках, в тубусах, пеналах, отрывная. Универсальной индикаторной бумагой пользуются только для приближённого определения значений рН в широких пределах с точностью около одной единицы рН или десятой доли.
Таблица показаний значений pH.
| Среда раствора | pH | Исследуемые пробы |
| Сильнокислая | 0 1 2 3 |
|
| Слабокислая | 4 5 6 |
|
| Нейтральная | 7 |
|
| Слабощелочная | 8 9 10 |
|
| Щелочная | 11 12 13 14 |
|
. 
ПРОВЕРОЧНАЯ РАБОТА (ТЕСТ) ПО ПРОФЕССИОНАЛЬНОЙ ПРОБЕ:
«Вода – самая удивительная жидкость на свете »
Вариант 1
1. Оболочка биосферы, включающая океаны, моря, реки...
а) атмосфера;
б) гидросфера;
в) ноосфера.
2. Воды, находящиеся в толщах горных пород
а) надземные;
б) подземные;
в) грунтовые.
3. Стоки воды, загрязненные свинцом, медью, ртутью и т. п.
а) сельскохозяйственные;
б) промышленные;
в) коммунальные.
4. Отработанная вода
а) сточная;
б) проточная;
в) водопроводная.
5. Система действий по наблюдению за экологическим состоянием окружающей среды.
а) информация;
б) мониторинг;
в) отслеживание.
6. Один из методов очистки сточных вод при помощи микроорганизмов.
а) механический;
б) химический;
в) биологический.
7. Людям требуется вода...
а) любая;
б) с питательными примесями;
в) чистая. 8. Водяной пар — это...
а) вода в жидком состоянии;
б) вода в газообразном состоянии;
в) вода в парообразном состоянии.
9. Когда быстрее высыхают лужи после дождя?
а) осенью;
б) летом;
в) нет разницы.
10. Почувствует ли человек изменение в своем организме, если резко сменит один вид воды на другой?
а) да;
б) немного;
в) нет.
11. Сколько дней человек может прожить без воды?
а) 2 дня;
б) 5 дней;
в) 7 дней.
Вариант 2
1. Наука о связях между живыми существами и окружающей среды
а) экология;
б) биология;
в) психология.
2. Подземные источники питьевой воды.
а) родники, снеговая вода;
б) родники, колодцы;
в) скважины, дождевая вода.
3. Хозяйство отправляющее в реки фекальные воды, химические вещества и т. п.
а) коммунальное;
б) промышленное;
в) сельскохозяйственное.
4. Хозяйство, на полях которого используется удобрения.
а) транспортное;
б) промышленное;
в) сельское.
5. Процесс "цветение" воды.
а) фитофикация;
б) эвтрофикация;
в) нет правильного ответа.
6. Наука изучающая вещества.
а) биология;
б) химия;
в) экология.
7. Из-за чего зимой иногда лопаются водопроводные трубы?
а) вода сильно сжимается и давит на трубы;
б) вода замерзая, расширяется, давит на трубы;
в) от высокой температуры воды в трубах.
8. Вода в природе находится в нескольких состояниях.
а) только в жидком и твёрдом;
б) твёрдом и газообразном;
в) твёрдом, жидком, газообразном.
9. Вода не имеет...
а) цвета, но имеет запах;
б) цвета и запаха;
в) оба ответа правильные.
10. Она входит в состав любого организма.
а) сода;
б) вода;
в) глина.
11. Сколько воды должен пить взрослый человек в день? ______________
Вариант 3
1. Наука о связях между живыми существами и окружающей среды
а) экология;
б) биология;
в) психология.
2. Стоки воды, загрязненные свинцом, медью, ртутью и т. п.
а) сельскохозяйственные;
б) промышленные;
в) коммунальные.
3. Процесс "цветение" воды.
а) фитофикация;
б) эвтрофикация;
в) нет правильного ответа.
4. Водяной пар — это...
а) вода в жидком состоянии;
б) вода в газообразном состоянии;
в) вода в парообразном состоянии.
5. Сколько воды должен пить взрослый человек в день? ______________
6. Воды, находящиеся в толщах горных пород
а) надземные;
б) подземные;
в) грунтовые.
7. Наука изучающая вещества.
а) биология;
б) химия;
в) экология.
8. Оболочка биосферы, включающая океаны, моря, реки...
а) атмосфера;
б) гидросфера;
в) ноосфера.
9. Система действий по наблюдению за экологическим состоянием окружающей среды.
а) информация;
б) мониторинг;
в) отслеживание.
10. Подземные источники питьевой воды.
а) родники, снеговая вода;
б) родники, колодцы;
в) скважины, дождевая вода.
11. Почувствует ли человек изменение в своем организме, если резко сменит один вид воды на другой?
а) да;
б) немного;
в) нет.
Вариант 4
1. Она входит в состав любого организма.
а) сода;
б) вода;
в) глина.
2. Вода не имеет...
а) цвета, но имеет запах;
б) цвета и запаха;
в) оба ответа правильные.
3. Процесс "цветение" воды.
а) фитофикация;
б) эвтрофикация;
в) нет правильного ответа.
4. Наука изучающая вещества.
а) биология;
б) химия;
в) экология.
5. Вода в природе находится в нескольких состояниях.
а) только в жидком и твёрдом;
б) твёрдом и газообразном;
в) твёрдом, жидком, газообразном.
6. Сколько дней человек может прожить без воды?
а) 2 дня;
б) 5 дней;
в) 7 дней.
7. Из-за чего зимой иногда лопаются водопроводные трубы?
а) вода сильно сжимается и давит на трубы;
б) вода замерзая, расширяется, давит на трубы;
в) от высокой температуры воды в трубах.
8. Людям требуется вода...
а) любая;
б) с питательными примесями;
в) чистая.
9. Подземные источники питьевой воды.
а) родники, снеговая вода;
б) родники, колодцы;
в) скважины, дождевая вода.
10. Хозяйство отправляющее в реки фекальные воды, химические вещества и т. п.
а) коммунальное;
б) промышленное;
в) сельскохозяйственное
11. Стоки воды, загрязненные свинцом, медью, ртутью и т. п.
а) сельскохозяйственные;
б) промышленные;
в) коммунальные.