Бинарный урок по химии и биологии
Тема: БЕЛКИ.
Подготовлена преподавателем биологии Ильченко И.И.
Преподавателем химии Пунько В.Н.

Белки
- Жизнь – это форма существования белковых тел
- Белок – это мышцы, соединительные ткани (сухожилия, связки, хрящи).
- Белковые молекулы включены в состав костной ткани.
- Из особых форм белка сотканы волосы, ногти, зубы, кожный покров.
- Из белковых молекул образуются отдельные очень важные гормоны, от которых зависит здоровье.
- Большинство ферментов также включают белковые фрагменты, а от ферментов зависит качество и интенсивность происходящих в организме физиологических и биохимических процессов.
- Содержание белков в различных тканях человека неодинаково. Так, мышцы содержат до 80% белка, селезенка, кровь, легкие – 72%, кожа – 63%, печень – 57%, мозг – 15%, жировая ткань, костная и ткань зубов – 14–28%.

В состав белков входят:
Гемоглобин - С 3032 H 4816 O 872 N 780 S 8 Fe 4
Mr белка яйца = 36 000,
Mr белка мышц = 1 500 000.
водород
углерод
азот
кислород
фосфор
сера
железо
другие элементы
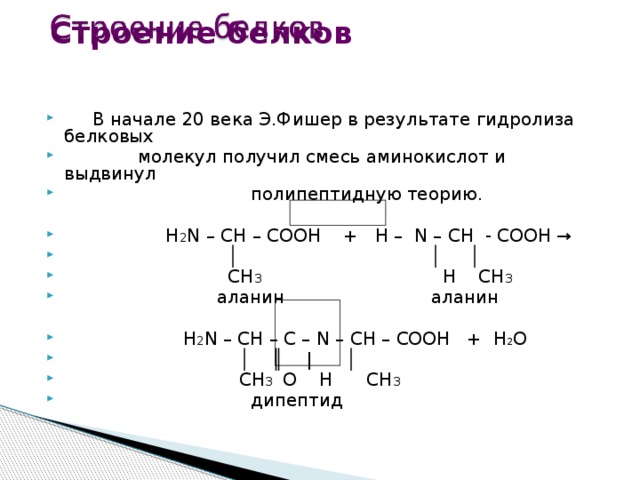
Строение белков
- В начале 20 века Э.Фишер в результате гидролиза белковых
- молекул получил смесь аминокислот и выдвинул
- полипептидную теорию.
- H 2 N – CH – COОН + Н – N – CH - COOH →
- │ │ │
- CH 3 H CH 3
- аланин аланин
- H 2 N – CH – C – N – CH – COOH + Н 2 О
- │ ║ | │
- CH 3 О Н CH 3
- дипептид
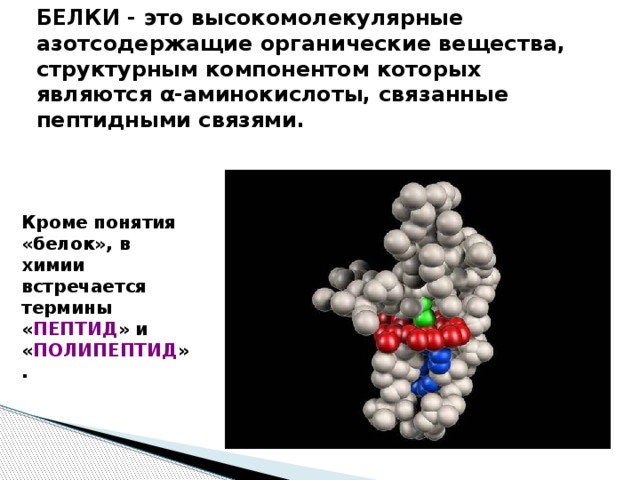
БЕЛКИ - это высокомолекулярные азотсодержащие органические вещества, структурным компонентом которых являются α-аминокислоты, связанные пептидными связями.
Кроме понятия «белок», в химии встречается термины « ПЕПТИД » и « ПОЛИПЕПТИД ».

В состав белков входит 20 различных аминокислот.
Из них может быть образовано 2 432 902 008 176 640 000 комбинаций, т.е. различных белков

Источники аминокислот
Основным источником α - аминокислот для живого организма служат пищевые белки , которые в результате ферментативного гидролиза в желудочно-кишечном тракте дают α - аминокислоты. Многие α - аминокислоты синтезируются в организме, а некоторые необходимые для синтеза белков α - аминокислоты не синтезируются в организме и должны поступать извне. Такие аминокислоты называются незаменимыми.
Их всего восемь: лизин, метионин, триптофан, лейцин, изолейцин, валин, треонин и фенилаланин.
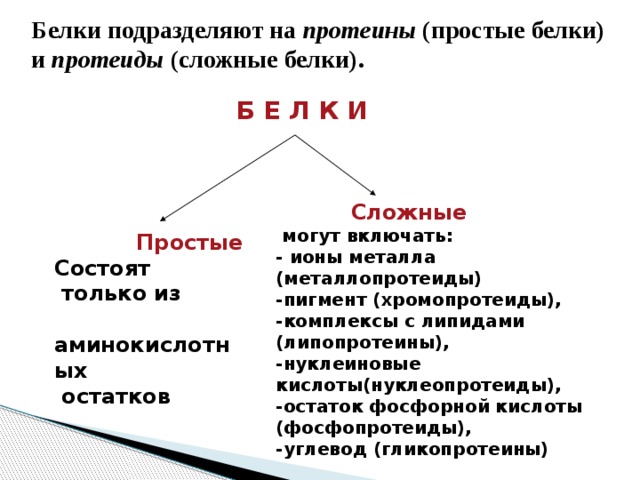
Белки подразделяют на протеины (простые белки) и протеиды (сложные белки).
Б Е Л К И
Сложные
могут включать:
- ионы металла (металлопротеиды)
-пигмент (хромопротеиды),
-комплексы с липидами (липопротеины),
-нуклеиновые кислоты(нуклеопротеиды),
-остаток фосфорной кислоты (фосфопротеиды),
-углевод (гликопротеины)
Простые
Состоят
только из
аминокислотных
остатков
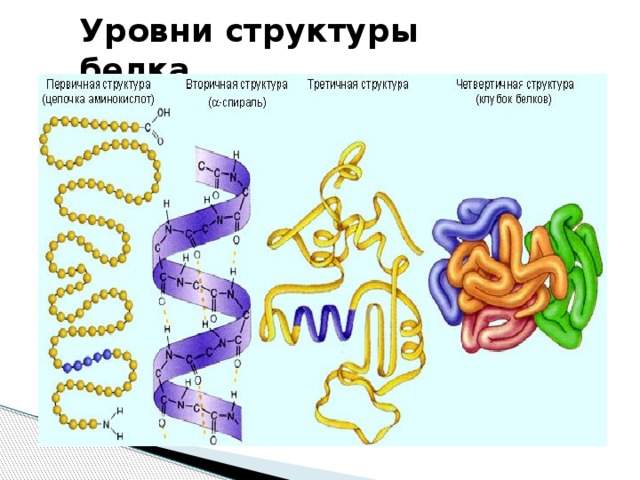
Уровни структуры белка.
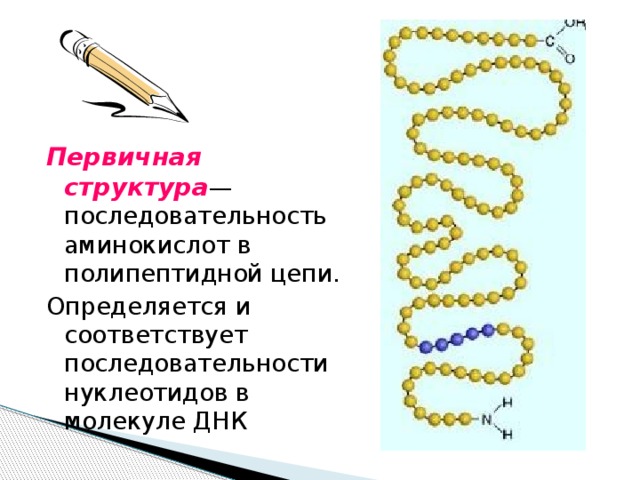
Первичная структура — последовательность аминокислот в полипептидной цепи.
Определяется и соответствует последовательности нуклеотидов в молекуле ДНК
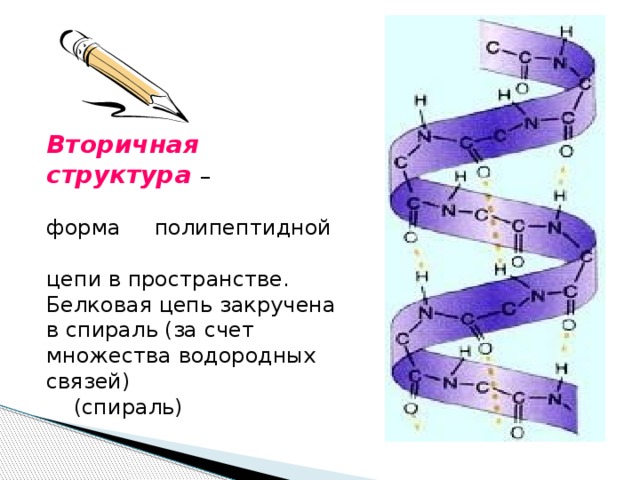
Вторичная структура –
форма полипептидной
цепи в пространстве.
Белковая цепь закручена в спираль (за счет множества водородных связей)
(спираль)
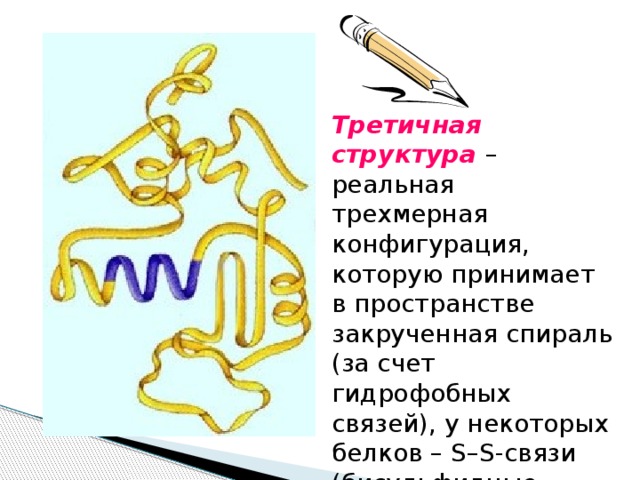
Третичная структура – реальная трехмерная конфигурация, которую принимает в пространстве закрученная спираль (за счет гидрофобных связей), у некоторых белков – S–S-связи (бисульфидные связи)
(клубок)

Четвертичная структура — субъединичная структура белка. Взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
Сигнальная( рецепторная) функция
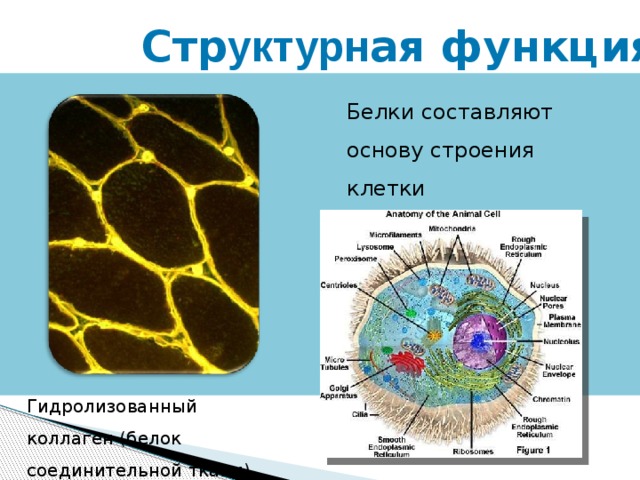
Стр уктурн ая функция
Белки составляют основу строения клетки
Гидролизованный коллаген (белок соединительной ткани)
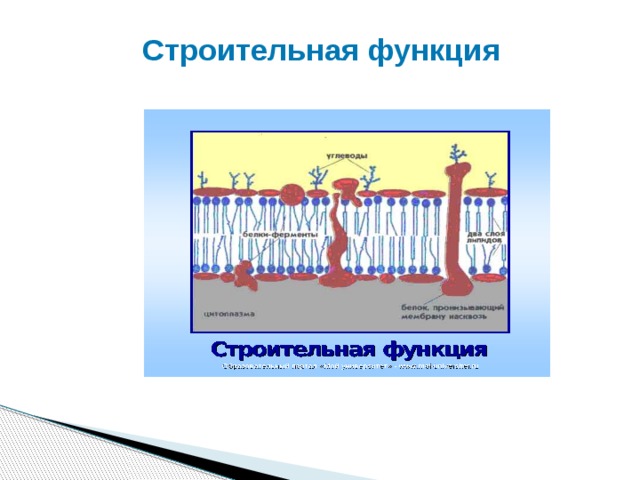
Строительная функция
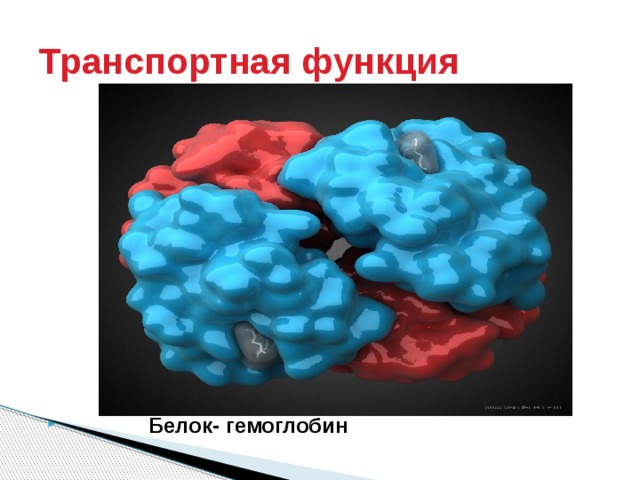
Транспортная функция

ЭНЕРГЕТИЧЕСКАЯ ФУНКЦИЯ
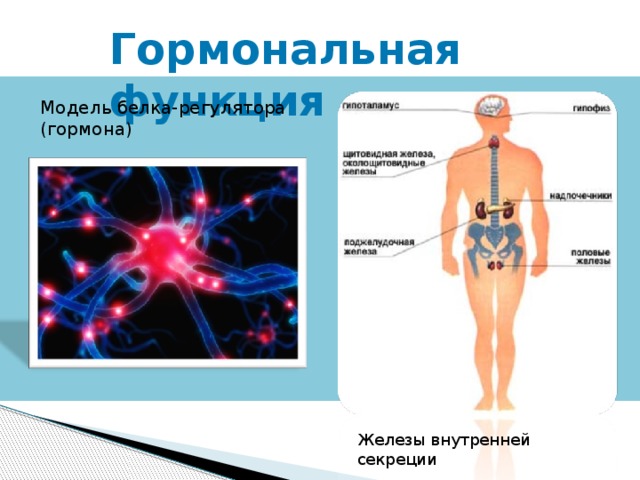
Гормональная функция
Модель белка-регулятора (гормона)
Железы внутренней секреции

Гормональная функция

Защитная функция
Антитела обезвреживают вещества, поступающие в организм или появляющиеся в результате жизнедеятельности бактерий и вирусов
Белок плазмы крови фибриноген, участвуя в свертывании крови, уменьшает кровопотери.

Токсическая функция
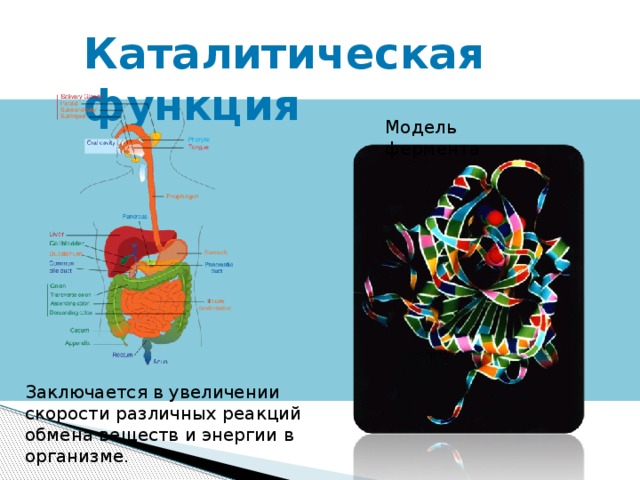
Каталитическая функция
Модель фермента
Заключается в увеличении скорости различных реакций обмена веществ и энергии в организме.

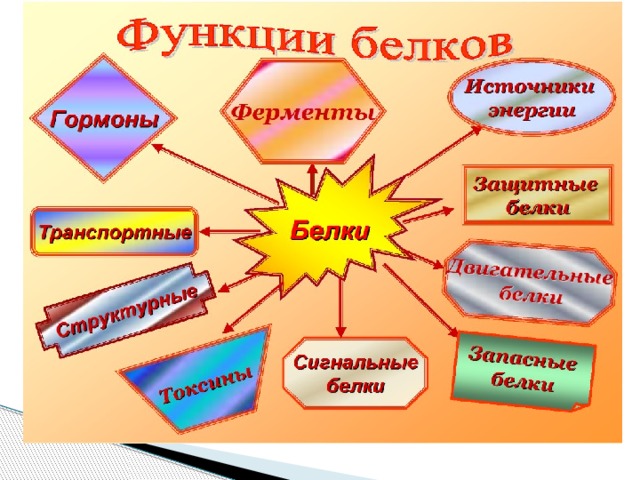
ФУНКЦИИ БЕЛКОВ
► Строительная – белки участвуют в образовании оболочки клетки, органоидов и мембран клетки. Из белков построены кровеносные сосуды, сухожилия, волосы
► Каталитическая – все клеточные катализаторы –
белки (активные центры фермента).
► Двигательная – сократительные белки вызывают
всякое движение.
► Транспортная – белок крови гемоглобин присоединяет кислород и разносит его по всем тканям.
► Защитная – выработка белковых тел и антител для обезвреживания чужеродных веществ.
► Энергетическая – 1 г белка эквивалентен 17,6 кДж.
► Сигнальная – реакция на внешний раздражитель.
► Регуляторная - регулирует протекание физиологических процессов
► Токсическая-выделение белков- токсинов, которые являются ядами
Физические свойства белков
- Белки могут быть как растворимы, так и нерастворимы в воде в зависимости от их состава и структуры.

Физические свойства белков
- Водорастворимые белки образуют коллоидные растворы

Физические свойства белков
При обработке
хлоридом натрия
белки высаливаются
из раствора.
Этот процесс обратим.

Химические свойства белков
1. Гидролиз белков
Гидролиз белков сводится к расщеплению полипептидных связей и образованию аминокислот:

2. Денатурация белков
Денатурация – нарушение природной структуры белка под действием нагревания и химических реагентов.
а) высокая или низкая температура
б) механическое воздействие;
в) облучение;
г) яды;
д) действие спирта;
б) действие солей тяжелых металлов (Pb, Hg и др.)

Первичная структура белка при денатурации сохраняется. Денатурация может быть обратимой (так называемая, ренатурация) и необратимой. Пример необратимой денатурации при тепловом воздействии – свертывание яичного альбумина при варке яиц.
Денатурированный белок теряет свои биологические свойства.

Белок может восстановить первоначальное состояние при условии прекращения повреждающего фактора- ренатурация. Какая структура белка должна при этом сохраниться?

Формалин, спирты, щелочи вызывают при длительном воздействии процесс деструкции белка. Каковы последствия этого процесса?

3. Цветные реакции - качественные реакции на белки:
a) Биуретовая реакция – фиолетовое окрашивание при действии солей меди (II) в щелочном растворе. Такую реакцию дают все соединения, содержащие пептидную связь.

б) Ксантопротеиновая реакция – появление желтого окрашивания при действии концентрированной азотной кислоты на белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина).

- Проверка степени усвоения материала Ответьте на вопросы тестового задания (форма ответа: цифра-буква).
- 1. Какие вещества входят в состав белков? а) аминокислоты; б) спирты; в) эфиры; г) кислоты 2. Сколько аминокислот участвуют в образовании белков? а) 16; б) 20; в) 30; г) 10 3. Какие белки называются неполноценными? а) в которых отсутствуют некоторые аминокислоты; б) в которых отсутствуют некоторые незаменимые аминокислоты; в) в которых отсутствуют некоторые заменимые аминокислоты. 4. В результате какой реакции образуются белки? а) гидролиз; б) поликонденсация; в) гидратация; г) этерификация; По рисункам определите вид структуры белка (форма ответа: цифра – название структуры)