Интеллектуальная игра по химии "Теория электролитической диссоциации"
Игра проводится с целью углубления знаний учащихся по химии, активизации познавательной деятельности, развития умения выделять главное и находить ответы на поставленные вопросы, закрепления умения и навыков в решении экспериментальных задач.
Задачей данной игры является проведение в занимательной форме смотра знаний школьников, проверка их теоретических знаний и практических умений.
В интеллектуальной игре принимают участие учащиеся 9-х классов общеобразовательных и инновационных учреждений города. Оценивают игру девятиклассники той школы, где проводится игра.
Каждое учебное заведение готовит команду в составе 8 человек: капитан команды, знатоки теории, практики, способные красиво и правильно “химичить”, учащиеся, обладающие определенным даром: изобразительным, актерским.
Регистрация участников начинается за 30 минут до начала игры. Команды получают индивидуальные маршрутные листы, в которых указаны станции игры. Все станции работают одновременно. После открытия игры и приветствия участников, каждый член команды идет на свою станцию. Время прибытия на станции 40-60 минут. За выполнение каждого задания команды получают определенное количество баллов.
1. Станция “ВСЕЗНАЙКА” (капитанская)
Задание 1.
Прочитайте описание действия ученика и представьте эту информацию в виде молекулярных и ионных уравнений реакций:
“Выполняя практическую работу, ученик прилил к раствору карбоната калия раствор хлорида кальция, затем последовательно в ту же пробирку добавлял растворы соляной кислоты, нитрата серебра, сульфата железа(III) и гидроксида натрия. После этого он попытался понять, что же у него в пробирке. Какие вещества в конечном итоге оказались в пробирке?”
Задание 2.
В конце XIX века молодые ученые И.А.Каблуков и, независимо от него, В.А.Кистяковский пришли к выводу, что, очевидно, ионы движутся не одни, а увлекают с собой некоторое количество воды, и чем меньше радиус иона, тем больше количество воды ион может удержать вокруг себя, следовательно, он становится очень большим по диаметру.
Как называется явление, которое описали Каблуков и Кистяковский?
2. Станция “МАТЕМАТИЧЕСКАЯ ЭКСПЕРТИЗА”
Задание: Решите задачи.
Для подкормки комнатных растений применяют 0,2%-ный раствор натриевой селитры. Сколько нужно взять данного вещества (в кг) для приготовления 5 кг раствора?
Для соления огурцов применяют 5%-й раствор поваренной соли. Сколько соли и воды (по массе) надо взять для приготовления 50 кг этого раствора?
Для покрытия деталей слоем меди путем электролиза готовят раствор медного купороса – 60 г купороса растворяют в 1 л воды. Вычислите массовую долю вещества в растворе.
Физиологический раствор, применяемый в лечебной практике для внутреннего вливания, представляет собой 0,95%-й раствор хлорида натрия. Сколько необходимо соли и воды (по массе) для приготовления 1,5 кг этого раствора?
Для борьбы с заболеванием плодовых деревьев хлорозом используют 1%-й раствор железного купороса. Сколько нужно взять вещества для приготовления 50 кг 1%-го раствора?
При варке мыла на мыловаренном заводе используется раствор гидроксида натрия – 60 кг щелочи на 100 л воды. Какова массовая доля раствора?
3.Станция “НЕЗНАЙКИНЫ ВОПРОСЫ”
Тест.
1. Лампочка прибора для определения электропроводности загорится, если электроды поместить:
а) в воду;
б) в гидроксид меди (II);
в) в расплав хлорида калия;
г) в азот;
д) правильного ответа нет.
2. Какой вклад в химическую науку внес С.Аррениус?
а) сформулировал основные положения теории электролитической диссоциации;
б) выдвинул идею о гидратации ионов растворе;
в) экспериментально определил размер некоторых ионов в растворе;
г) объединил теорию растворов с представлениями об электролитической диссоциации;
д) правильного ответа нет.
3. Что называется гидратацией?
а) процесс растворения веществ в воде;
б) реакция обмена, в которой участвует вода;
в) процесс взаимодействия атомов или ионов с молекулами воды;
г) процесс распада воды на ионы;
д) правильного ответа нет.
4. Какие вещества называются электролитами?
а) вещества, проводящие электрический ток;
б) вещества, водные растворы или расплавы, которых проводят электрический ток;
в) вещества, имеющие атомную кристаллическую решетку;
г) вещества, реагирующие с водой;
д) правильного ответа нет.
5. Какой вклад сделал Д.И.Менделеев в науку о растворах?
а) сформулировал основные положения теории электролитической диссоциации;
б) открыл химическую сущность процесса растворения;
в) выдвинул идею о гидратации ионов в растворе;
г) объединил теорию растворов с представлениями об электролитической диссоциации;
д) правильного ответа нет.
6. Какие вещества называются кристаллогидратами?
а) твердые вещества, в состав которых входит химически связанная вода;
б) твердые вещества, растворимые в воде;
в) твердые вещества, реагирующие с водой;
г) твердые вещества. нерастворимые в воде;
д) правильного ответа нет.
7. Какие утверждения верны?
а) анионы движутся в растворе упорядоченно;
б) анион движется в растворе хаотично;
в) анионы заряжены отрицательно;
г) анионы заряжены положительно;
д) анионы не имеют заряда;
е) некоторые анионы окрашены;
ж) анионы всегда окрашены;
з) все анионы неядовитые;
и) некоторые анионы ядовиты.
8. При диссоциации, каких веществ образуются анионы только одного вида – гидроксид-ионы?
а) основные соли;
б) средние соли;
в) кислоты;
г) щелочи;
д) правильного ответа нет.
9. Какие ионы не могут находиться в растворе одновременно?
а) Н+ и ОН-;
б) Ва2+ и ОН-;
в) Н+ и NO3-;
г) Na+ и SO42-;
д) правильного ответа нет.
10. Что обозначает выражение: “Степень диссоциации кислоты равна 25%”?
а) 25% всех молекул кислоты не диссоциируют на ионы;
б) 25% всех молекул кислоты диссоциирует на ионы;
в) 25 всех частиц в растворе кислоты – молекулы;
г) 25% всех частиц в растворе кислоты – ионы;
д) правильного ответа нет.
11. При диссоциации какого вещества образуется больше всего видов ионов?
а) CaCl2;
б) HCl;
в) Al2(SO4)3;
г) H2CO3;
д) правильного ответа нет.
12. В каком из примеров уравнение диссоциации азотной кислоты записано верно?
а) HNO3 = H+ + NO3-;
б) HNO3 = H- + 3NO3+;
в) HNO3 = H- + NO+;
г) HNO3 = H+ + NO3-;
д) правильного ответа нет.
13. После добавления, какого вещества к воде в растворе можно обнаружить сульфат-ион?
а) Na2SO3;
б) BaSO4;
в) H2SO4;
г) H2S;
д) правильного ответа нет.
14. Растворы, каких веществ реагируют между собой с образованием осадка?
а) Fe(OH)3 и HCl;
б) Na2SO4 u HCl;
в) FeCl3 u AgNO3;
г) K2CO3 u HCl;
д) правильного ответа нет.
15. Сокращенное ионное уравнение Ba2+ + SO42- = BaSO4 соответствует реакции между:
соответствует реакции между:
а) раствором Ba(OH)2 и раствором H2SO4;
б) раствором Ba(NO3)2 и раствором H2SO4;
в) BaCO3 u раствором H2SO4;
г) BaO и раствором Na2SO4;
д) правильного ответа нет.
| Ответы. |
|
|
| 1. В | 6. А | 11. Г |
| 2. А | 7. Б, В, Е, И | 12. Г |
| 3. В | 8. Г | 13. В |
| 4. Б | 9. А | 14. В |
| 5. Б | 10. Б | 15. Б |
4. Станция “ЭКСПЕРИМЕНТАЛЬНАЯ”
Вариант 1.
Даны реактивы: растворы CuSO4, NaOH, BaCl2, H2SO4, FeCl3, Na2CO3.
Получите, используя выданные вам вещества:
1. Три осадка – голубой, белый и бурый (коричневый).
2. Газ без запаха.
Запишите уравнения реакций в молекулярном, полном и сокращенном ионном виде.
Вариант 2.
Даны реактивы: NaOH, фенолфталеин, H2SO4, BaCl2, CuSO4, HCl.
Экспериментальным путем осуществите следующие превращения, используя выданные вам реактивы:
а) раствор 
 раствор;
раствор;
б) бесцветный р-р  р-р малинового цвета
р-р малинового цвета  бесцветный р-р
бесцветный р-р  осадок белого цвета.
осадок белого цвета.
Запишите уравнения реакций в молекулярном, полном и сокращенном ионном виде.
Вариант 3.
Даны реактивы: NaOH, H2SO4, BaCl2, Na2CO3, фенолфталеин.
Экспериментальным путем осуществите следующие превращения, используя выданные вам реактивы:
а) бесцветный р-р  р-р малинового цвета
р-р малинового цвета 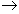 бесцветный р-р
бесцветный р-р 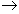 осадок белого цвета;
осадок белого цвета;
б) раствор 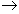
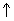
 .
.
Запишите уравнения реакций в молекулярном, полном и сокращенном ионном виде.
5. Станция “ХУДОЖЕСТВЕННАЯ”
Задание: Нарисовать рисунок на тему: “Растворы в нашей жизни”.
6. Станция “ТЕАТРАЛЬНАЯ”
Задание готовится дома.
Команда готовит приветствие, с которым выступают 3 участника. Приветствие должно отражать название команды, эмблему. Время выступления 2 минуты.
По окончании игры участники собираются в актовом зале для подведения итогов. Награждаются команды, занявшие три призовых места. Поощрительные призы получают учащиеся, показавшие лучшие результаты на каждой станции.

























