Муниципальное общеобразовательное учреждение средняя общеобразовательная школа с углублённым изучением предметов художественно-эстетического цикла №23
Исследовательская работа на тему:
«Водород – топливо будущего»
Работу выполнил:
ученик 8ф класса
МОУ СОШ №23
Сяськин Данила
Руководитель: учитель химии
Бакаева Татьяна Анатольевна
Комсомольск-на-Амуре 2019-2020г.
РЕЦЕНЗИЯ на исследовательскую работу
на тему: «Водород – топливо будущего»
Общая оценка исследовательской работы:
Данная тема в настоящее время актуальна, потому что экологически чистым называют водород – как вид топлива, так как продуктом горения водорода является вода, соответственно, водяной пар вместо углерода. Выдвинута проблема и гипотеза исследования, определена цель, задачи, методы исследования. Содержание проекта соответствует заявленной теме. Работа содержит введение, теоретическую и практическую части, список литературы, выводы, заключение.
В теоретической части работы были изучены: физические и химические свойства водорода, получение водорода в промышленности и лаборатории. Обосновано применение водорода – как экологически чистого вида топлива.
В практической части работы проведено исследование по получению водорода в лаборатории различными методами и проведен эксперимент по получению водорода в домашних условиях.
В работе поставленные задачи решены, цель достигнута, гипотеза работы подтвердилась экспериментально.
Вывод:
Стиль изложения работы научный, оформление исследовательской работы соответствует требованиям. Работа допускается к защите.
Рецензент Т.А. Бакаева, учитель химии
Содержание
Введение……………...……………………………………………………………3
I..Теоретическая часть.
1.1 Водород – как экологически чистый вид топлива ……………………..…..4
1.2 Физические свойства водорода………………………………………………6
1.3 Промышленное получение водорода как, экологически чистого топлива..9
1.4 Лабораторные методы получения водорода…………………….….……..13
II. Практическая часть.
2.1 Получение водорода реакцией щелочного металла с водой……………...14
2.2 Получение водорода реакцией взаимодействия активного металла с раствором сильной кислоты………………………………………………….....15
2.3.Домашний эксперимент «Получение водорода взаимодействием гвоздя с уксусной кислотой»……………………………….………………………...….16
3 Список литературы……………………………………………………...……..19
4 Приложение……………………………………………………………………21
Введение
Огромную роль в применении природных энергетических ресурсов играют транспортные средства, использующие приблизительно треть всей в мире нефти , причем из всех видов транспорта наиболее ресурс затратным является автомобильный. Применение в транспортных средствах углеводородных топлив нефтяного происхождения сопровождается выбросом в окружающую среду огромного количества вредных веществ. В результате на автомобильный транспорт приходится от 39 до 63% загрязнения окружающей среды, масштабы которой глобальны – воздух, суша и вода. Альтернативные приводы и источники энергии, не наносящие ущерба окружающей среде, называют надеждой завтрашнего дня. Топливные элементы считаются самым оптимальным решением энергетических проблем: из водорода и кислорода вырабатывается электрический ток, который используется для привода двигателя. В результате электрохимического процесса, кроме электрической энергии, образуются только тепло и водяной пар. Водородное топливо уже давно занимает ведущие позиции среди других источников энергии. Обладающий уникальными свойствами, водород по праву называют топливом ближайшего будущего.
По сравнению с дизельным и бензиновым топливом, у него больший КПД и экологичность вещества. Хотя водород обладает чудесными характеристиками, его почти не применяют на автотранспорте потому, что люди привыкли использовать бензин, хотя он и дорожает с каждым днем. [1]
Актуальность данной работы состоит в том, что при производстве водорода в промышленных масштабах и его массовом использовании снизит загрязнение окружающей среды.
Цель: представить водород как альтернативный вид топлива, как топливо будущего.
Гипотеза: Водород можно получить разными способами.
Цель: изучить получение водорода разными способами, получить водород в лабораторных условиях и
Задачи:
Изучить водород как экологически чистый вид топлива, его преимущества.
Изучить физические и моторные свойства водорода.
Изучить промышленное получение водорода как, экологически чистого топлива.
Исследовать способы получения водорода в лаборатории и провести опыты в условиях школьной лаборатории.
Объект исследования: водород.
Предмет исследования: способы получения водорода.
ОСНОВНАЯ ЧАСТЬ
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
1.1 Водород – как экологически чистый вид топлива
Водород как топливо имеет множество плюсов.
Водород при горении в среде чистого кислорода не выделяет никаких загрязняющих веществ.
Массовое производство и использование водорода может облегчить проблемы, связанные с меняющимися ценами и перерывами в поставках обычных видов топлива.
Рост производства водорода мог бы, как дополнительный выигрыш, стимулировать рост поставок водорода для отопления домов и офисов.
Во многих странах, включая США, уже существуют сети трубопроводов для метана. Некоторые из них можно было бы адаптировать для прокачки водорода и доставки его к заправочным станциям.
Водород можно получать как в малых масштабах на местных предприятиях, так и массово на крупных централизованных производствах. Это способствует повышению безопасности цивилизованного мира благодаря распределению энергетических ресурсов и благ в его пределах. Поэтому я считаю водород перспективным видом топлива.
Человечеству очень хотелось бы иметь идеально чистое топливо. Считают, что такое топливо найдено. Это — водород. Сегодня он выделяет больше тепла, чем любой вид традиционного ископаемого топлива, а продуктом горения, отходом становится окись водорода, говоря попросту, вода. Воображение подсказывает идеалистические картины: автомобиль, из выхлопной трубы которого разбрызгивается освежающая влага, ТЭС тоже выбрасывает в небо не окись углерода, а водяной пар. Фантастика? Нет. И хотя говорить о широком промышленном применении водорода еще рановато, но первые шаги по «приручению» этого топлива сделаны.
В США построен жилой корпус, где водороду определены бытовые функции: выработка электричества, отопление. Еще на VII Всемирной конференции по водородной энергетике, проходившей в Москве в 1986 году, большое впечатление произвел доклад А.А. Туполева, подкрепленный документальным кинофильмом. Один из трех двигателей Ту-155 работал на водороде! Весьма перспективно водородное горючее и для космических кораблей. При запуске американского многоразового транспортного космического корабля "Shuttle" частично использовалась энергия, полученная за счет сжигания водорода.
В СССР начали использовать водород в двигателях внутреннего сгорания еще во время Великой Отечественной войны. Было это в осажденном Ленинграде, где не хватало не только пищи, но и горючего для машин. Тогда-то и удалось заменить бензин водородом. В послевоенные годы этот первый опыт был забыт. В конце 80-х годов в Советском союзе создано несколько моделей водородных автомобилей, в том числе автобусы. А в одесском порту успешно применяются автопогрузчики на водороде.
Преимуществ у водородного топлива много. Его можно передавать на расстояние не по проводам, а по водородопроводам. Водород удобен как концентрат энергии, его можно хранить и извлекать из водородохранилищ по мере надобности. Но есть сомнения и проблемы с использованием, на первый взгляд экологически чистого водородного топлива. Ситуация примерно такая, как и для подавляющего числа так называемых экологически чистых производств.
Водород — вторичное сырье, его получение сопровождается определенным воздействием на окружающую среду. Кроме того, на этот процесс затрачивается энергия от других источников, отнюдь не столь чистых. То же относится и к другой технологической процедуре извлечения водорода — электролизу воды. И здесь без дополнительных затрат электроэнергии не обойтись. А автомобили на водородном горючем взрывоопасны. В связи с этим академик, В.А. Легасов говорил:
«Нельзя допустить, чтобы экологически чистый энергоноситель производился с загрязнением окружающей среды, нанося ущерб, принижающий экономический эффект от внедрения использующих водород технологий».
Таким образом, реальная действительность такова, что ни экологически, ни экономически водородный источник энергии не является более рентабельным, чем существующие традиционные источники энергии.
1.2 Физические свойства водорода
Водород – один из наиболее распространённых химических элементов на Земле. В земной коре из каждых 100 атомов 17 – атомы водорода. Он составляет примерно 0,88 % от массы земного шара (включая атмосферу, литосферу и гидросферу). Если вспомнить, что воды на земной поверхности более 1,5∙1018 м 3 и что массовая доля водорода в воде составляет 11,19 %, то становится ясно, что сырья для получения водорода на Земле – неограниченное количество. Водород входит в состав нефти (10,9 – 13,8 %), древесины (6 %), угля (бурый уголь – 5,5%), природного газа (25,13 %). Водород входит в состав всех животных и растительных организмов. Он содержится и в вулканических газах. Основная масса водорода попадает в атмосферу в результате биологических процессов. При разложении в анаэробных условиях миллиардов тонн растительных остатков в воздух выделяется значительное количество водорода. Этот водород в атмосфере быстро рассеивается и диффундирует в верхние слои атмосферы. Имея малую массу, молекулы водорода обладают высокой скоростью диффузионного движения (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут улететь в космическое пространство. Концентрация водорода в верхних слоях атмосферы составляет 1∙10-4 %. При нормальной температуре водород представляет собой бесцветный газ без запаха. Жидкий водород представляет собой бесцветную жидкость без запаха, отличающуюся высокой степенью криогенности. Водород сжижается при 20 К, а при 14 К переходит в твердое состояние, т. е. в жидкофазном состоянии он находится в узком диапазоне температуры – около 60. В этой области возможно образование промежуточной формы водорода – шугообразной, представляющей собой смесь жидкого водорода с твердым водородом в виде льда, плавающего в жидкости. Для образования шуги в жидком водороде требуется его небольшое – до 0,7 0С переохлаждение. В шугообразной форме плотность водорода повышается до 0,08-0,087 г/см 3 и становится максимальной при полном застывании. Водород обладает способностью проникновения через толщу материала, в частности металлов. Это отрицательное явление ведущее к ухудшению свойств материала, получило название наводороживание. С повышением давления и температура диффузия водорода в металлы возрастает. Глубина наводораживания, т.е. проникновения молекул водорода в кристаллическую решетку металла, в большинстве случаев не превышает 4-6 мм, а при нагортовке материала может быть снижена до 2-1,5 мм. Водородо – воздушные смеси характеризуются широкой областью воспламенения (4-75% по объему) и взрываемости (18,3-74% по объему), что повышает их пожаро- и взрывоопасность. В то же время водород отличается высокой температурой воспламенения (590 0С) и способностью к быстрому рассеиванию в воздушной среде, благодаря чему по суммарным показателям безопасности он примерно равноценен природному газу. При загрязнении технологическими примесями взрывоопасность водорода увеличивается. Поэтому основным условием безопасной работы с водородом в закрытых помещениях является контроль за его содержанием в воздухе и возможными утечками. [4,5]
Водород характеризуется более высокими энерго-массовыми показателями среди химических топлив. Меньшая теплота сгорания водорода (с образованием водяного пара) составляет 241,9 МДж/моль (57740 ккал/моль), что соответствует 120 МДж/кг ( 28640 ккал/кг). Таким образом, водород по массовой энергоемкости превосходит традиционные углеводородные топлива примерно в 2,5-3раз, спирты-в 5-6раз и аммиак-в 7 раз. Однако вследствие очень низкой плотности водорода его объемные энергетические характеристики невысоки даже в криогенной форме:
Таблица 1.
| Форма водорода | Газ (н.у.) | жидкий | шугообразный | твёрдый |
| Теплота сгорания | МДж/мі | 10,501 | 8373,8 | 9439,2 | 10501,1 |
|
| ккал/л | 2,506 | 1998,5 | 2252,8 | 2506,2 |
Среди горючих газов водород характеризуется наиболее низкой энергией воспламенения (примерно в 70 раз меньше, чем у метана) и высокой скоростью сгорания. Влияние добавок водорода на антидетонационную стойкость углеводородного топлива носит довольно сложный характер. Однако при дальнейшем повышении содержания водорода наблюдается тенденция к детонационному сгоранию, так что при концентрациях Н 2 свыше 60% детонация имеет место уже при е=6, а при содержании водорода от 90 до 95 диапазон детонации расширяется почти в 2 раза.
1.3.Промышленное получение водорода как, экологически чистого топлива.
Для промышленного получения водорода было предложено большое количество различных способов. Основные методы получения водорода в промышленности можно сгруппировать в следующие: а) химические методы; б) электрохимические методы; в) физические методы. К химическим методам относятся те процессы, в которых исходным веществом для получения водорода является химическое соединение (или ряд химических соединений) водорода с другими элементами, и откуда водород получается при помощи тех или иных химических реакций. Под электрохимическими следует понимать те методы, где выделение водорода из его химических соединений осуществляется разложением последних под действием электрического тока. К физическим методам следует причислять те процессы, в которых исходное сырьё (газовая смесь) уже содержит свободный водород и требуется тем или иным физическим путём (например, фракционной конденсацией) освободить его от остальных компонентов. Химическими методами водород в промышленности получается следующими путями. Из водяного пара восстановлением его железом (железо - паровой способ) или углеродом (газификация кокса, каменных и бурых углей и других видов твёрдого топлива на водяной газ). Из газообразных углеводородов термическим разложением или конверсией с окислителями (Н 2О, О 2, СО 2). Из жидких углеводородов термическим разложением или неполным окислением (газификацией) с применением в качестве окислителей Н 2О и О 2. Необходимо отметить, что при получении водорода из углеводородов с применением в качестве окислителя водяного пара последний является дополнительным источником водорода.
Конкретным сырьём для получения водорода из газообразных углеводородов при термическом разложении служат любые углеводородные газы, не содержащие кислородных соединений, или содержащие их в незначительном количестве, как природные, так и попутные газы, газы нефтепереработки и газы гидрирования. При конверсии газообразных углеводородов с водяным паром углекислотой или кислородом сырьём являются: а) природные и попутные газы; б) газы нефтепереработки, в) газы гидрирования; г) жидкие газы (пропан, бутан); д) коксовый газ; е) метановая фракция после выделения водорода из коксового газа методом глубокого охлаждения. При неполном окислении жидких углеводородов в качестве сырья применяются преимущественно нефтяные остатки.
Существует множество методов добычи водорода в промышленных масштабах. В промышленности водород часто получают в результате так называемой газопаровой конверсии угля, когда над раскаленным углем (коксом) пропускают водяной пар. При высокой температуре атомы водорода в воде замещаются на атомы углерода. В результате реакции образуется угарный газ и водород: C + H2O = CO + H2
Далее смесь полученных газов разделяют или используют без разделения. Смесь угарного газа с водородом называют синтез-газом. Также водород получают из газа метана: CH4 + H2O = CO + 3H2
Эта реакция также протекает при высокой температуре (около 1000 °C) и включает несколько стадий.
При высокой температуре водород может быть получен разложением метана. Продуктом реакции, помимо водорода, является сажа, которая также находит применение в промышленности: CH4 = C + 2H2
Преимущества водородных двигателей внутреннего сгорания
Главное неоспоримое преимущество автомобилей на водороде – это высокая экологичность, так как продуктом горения водорода является водяной пар. Конечно, при этом сгорают еще различные масла, но токсичных выбросов гораздо меньше, чем у бензиновых выхлопов.
Простая конструкция.
Отсутствие дорогостоящих систем топливоподачи, которые к тому же опасны и ненадежны.
Бесшумность.
КПД электродвигателя на водородном топливе намного выше, чем у ДВС.
Недостатки.
Имеются и недостатки у автомобилей на водородном топливе:
Дорогой и сложный способ получений топлива в промышленных объемах.
Отсутствие водородной инфраструктуры заправок автотранспорта.
Не разработаны стандарты транспортировки, хранения и применения топлива на водороде.
Несовершенство технологий хранения такого топлива.
Дорогие водородные элементы.
Большой вес транспорта. Работа электродвигателя на водородном топливе требуют водородные преобразователи тока и мощные аккумуляторные батареи, которые весят не мало, а также обладают внушительными габаритами.
Существует опасность возгорания и взрыва при работе водорода с традиционным топливом.
Ознакомившись с достоинствами и недостатками водородного топлива можно понять, почему до сих пор откладывается серийный выпуск водородных автомобилей. Однако из-за ухудшающейся экологии этот альтернативный источник энергии может оказаться единственным решением проблемы.
Мировые производители все же проводят испытание в этой сфере и даже выпускают автотранспорт на водородном топливе:
Toyota — модель Toyota Highlander FCHV;
Ford Motor Company проводит испытания с концептом Focus FCV;
Honda со своей моделью Honda FCX;
Hyundai выпускает Tucson FCEV;
Daimler AG отвечает за модель Mercedes-Benz A-Class;
General Motors. [3]
В чистом, несвязанном виде водород в природе практически не встречается. Он может выделяться в незначительных количествах при извержении вулкана или из скважин при добывании нефти (всего 1 % содержится в земной коре). Поэтому существуют искусственные методы получения водорода в промышленности.
В промышленности водород выделяют:
из метана;
из воды;
из гидридов.
В лабораторных условиях получают водород в результате реакции металла с кислотой. Кроме того, водород образуется при взаимодействии пара воды с металлами и неметаллами, а также при электролизе воды.
1.4.Лабораторные методы получения водорода
Калий и его аналоги располагаются в самом начале ряда напряжений. Взаимодействие калия с водой сопровождается самовоспламенением выделяющегося водорода, а взаимодействие рубидия и цезия — даже взрывом.
Литий с водой взаимодействует спокойно, для натрия наблюдается значительный тепловой эффект. У калия взаимодействие с водой сопровождается самовоспламенением водорода, рубидий и цезий реагируют с водой со взрывом, вытесняют водород из воды (льда) даже при —108 °С. Щелочные металлы взаимодействуют не только с водой, но и с другими водородсодержащими соединениями, например со спиртами
Основные способы получения водорода описаны в таблице.
Водород, полученный при взаимодействии кислот и металлами, содержащими примеси, получается загрязнённым, поэтому проводят процесс очистки. Для этого полученное водородное соединение пропускают через раствор перманганата или бихромата калия, а затем через раствор гидроксида калия и концентрированную серную кислоту. (Приложение №3)
II Практическая часть
2.1 Получение водорода реакцией щелочного металла с водой.
Техника безопасности. Ожоги от щелочей и других веществ. Ожог щелочами может произойти при неправильной демонстрации опыта, показывающего взаимодействие металлического натрия или калия с водой. Для этой цели обычно используют кристаллизатор с водой, в которую помещают кусочек щелочного металла. Во время этого эффектного опыта многие стараются приблизиться к лабораторному столу и после прекращения горения водорода стремятся заглянуть в кристаллизатор. А как раз в этот момент происходит завершающая стадия реакции, сопровождающаяся небольшим взрывом и разбрызгиванием образовавшейся горячей щелочи. Демонстрацию этого опыта можно производить по учебнику Кусочек металлического натрия или калия берут не больше пшеничного зерна и после удаления керосина фильтровальной бумагой, поместив на обрывок такой же бумаги
В ходе опыта нужно было подтвердить что при взаимодействии натрия, калия и лития с водой выделяется водород.
В школьной лаборатории мы взяли несколько образцов различных металлов таких как натрий, калий и литий. После физической отчистки металла от керосиновой пленки с помощью фильтровальной бумаги мы поочередно поместили образец в колбу с водой, после чего ее плотно закрыли, потому что водород легкий газ, а значит если закрыть колбу он будет скапливаться на верху. После растворения лития мы открыли колбу и поднесли к ней огонь. Так как водород – взрывоопасный газ, то произошел небольшой хлопок. Это значило что при взаимодействии натрия, калия и лития с водой выделяется водород. Такие же действия мы проделали с каждым образцом. (Приложение №1)
Уравнения реакции:
2Li + 2H2O = 2LiOH + H2
2Na + 2H2O = 2NaOH + H2
2K + 2H2O = 2KOH + H2
Вывод: В ходе опыта мы подтвердили что при взаимодействии натрия, калия и лития с водой выделяется водород.
2.2. Получение водорода реакцией взаимодействия активного металла с раствором сильной кислоты
В земных условиях водород встречается преимущественно в связанном состоянии. Многие его соединения нам уже известны: Н2О, HCl, HF и т.д. В этих соединениях водород имеет степень окисления +1, поскольку его электроотрицательность (2,2) меньше, чем электроотрицательность кислорода (3,44), хлора (3,16) и фтора (3,98).
Когда водород уже находится в степени окисления +1, он может отбирать электрон у многих элементов – особенно металлов, которые склонны отдавать электроны. Поэтому способы получения водорода часто основаны на реакции какого-либо металла с одним из соединений водорода, например:
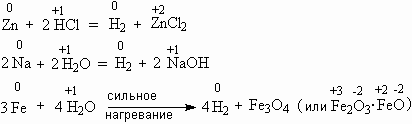
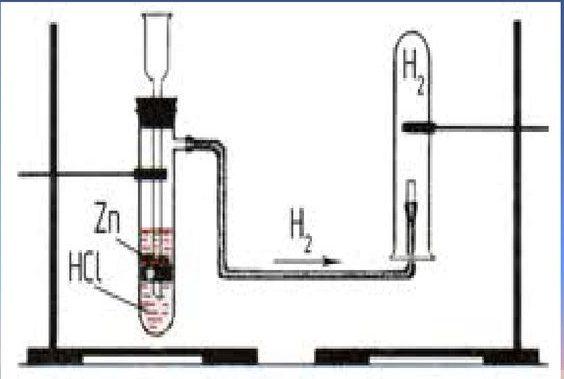
Реакцию между цинком и водным раствором хлористого водорода (соляной кислотой) наиболее часто используют для получения водорода в лаборатории.
2.3. Домашний эксперимент «Получение водорода взаимодействием гвоздя с уксусной кислотой»
В домашних условиях я провел эксперимент. Я взял уксусную кислоту, Гвозди из цинка и стеклянный стакан. После того как раствор уксусной кислоты был налит в стакан я погрузил в нее гвоздь, который при взаимодействии с уксусной кислотой выделяется водород. Так как водород легкий газ, а значит, если закрыть стакан он будет скапливаться на верху. Закрыв стакан и подождав определенное количество времени, я открыл стакан и поднес к нему огонь. Так как водород – взрывоопасный газ, то произошел небольшой хлопок.
2СН3СООН + Мg = H2 + ( CH3COO)2 Mg
2СН3СООН + Zn = H2 + ( CH3COO)2 Zn
Вывод: В ходе опыта подтвердил, что при взаимодействии цинка с раствором уксусной кислоты выделяется водород.
(Приложение №2)
Заключение
В ходе работы установили, что у нашего мира ещё есть возможность хоть как то наладить экологическую обстановку. В ходе работы видим из всех доказательств, приведённых в работе, что водород – это не просто элемент, водород – это чудо, и сейчас его не без оснований называют чудесным топливом будущего. Выделение энергии в ядерных реакциях в миллионы раз превышает энерговыделение при обычном горении. Ввиду быстрого истощения ресурсов естественных источников энергии на Земле (нефть, газ, уголь) актуальной является проблема овладения ядерной и водородной энергией.
Экологически чистым называют водород – как вид топлива, так как продуктом горения водорода является вода, соответственно, водяной пар вместо углерода, идущий из выхлопной трубы, кажется большинству людей привлекательным для экологии вариантом.
Реакцию между цинком и водным раствором хлористого водорода (соляной кислотой) наиболее часто используют для получения водорода в лаборатории. А реакция между железом и водяным паром при нагревании имеет историческое значение – когда-то её использовали для наполнения водородом воздушных шаров.
Реакцию между щелочными металлами и водой тоже используют для лабораторного получения водорода. Но лабораторные способы получения не пригодны для использования в промышленных масштабах.
Существует множество методов добычи водорода в промышленных масштабах. В промышленности водород часто получают в результате так называемой газопаровой конверсии угля, когда над раскаленным углем (коксом) пропускают водяной пар. При высокой температуре атомы водорода в воде замещаются на атомы углерода. Существует множество методов добычи водорода в промышленных масштабах. В промышленности водород часто получают в результате так называемой газопаровой конверсии угля, когда над раскаленным углем (коксом) пропускают водяной пар. При высокой температуре атомы водорода в воде замещаются на атомы углерода.
Таким образом, гипотеза работы была подтверждена, цель работы достигнута.
СПИСОК ЛИТЕРАТУРЫ
1.Вид топлива - реферат, курсовая работа, диплом....
.2.Водород как альтернативный вид топлива — текст работы revolution.allbest.ru›Производство›00019628_0.html
Химия. 9 класс : учеб. Для общеобразоват. Учреждений / О. С. Габриелян. – М.: Дрофа,2008.- 257,(5) с. : ил.
3.Водород как альтернативный вид топлива...xreferat.com›Производство›4212-1-vodorod-kak-al… 4.Водородное топливо для автотранспорта...referat.abc-english-grammar.com›ref.php…Диплом, курсовая, реферат - ...альтернативный вид топлива 5. Водородное топливо. | По типу работы webkursovik.ru›kartgotrab.asp?id=-103858 6.Водородное топливо для автотранспорта - Экология...KazEdu.kz›referat/69842 7. Водородное топливо как альтернативный вид...BestReferat.ru›referat-275791.html 8.Водород как альтернативный вид топлива - рефераты...2dip.ru›рефераты/743192/ 9. Работа двигателя на водородном топливе. text.tr200.biz›referat_transport/?referat=186922…1
10.esco.co.ua›journal/2006_6/art090-2.htm
Переход к водородному топливу - сердцевина глобальной энергетической революции XXI века.
11.kuzyk.ru›allbooks/get_book.php?id=590&bookId=467
Г. Бокль. ГЛАВА ГЛОБАЛЬНАЯ ЭНЕРГЕТИЧЕСКАЯ РЕВОЛЮЦИЯ
12.h2club.rdmk.ru›sources/Vodorod_Book.pdf
13.Экология. Промышленная утилизация. Переработка...
novellamultimedia.narod.ru›public/2010-garbage-89…
14.На пути к водородной энергетикеБиблиотека Нон-фикшн...
lib.biblioclub.ru›book…Na…k_vodorodnoi_energetike/
15.Яковец Ю.В. Россия: стратегия перехода к водородной...
studmed.ru›kuzyk…perehoda-k-vodorodnoy-energetike…
16.Переход к водородному топливу
mosvet.ru›page419-page4.html
17.На пути к водородной энергетике
otherreferats.allbest.ru›Физика›00256404_0.html
18.Б.Н., Кушлин В.И., Яковец Ю.В. На пути к водородной...
twirpx.com›file/298552/.
19.http://www.abitura.com/modern_physics/hydro_energy/hydro_energy3.html.
20.http://www.abitura.com/modern_physics/hydro_energy/hydro_energy2.html.
21.http://potential.org.ru/Phys/ArtDt200504231615PH4J4.
Приложение № 1
Реакция лития с водой
(
Литий в колбе с водой)
Приложение №2
Домашний эксперимент «Получение водорода взаимодействием гвоздя с уксусной кислотой»




Приложение №3
Лабораторные способы получения водорода
| Взаимодействие | Реакция получения | Побочные продукты |
| Натрия с водой | 2Na + 2H2O → 2NaOH + H2↑ | Гидроксид натрия |
| Гидрида кальция с водой | CaH2 + 2H2O → Ca(OH)2 + 2H2↑ | Гидроксид кальция |
| Гидрида натрия с водой | NaH + H2O → NaOH + H2↑ | Гидроксид натрия |
| Водяного пара с раскалённым железом | 4Н2О + 3Fe → Fe3O4 + 4H2↑ | Оксид железа (II, III) |
| Водяного пара с раскалённым коксом (газификация угля) | H2O + C → CO↑ + H2↑ | Угарный газ |
| Метана с водяным паром (разложение метана при 1000°C) | CH4 + H2O → CO↑ + 3H2↑ | Угарный газ |
| Фиолетового фосфора и водяного пара | 2Р + 8Н2О → 2Н3РО4 + 5Н2↑ | Фосфорная кислота |
| Цинка с разбавленной соляной кислоты | Zn + 2HCl → ZnCl2 + H2↑ | Соль хлорид цинка |
| Алюминия или кремния со щёлочью и водой | 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ Si + 2KOH + H2O → Na2SiO3 + 2H2↑ | Соль тетрагидроксоалюминат натрия или метасиликат натрия |
| Разложение метана при высокой температуре | CH4 → C + 2H2↑ | Сажа |
| Окисление метана | 2CH4 + O2 → 2CO + 4H2↑ | Угарный газ |
| Электролитический способ разложения воды (добавляют электролиты, например, КОН) | 2H2O → 2H2↑ + O2↑ | Кислород |
| Электролиз растворов солей | 2NaCl + 2H2O → 2NaOH + Cl2 + H2↑ | Гидроксид натрия и свободный хлор |























