Муниципальное общеобразовательное учреждение средняя общеобразовательная школа с углублённым изучением предметов художественно-эстетического цикла №23
Исследовательский проект
«Создание установки для электролиза»
Работу выполнил:
ученик 8ф класса
МОУ СОШ №23
Сяськин Никита
Руководитель: учитель химии
Бакаева Татьяна Анатольевна
Комсомольск-на-Амуре 2019-2020г.
РЕЦЕНЗИЯ на исследовательский проект
на тему: «Создание установки для электролиза»
Общая оценка исследовательской работы:
Данная тема в настоящее время актуальна, потому что изучение электролиза и дальнейшее использование является перспективным по причине экологической безопасности для природы и человека и возможностью выделения чистых металлов. Выдвинута гипотеза работы, определена цель, задачи проекта. Содержание проекта соответствует заявленной теме. Работа содержит введение, теоретическую и практическую части, список литературы, заключение и приложение.
В теоретической части работы была изучена история электролиза, рассмотрена классификация электролиза, дано определение электролиза – как окислительно-восстановительной реакции, применение электролиза для получения металлов.
В практической части работы создан чертеж модели установки для электролиза. Для подтверждения гипотезы планируется создать установку для электролиза по составленной модели, а также провести опыт «Выделение чистой медь из электролита с растворённой в нем меди».
В работе поставленные задачи решены, цель достигнута, гипотеза работы подтвердилась экспериментально.
Вывод:
Стиль изложения работы научный, оформление исследовательской работы соответствует требованиям. Работа допускается к защите.
Рецензент Т.А. Бакаева, учитель химии
Содержание
Введение…………………………………………………………………3
Теоритическая часть...……………………………….....…………………………………4
История электролиза………………...…………………………….……4
Определение электролиза..………………...………………………………...…………5
Применение электролиза для получения металлов…...........................9
Практическая часть.......………………………………....……………………………….11
2.1 Создание модели установки для электролиза (чертеж)……………11
Заключение.………………………………………………………………12
Список использованной литературы……………………………………13
Приложение………………………………………………………………14
Введение
В настоящее время электролизер можно купить в магазине медтехники. В интернете достаточно инструкций и видеороликов по самостоятельному изготовлению аналогичных устройств, а также рецептов применения активированной воды. Возможность изучить процесс электролиза, собрать устройство для электролиза растворов солей и щелочных металлов и исследовать свойства полученных растворов делает эффект электролиза интересным для изучения.
Актуальность. Изучение электролиза и дальнейшее использование является перспективным по причине экологической безопасности для природы и человека и возможностью выделения щелочных металлов.
Гипотеза - установку для электролиза можно сделать своими руками с помощью лаборатории Polytex
Цель: Создание установки для электролиза растворов солей.
Задачи:
Изучить историю появления электролиза, как окислительно-восстановительного процесса.
Изучить способы применения электролиза для получения металлов.
Создание установки для электролиза.
Теоретическая часть
1.1 История электролиза
Явление электролиза было открыто в самом начале XIX в. Первые систематические исследования тока в электролитах провел Фарадей в 1833—1834 гг.
В этот период Фарадей проводит пятую серию своих знаменитых экспериментальных исследований по электричеству, посвященную законам электролиза. Он устанавливает «чрезвычайно важный принцип... что количество воды, разложенной под влиянием электрического тока, в точности пропорционально количеству прошедшего электричества». И далее: «продукты разложения могут быть собраны с такой точностью, что дают превосходное и ценное средство для измерения электричества, участвующего в их. выделении».
Фарадей вводит первую электрическую единицу, «градус электричества», имеющую соответствующий эталонный прибор, который он называет вольта-электрометром.
Измеряя количество отложившихся на электродах веществ при электролизе, Фарадей приходит к следующему заключению: «что бы собой не представляло разлагаемое вещество: воду, растворы солей, кислоты, расплавленное тело и т. д.,— для одного и того же количества электричества сумма электрохимических действий есть величина постоянная». «Сумма электрохимических действий» определяется массой вещества, отложившейся на электроде.
В такой форме впервые появился первый закон электролиза. Фарадей не ограничился формулировкой закона. Его конечная цель — выяснение природы электрохимического разложения. Фарадей замечает, что электролиз возникает благодаря силам, которые по отношению к разлагаемому веществу являются внутренними, а не внешними.
Фарадей устанавливает, что электрохимические эквиваленты постоянны для каждого вещества, они пропорциональны химическим эквивалентам. Отсюда он приходит к фундаментальному обобщению: обычное химическое сродство является лишь простым следствием электрических притяжений различных по природе частиц материи.
Итак, носителем электрических сил являются не особые электрические жидкости, а частицы материи — атомы.
1.2 Определение электролиза как окислительно-восстановительного процесса
Электролиз –это физико-химический окислительно-восстановительный процесс, протекающий в растворах или расплавах электролитов под действием электрического тока, заключающийся в выделении на электродах составных частей растворённых веществ или других веществ - продуктов вторичных реакций на электродах.
процесс на катоде K(-): катион принимает электроны и восстанавливается
процесс на аноде A(+): анион отдает электроны и окисляется.
Рассмотрим процессы, протекающие при электролизе, на примере хлорида натрия. При сильном нагревании твердый хлорид натрия плавится. Полученный расплав содержит подвижные ионы натрия и хлора, освободившиеся из кристаллической решетки, и поэтому проводит электрический ток. Если в расплав опустить угольные электроды, присоединенные к источнику тока, ионы приобретают направленное движение: катионы Na+ движутся к отрицательно заряженному электроду – катоду, анионы Cl– – к положительно заряженному электроду – аноду.
На катоде ионы Na+ получают электроны и восстанавливаются до металла:
Na++e−→Na (восстановление),
а на аноде ионы Cl– отдают электроны и окисляются до свободного хлора:
2Cl––2e−→Cl2 (окисление).
Таким образом, в результате процесса электролиза расплав хлорида натрия разлагается на простые вещества:
K−:2Na++2e−→2Na
A+:2Cl−−2e−→Cl2
Суммарное уравнение электролиза: эл.ток2Na++2Cl−→эл.ток2Na+Cl2
Электролиз отличается от обычных окислительно-восстановительных реакций. При электролизе полуреакции разделены в пространстве: восстановление происходит только на катоде, а окисление – на противоположном электроде - аноде.
Окислительное и восстановительное действие электрического тока намного сильнее действия обычных химических веществ. Только с помощью тока ученым удалось получить наиболее активные простые вещества – натрий, калий и фтор. Пионером в использовании электрического тока в химии был английский ученый Гемфри Дэви. Подвергая электролизу расплавы различных соединений, он открыл восемь неизвестных до него химических элементов.
Электролиз растворов электролитов
В водных растворах процессы электролиза осложняются присутствием воды, которая проявляет двойственную природу: она может проявлять свойства и окислителя, и восстановителя. На катоде вода может принимать электроны, и тогда атомы водорода в ней будут восстанавливаются до газообразного водорода:
K−:2H2O+2e−→H2↑+2OH–.
На аноде вода может отдавать электроны, при этом атомы кислорода будут окисляться до газообразного кислорода:
A+:2H2O–4e−→O2+4H+.
Другими словами, при электролизе растворов электролитов (чаще всего солей) на катоде и аноде протекают конкурирующие процессы: катионы металла Me+n конкурируют с катионами водорода H+, а анионы кислотных остатков Ann− конкурируют с анионами гидроксильных групп (OH)−. Рассмотрим подробнее процессы, протекающие на электродах.
Закономерности процессов на катоде
На отрицательно заряженном электроде - катоде, происходит восстановление катионов, которое не зависит от материала катода, из которого он сделан, но зависит от активности металла, т.е. от положения металла в электрохимическом ряду напряжения (ЭХР). (Сравниваем окислительную способность, то есть способность принимать электроны, ионов металлов и иона водорода)
|  Li K Ca Na Mg Al Li K Ca Na Mg Al
| Mn Zn Fe Ni Sn Pb | Cu Hg Ag Pt Au |
| Me+ne¯≠ 2H2O+2e¯=H2+2OH− | Me+n+ne¯=Me0 2H2O+2e¯=H2+2OH− | Me+n+ne¯=Me0 |
| На катоде всегда восстанавливаются молекулы воды | На катоде могут восстанавливаться и ионы металла, и воды в зависимости от плотности тока, Т и концентрации соли | На катоде всегда восстанавливаются ионы металлов |
Если соль образована активным металлом, стоящим в ряду напряжения до марганца, на катоде не восстанавливаются катионы металла, а происходит восстановление воды с выделением газообразного водорода.
Если металл, образующий соль средней активности (после алюминия, но до водорода), то на катоде возможны два конкурирующих процесса: и восстановление воды, и восстановление катионов металла. Преобладание того или иного процесса зависит от плотности тока, температуры и концентрации соли.
Легче всего принимаю электроны неактивные металлы (стоящие в ЭХР после Н), поэтому они легко восстанавливаются на катоде до простого вещества - металла.
Закономерности процессов на аноде
Процесс на положительно заряженном электроде - аноде зависит от материала анода и от природы аниона. При электролизе растворов электролитов на аноде происходит окисление анионов. Образующийся продукт зависит от восстановительной активности аниона кислотного остатка.
Ряд восстановительной активности анионов (уменьшается). По способности окисляться анионы располагаются в следующем порядке:
J−Br−S2−Cl−OH−SO42−NO3−F−
Анод может быть растворимым и нерастворимым (инертным).
Кислотный остаток
бескислородный
Cl−,Br−,I−,S2−
кислородсодержащий
NO3−,SO42−,PO43−,F−
Преимущества электролиза перед химическим методами получения чистых веществ заключаются в возможности сравнительно просто (регулируя ток) управлять скоростью протекания реакций.
Условия электролиза легко контролировать, получать сильнейшие окислители и восстановители, используемые в науке и технике.
Электролиз — основной метод промышленного производства алюминия, хлора и едкого натра; важнейший способ получения фтора, щелочных и щелочноземельных металлов; эффективный метод рафинирования металлов.
Скорость протекания реакций при электролизе зависит:
1) от состава и концентрации электролита;
2) от материала электрода;
3) от силы тока при электролизе;
4) от температуры.
Скорость реакции определяется скоростью переноса электрических зарядов через единицу поверхности электрода в единицу времени. Мерой скорости служит плотность тока. Плотность тока j=I/S, где I-сила тока,S-площадь электрода.
1.3 Применение электролиза для получения металлов
Выделение меди с помощью электролиза
1. Медную пластинку очистить наждачной бумагой до блеска, погрузить на 3—4 мин в 15%-ный раствор азотной кислоты и после травления хорошо промыть водой под краном. В стакан-электролизер налить столько раствора для электролиза, чтобы пластинки были на /4 погружены в раствор.
2.Опустить электроды в раствор включить реостат на полное сопротивление. Замкнуть ключом электрическую цепь, отметить время начала опыта (включить секундомер) и уменьшить сопротивление так. чтобы напряжение было 1,2—1,4 вольта.
3.Отметить по амперметру силу тока. Точно через 15 мин разомкнуть цепь и промыть железную пластинку водой. Осажденная медь имеет вид плотного
Характеристика процесса осаждения. Условия полного выделения меди.
4. Наблюдаем выделение меди из раствора соли меди начинается при напряжении, равном приблизительно 1,4 е. В 49 указывалось, что это напряжение является разностью нормальных потенциалов меди (0,3 в) и кислорода (1,70 е) на гладкой платине. Для практически полного осаждения достаточно, если концентрация ионов меди, остающейся в растворе, не будет превышать 10 г-ион/л. В растворе с такой концентрацией ионов меди потенциал медного электрода приближенно равен Для электролитического рафинирования меди использован реверсивный режим электролиза с длительностью катодного периода 39 с и плотностью тока 320 А/м . Для анодного периода эти параметры составляют 1,0 с и 290 А/м соответственно. При катодном периоде выход по току для осаждения меди составляет в среднем 98 % растворение меди в анодные периоды проходит с выходом по току 101 %. Процесс проводят в электролизерах с общей катодной поверхностью 50 м при среднем рабочем напряжении 0,34 В на один электролизер.
В понятие структуры входит не только размер, но и форма кристаллов. Варьируя состав электролита и условия электролиза, можно влиять не только на размер кристалла, но также на его геометрическую и кристаллографическую форму. Характерным примером изменения геометрической формы в зависимости от условий электролиза является осаждение меди. При осаждении меди из растворов сульфатов и фтор боратов без добавок образуются осадки с колончатой структурой. Введение в электролит добавок желатины, фенолсульфоновой кислоты и многих других добавок приводит к образованию волокнистой структуры. Подобным способом можно выделять и другие металлы такие как алюминий.
Практическая часть
2.1 Создание модели установки для электролиза (чертеж)
Прибор для электролиза включает в себя 2 электрода подключенные к источнику питания проводами. В качестве источника питания мы используем обычную батарейку. Эти 2 электрода мы опускаем в жидкость – электролит через которую и будем пропускать электрический ток. Для эксперимента нам потребовалось 1 пластиковый стаканчик, источник питания, провода, электролит.
1-провода
2-электроды
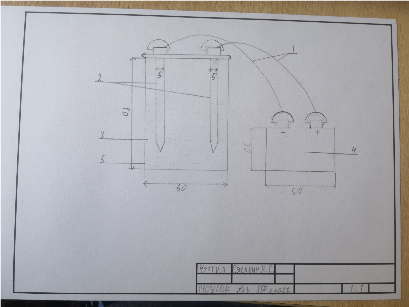
3-электролит
4-батарея
5-стаканчик
Заключение
В теоретической части работы были изучены: история появления электролиза, электролиз как окислительно-восстановительный процесс, способы применения электролиза для получения металлов. Преимущества электролиза перед химическим методами получения чистых веществ заключаются в возможности сравнительно просто (регулируя ток) управлять скоростью протекания реакций. Условия электролиза легко контролировать, получать сильнейшие окислители и восстановители, используемые в науке и технике.
Установили, что изучение электролиза и дальнейшее использование является перспективным по причине экологической безопасности для природы и человека и возможностью выделения щелочных металлов.
В практической части работы создан чертёж модели установки для электролиза растворов солей, в дальнейшем планируется создать установку, которую можно будет использовать в качестве школьного оборудования на уроках и других мероприятиях, для наглядного объяснения теории электролиза на уроке.
Все поставленные задачи проекта выполнены, цель достигнута. Гипотезу проекта, что создание установки для электролиза, возможно, своими руками с помощью специального набора Polytex планируется подтвердить экспериментально. Для подтверждения гипотезы планируется создать установку для электролиза по составленной модели, а также провести опыт «Выделение чистой медь из электролита с растворённой в нем меди».
СПИСОК ЛИТЕРАТУРЫ
http://tepka.ru/himiya_9/index.html
http://profil.mos.ru/kur/proekty/ustrojstvo-dlya-elektroliza-vody-izuchenie-i-primenenie.html
https://infourok.ru/issledovatelskiy-proekt-elektroliz-kak-metod-zaschiti-poverhnosti-metalla-ot-korrozii-3840647.html
https://foxford.ru/wiki/himiya/elektroliz-rastvorov-i-rasplavov
https://ru.wikipedia.org/wiki/Электролиз
http://electricalschool.info/main/electrotehnolog/664-jelektroliz.html
https://chem21.info/info/1485212/
https://cyberleninka.ru/article/n/izvlechenie-kationov-tyazhelyh-metallov-iz-kislyh-rastvorov-soderzhaschih-silnye-okisliteli
Приложение 1
Прибор для электролиза – МОДЕЛЬ УСТАНОВКИ

П
риложение 2
Сборка прибора для электролиза
П
риложение 3
Л
итий
Натрий
12







 Li K Ca Na Mg Al
Li K Ca Na Mg Al























