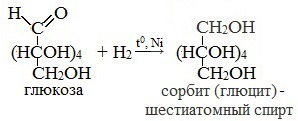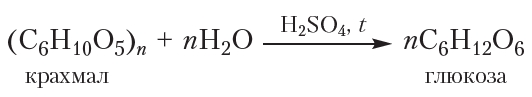Химические свойства глюкозы как альдегидоспирта. Качественные реакции крахмала.
Тема занятия: Химические свойства глюкозы как альдегидоспирта. Качественные реакции крахмала.
Цель занятия: знают химические свойства глюкозы и крахмала, проводят их качественные реакции.
https://youtu.be/mgXQdevOLl4
https://youtu.be/unFbNFpRLf8
Химические свойства глюкозы обусловлены присутствием в ее молекуле:
а) альдегидной группы -СОН; б) спиртовых гидроксилов -ОН.
Реакции с участием альдегидной группы глюкозы (свойства глюкозы как альдегида)
1. Восстановление (гидрирование) с образованием многоатомного спирта
В ходе этой реакции карбонильная группа восстанавливается и образуется новая спиртовая группа:
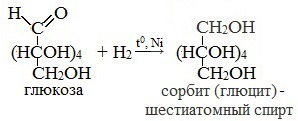
Cорбит содержится во многих ягодах, фруктах, особенно много сорбита в плодах рябины.
2. Окисление
Качественные реакции на глюкозу как альдегид!
Протекающие в щелочной среде при нагревании реакции с аммиачным раствором Ag2O (реакция серебряного зеркала») и с гидроксидом меди (II) Cu(OH)2 приводят к образованию смеси продуктов окисления глюкозы.
1) Реакция «серебряного зеркала»
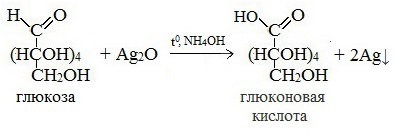
Соль этой кислоты – глюконат кальция – известное лекарственное средство.
2) Окисление гидроксидом меди (II)
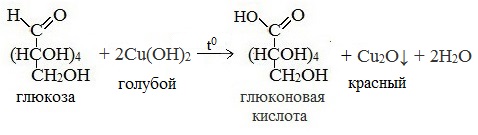
В ходе этих реакций альдегидная группа – СОН окисляется до карбоксильной группы – СООН.
Реакции глюкозы с участием гидроксильных групп (свойства глюкозы как многоатомного спирта)
Взаимодействие с Cu (ОН)2 с образованием глюконата меди (II)
Качественная реакция на глюкозу как многоатомный спирт!
Подобно этиленгликолю и глицерину, глюкоза способна растворять гидроксид меди (II), образуя растворимое комплексное соединение синего цвета:
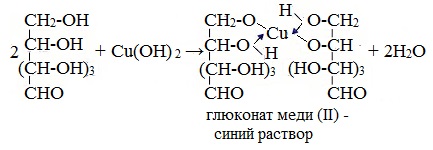
Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет.
В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение.
Химические свойства крахмала
В макромолекуле крахмала циклические формы глюкозы зафиксированы, поэтому крахмал не проявляет свойства, характерные для альдегидов. Крахмал не даёт реакцию «серебряного зеркала» и не образует красный осадок оксида меди(I) при нагревании с гидроксидом меди(II).
В то же время крахмал проявляет некоторые химические свойства, присущие сахарозе. Мы уже знаем, что, в отличие от моносахаридов, дисахарид сахароза подвергается гидролизу. При этом происходит расщепление молекулы сахарозы, и образуются две молекулы моносахаридов: глюкозы и фруктозы.
Будучи полисахаридом, крахмал также подвергается гидролизу. Если нагреть крахмальный клейстер с несколькими каплями серной кислоты, то происходит постепенное расщепление макромолекул крахмала. При этом сначала образуются продукты частичного расщепления макромолекул, имеющие молекулярную массу меньше, чем у крахмала, — декстрины. При дальнейшем расщеплении молекул может образоваться дисахарид мальтоза. Конечным продуктом гидролиза крахмала является глюкоза. 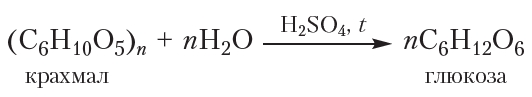
Одно из свойств крахмала – это способность давать синюю окраску при взаимодействии с йодом. Эту окраску легко наблюдать, если поместить каплю раствора йода на срез картофеля или ломтик белого хлеба. Крахмал в качестве резервного питания накапливается в клубнях, плодах, семенах растений. Так, в клубнях картофеля содержится до 24 % крахмала, в зёрнах пшеницы — до 64 %, риса — 75 %, кукурузы — 70 %.
С помощью йода можно открыть самые незначительные количества крахмала.
йод + крахмал = соединение темно-синего цвета
I2 + (C6H10O5)n = I2*(C6H10O5)n
(желт.) (прозр.) (синий)
https://drive.google.com/file/d/1YuKCSjkiZjLBciJKWOO7BKL2isc2-ML7/view?usp=sharing
https://drive.google.com/file/d/1p6J2u8LE1g0YZ1QGEMfi9Myj4B1LLXaU/view?usp=sharing
Задание.
Выполните практическую работу «Качественные реакции глюкозы и крахмала»
по видеоинструкциям и заполните таблицу. Видеоинструкции:
-
https://youtu.be/ougjhcqBjMU
-
https://youtu.be/746oItQzF-w
-
https://youtu.be/uhwHO2GRwUo
| Название опыта | Действия (что делали) | Наблюдения | Выводы, уравнения реакций |
| 1.Качественная реакция глюкозы с гидроксидом меди (II)
| а)
| | |
| б) |
|
|
| 2.Окисление глюкозы аммиачным раствором оксида серебра (I) |
|
|
|
| 3.Реакция крахмала с йодом |
|
|
|
Литература. М.К.Оспанова, Химия, 11кл., 1ч., Мектеп, 2020г., пар.19,21, стр.115
https://drive.google.com/file/d/1ZKlJpjS-KVMLLHGor-hiwfWNQfCxyFqr/view?usp=sharing