| Тема | Химические свойства кислот. Реакции обмена. |
| Цель | Объяснить химические свойства кислот, применение индикаторов; ознакомить учащихся с рядом напряжений металлов, его применением при составлении химических уравнений реакций; определить суть реакции обмена. |
| Оборудование и материалы | Растворы соляной и серной кислот, цинк, медь, вода, оксид меди, растворы гидроксида натрия и нитрата серебра, индикаторная бумага или раствор лакмуса, метилоранжа, фенолфталеина H2SO4 (конц.), термометр, лист бумаги, нагревательное оборудование, штативы с пробирками или химические стаканы, периодическая таблица химических элементов, ряд напряжений металлов. |
| Базовое понятие и термины | Кислоты, оксиды, основания, соли, реакция обмена и замещения, индикаторы. |
| Тип урока | Комбинированный |
Структура урока
Организационный этап…………….…………………………...1-2 мин
Актуализация опорных заданий……………………………....7-8 мин
Изучение нового материала……….……………………………25-29 мин
Действие кислот на индикаторы.
Взаимодействие кислот с металлами.
Взаимодействие кислот с основными оксидами. Реакции обмена.
Взаимодействие кислот с основаниями.
Взаимодействие кислот с солями.
Правила работы с кислотами.
Домашнее задание………………………………………………1-2 мин
Подведение итогов урока………………………………………2-3 мин
Рекомендации по проведению урока
По программе на изучение темы «Химические свойства кислот» отводится 2 урока. Учебный материал можно распределить по-разному, в зависимости от подготовки класса и желания учителя. Можно распределить объяснение нового материала на два урока, закрепляя каждое химическое свойство. В данных методических разработках предлагается изучить химические свойства кислот за один урок, а второй урок посвятить закреплению материала. В этом случае учащиеся будут иметь возможность поработать над изученным материалом дома.
ХОД УРОКА
ОРГАНИЗАЦИОННЫЙ ЭТАП
АКТУАЛИЗАЦИЯ ОПОРНЫХ ЗАДАНИЙ
Беседа.
Какие вещества называются кислотами?
Напишите формулы и назовите бескислородные кислоты.
Напишите формулы и назовите кислородосодержащие кислоты.
Какую еще классификацию кислот вы знаете? Ответ подтвердите примерами.
Напишите формулы кислот: серной, соляной, азотной, ортофосфорной. Определите основность каждой кислоты.
При взаимодействии каких веществ получают растворимые кислоты? Напишите два уравнения получения кислот. К какому типу относятся эти реакции?
Какие физические свойства проявляют кислоты?
Расскажите о правилах безопасности при работе с кислотами.
Коллективное обсуждение.
Учитель предлагает учащимся вспомнить химические свойства воды. Формулу воды можно представить как НОН, где на первом месте, как и в формулах кислот, стоит символ водорода. Химические свойства кислот обусловлены в основном наличием этого атом (или атомов).
Обсуждается вопрос: будут ли свойства воды сходны со свойствами кислот на основании их строения?
ИЗУЧЕНИЕ НОВОГО МАТЕРИАЛА
1. ДЕЙСТВИЕ КИСЛОТ НА ИНДИКАТОРЫ.
Лабораторная работа.
Действие воды и раствора кислоты на индикаторы.
В химически стаканы (или пробирки) с водой и раствором кислоты добавляется по несколько капель различных индикаторов (лакмуса, фенолфталеина, метилового оранжевого). Сравнивается окраска. Аналогично проводится опыт с индикаторной бумагой. Результаты исследований оформляются в виде таблицы.
| Индикатор | Окраска |
| В воде | В растворе кислоты |
| Фиолетовый лакмус | Фиолетовая | Красная |
| Метиловый оранжевый | Оранжевая | Красная |
| Фенолфталеин | Бесцветный | Бесцветный |
| Универсальная индикаторная бумага | Белая или желтая | Красная |
Учащиеся делают вывод, что индикаторами, при помощи которых можно определить кислоты, являются фиолетовый лакмус, метиловый оранжевый. Лакмусовая бумага. Фенолфталеин не позволяет определить кислоты.
2. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С МЕТАЛЛАМИ.
Рассказ учителя.
Кислоты, как и вода, реагируют с металлами, причем металлы также вытесняют водород:
2HCl + Fe FeCl2 + H2.
Демонстрация.
Демонстрируется взаимодействие кислот с металлами. Рекомендуется взять различные металлы (реагирующие и не реагирующие с кислотами). Например:
Zn + 2HCl ZnCl2 + H2;
Zn + H2SO4 ZnSO4 + H2;
Cu + H2SO4.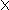
Рассказ учителя.
В строении воды и кислот есть различия – у кислот есть кислотный остаток, в состав которого входят неметаллы. Атом водорода оказывается более подвижным и легче замещается. Поэтому, в отличие от воды, кислоты взаимодействуют с металлами значительно активнее, и в реакции, крме водорода, образуются соли. Металлы, стоящие в ряду напряжений до водорода, вытесняют водород из разбавленных кислот (кроме азотной кислоты).
Учитель знакомит учащихся с рядом напряжений металлов и предлагает металлы для составления уравнений взаимодействия с кислотами. Следует предложить 2-3 металла, с которыми взаимодействия кислот невозможно. Например:
Mg + 2HCl MgCl2 + H2; 2Al + 6HCl 2AlCl3 + 3H2;
Ag + HCl ; Zn + H2SO4 ZnSO4 + H2;![]()
Au + H2SO4 ;![]()
3. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С ОСНОВНЫМИ ОКСИДАМИ. РЕАКЦИИ ОБМЕНА.
Демонстрация.
Демонтсрируется взаимодействие основных оксидов с кислотами.
Наиболее зрелищно взаимодействие оксида меди (II) с кислотами. В пробирку или химический стакан помещается CuO, добавляется раствор H2SO4. Стакан осторожно нагревается. Очевидное растворение черного осадка оксида меди и получение окрашенного раствора ее соли позволяют лучше запомнить эту реакцию.
Учитель записывает уравнение реакции, показывая стрелками обмен атомов в реагирующих веществах:
![]()
CuO + 2HCl CuCl2 + H2O.![]()
Учитель называет тип реакции – реакция обмена.
Работа с учебником.
Учащие знакомятся с определением реакций обмена.
Задания.
Написать несколько реакций обмена, например:
CaO + HCl …; MgO + HCl …;
FeO + H2SO4 …; Na2O + H2SO4 … .
4. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С ОСНОВАНИЯМИ.
Рассказ учителя.
Взаимодействие кислот с основаниями называется реакцией нейтрализации.
Записывается уравнение реакции, например:
NaOH + HCl = NaCl + H2O.
Анализируя уравнение реакции, учитель подчеркивает, что гидроксогруппа оснований –ОН, обеспечивающая щелочную среду, и атом водорода кислот, обеспечивающий кислую среду, образуют нейтральную воду. Отсюда и название реакции – реакция нейтрализации.
Демонстрация.
Демонстрируется взаимодействия кислот с основаниями.
Учитель показывает растворы кислоты и основания, они бесцветны, обращает внимание учащихся, что получаемые вещества – поваренная соль NaCl и вода – также не имеет окраски, т.е. в ходе реакции не будет видимых изменений. Для наблюдения хода реакции можно подкрасить какой-либо из исходных растворов индикатором. Наиболее удобно в этом случае использовать фенолфталеин, несколько капель которого добавляют в раствор щелочи. При добавлении кислоты к малиновому раствору щелочи окраска исчезает. Это свидетельствует о том, что все группы –ОН вступили в химическую реакцию и вошли в состав воды.
Задание.
К какому типу относится реакция взаимодействия кислоты и основания?
Записать 1-2 реакции нейтрализации, например^
2KOH + H2SO4 K2SO4 + H2O;
Cu(OH)2 + 2HCl CuCl2 + H2O.
5. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С СОЛЯМИ.
Демонстрация.
Демонстрируется взаимодействия соляной кислоты с раствором нитрата серебра. Вначале следует записать уравнение реакции и выяснить, что хлорид серебра выпадает в осадок, затем провести демонстрацию:
HCl + AgNO3 AgCl + HNO3.
6. ПРАВИЛА РАБОТЫ С КИСЛОТАМИ.
Рассказ учителя.
Работа с кислотами требует большой осторожности. При разбавлении кислот необходимо вливать небольшими порциями, помешивая, кислоту в воду, но не наоборот. Это легко объяснить. При растворении кислот выделяется большое количество теплоты. Вода более теплоемка, чем кислота, поэтому если понемногу вливать кислоту в воду, то вся выделяющаяся теплота успевает поглотиться водой, если же вливать наоборот, то выделяющаяся теплота не успевает поглотиться кислотой, а идет на разогрев добавляемой воды. Вода вскипает и выплескивается наружу вместе с капельками кислоты. Это может привести к серьезному ожогу.
Демонстрация.
1) Разбавление серной кислоты водой.
В стакан наливают немного воды. Измеряют ее температуру. Затем понемногу приливают серную кислоту, помешивая стеклянной палочкой. Еще раз измеряют температуру.
2) Разрушение бумаги серной кислотой.
Раствором серной кислоты при помощи стеклянной палочки что-либо пишут или рисуют на бумаге. Лист бумаги осторожно прогревают над нагревательным оборудованием. Постепенно бумага разрушается и надпись или рисунок становятся видны.
Рассказ учителя.
Учитель акцентирует внимание учащихся на правилах техники безопасности при работе с кислотами: при попадании кислоты на кожу следует немедленно смыть ее проточной водой до исчезновения чувства жжения, затем промыть раствор питьевой соды и обратиться в медпункт. При попадании кислоты в глаза необходимо промыть их водой и немедленно обратиться к врачу. Работать с кислотами нужно в халате.
ДОМАШНЕЕ ЗАДАНИЕ
Подготовить краткие сообщения (2-3 мин) про химические свойства кислот.
ПОДВЕДЕНИЕ ИТОГОВ УРОКА