
Химия d-, f-элементов
переходные элементы

Элементы IIIB группы
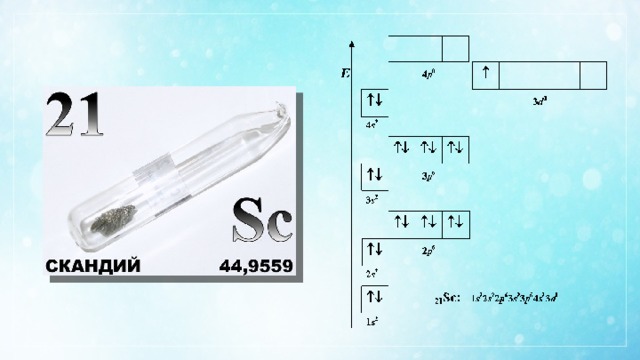
4s 2 3d 1
21 Sc ─ скандий
5s 2 4d 1
39 Y ─ иттрий
57 La ─ лантан
6s 2 5d 1
7s 2 5f 14 6d 1
89 Ac ─ актиний
Характерные степени окисления: +2, +3.
Актиноиды – редкие элементы

Элементы IVB группы
4s 2 3d 2
22 Ti ─ титан
5s 2 4d 2
40 Zr ─ цирконий
6s 2 4f 14 5d 2
72 Hf ─ гафний
Характерные степени окисления: +2, +3, +4.

Элементы VB группы
4s 2 3d 3
23 V ─ ванадий
5s 2 4d 3
41 Nb ─ ниобий
6s 2 4f 14 5d 3
73 Ta ─ тантал
Характерные степени окисления: +2, +3, +4, +5.

Элементы VIB группы
4s 1 3d 5
24 Cr ─ хром
«Проскок», или «провал» электрона
5s 1 4d 5
42 Mo ─ молибден
6s 2 4f 14 5d 4
74 W ─ вольфрам
Характерные степени окисления: +2, +3, +6.

Элементы VIIB группы
4s 2 3d 5
25 Mn ─ марганец
5s 2 4d 5
43 Tc ─ технеций
Редкие
элементы
6s 2 4f 14 5d 5
75 Re ─ рений
Характерные степени окисления: +2, +3, +4, +6, +7.

Элементы VIIIB группы
4s 2 3d 6
25 Fe ─ железо
Триада железа
4s 2 3d 7
43 Co ─ кобальт
4s 2 3d 8
75 Ni ─ никель
Характерные степени окисления: +2, +3, +4, +6, +8.

Элементы VIIIB группы
+3
+2
Co
Ni
Fe
+3
4s 2 3d 7
4s 2 3d 8
4s 2 3d 6
+4
+6
Rh
Pd
+2
Ru
5s 2 4d 8
5s 2 4d 7
5s 2 4d 6
Платиновые
металлы
Pt
+6
+4
Ir
+8
Os
6s 2 4f 14 5d 8
6s 2 4f 14 5d 6
6s 2 4f 14 5d 7

Элементы IB группы
4s 2 3d 9
29 Cu ─ медь
5s 2 4d 9
47 Ag ─ серебро
6s 2 4f 14 5d 9
79 Au ─ золото
Характерные степени окисления: +1, +2, +3.

Элементы IIB группы
4s 2 3d 10
30 Zn ─ цинк
5s 2 4d 10
48 Cd ─ кадмий
6s 2 4f 14 5d 10
80 Hg ─ ртуть
Характерные степени окисления: +1, +2.

Нахождение металлов в земной коре
Среди d-элементов наиболее распространённым является железо , которое занимает 4-ое место после кислорода, кремния и алюминия.

Гематит, или
кровавник
Fe
Fe
Магнетит, или
Лимонит
магнитный
железняк
Fe

Пирит
Fe
Fe
Пирротин
Сидерит
Fe

Титан очень распространён. Известно около 70 минералов титана.
Рутил
Ti
Ti
Ильменит, или
Анатаз
титанистый железняк
Ti

Содержание марганца в земной коре составляет 0,1% по массе.
Марганцевая обманка
Mn
Mn
Пиролюзит
Родохрозит, или малиновый шпат
Mn

Цинковая обманка, или сфалерит
Cu
Cr
Хромистый железняк, хромит
Самородная медь
Zn

Халькозин, или медный блеск
Co
Cu
Медный колчедан
Каролит
Cu

Кобальтин
Co
Co
Линнеит
Кобальтин
Co

У молибдена известно около 20 минералов.
Молибденит
Mo
Mo
Молибденит
Повеллит
Mo

Вольфрамовые минералы вкраплены в гранитные породы. Содержание вольфрама там 1 - 2%.
W
W
Вольфрамит
Вольфрамит
Вольфрамит
W

Элементы, которые не способны концентрироваться в земной коре и которые не образуют собственных минералов, называются рассеянными.
Cd
Hf
Рений
Гафний
Кадмий
Re

Ртуть встречается в природе в сульфидных минералах.
Hg
Hg
Каломель
Киноварь
Метациннабарит
Hg

Серебро и золото встречается в самородном состоянии.
Сплав золота и серебра
Au
Cu
Золото
Серебро
Ag

Платина, иридий и палладий встречаются в самородном состоянии и в виде интерметаллидов.
Pt
Pd
Иридий
Платина
Палладий
Ir

Технеций является редким элементом и встречается в урановых рудах.
Технеций
Урановая руда
Урановая руда
Tc
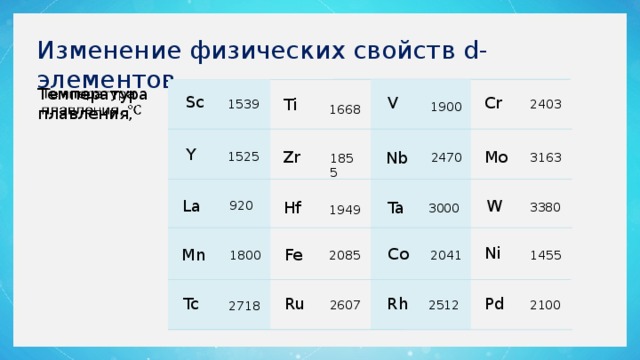
Изменение физических свойств d-элементов
Температура плавления,
Sc
Cr
V
Ti
1539
2403
1900
1668
Y
Mo
Zr
Nb
1525
3163
2470
1855
W
La
Hf
920
Ta
3380
3000
1949
Ni
Co
Mn
Fe
1455
2085
1800
2041
Pd
Rh
Tc
Ru
2512
2607
2100
2718

Изменение физических свойств d-элементов
Плотность, г/см 3
V
Ti
Sc
5,96
3,0
4,5
Zr
Nb
Y
8,57
6,5
4,47
La
Hf
Ta
6,16
13,2
16,6
Pt – 21,4
Os – 22,59
W – 19,1
Au – 19,3

- В образовании химической связи могут участвовать электроны s, p, d-орбиталей .
- Все d-элементы являются металлами .
- Все d-элементы проявляют переменные степени окисления .
- Устойчивость соединений d-элементов в высшей степени окисления возрастает вниз по группе.
- Для d–элементов характерен более широкий набор степеней окисления их атомов в соединениях.

Характерные степени окисления
Sc: +3.
Fe: +2, +3, +6.
Ti: +3, +4.
Co: +2, +3.
Ni: +2, +3.
V: +2, +3, +4, +5.
Cr: +2, +3, +6.
Cu: +1, +2.
Zn: +2.
Mn: +2, +3, +4, +6, +7.

Кислотно-основные свойства соединений d-элементов
У d-элементов идёт заполнение предвнешних орбиталей.
Cr (+2) – основные свойства;
Cr (+3) – амфотерные свойства;
Элементы-близнецы:
Zr ─ Hf,
Лантаноиды и актиноиды.
Nb ─ Ta,
Cr (+6) – кислотные свойства.
Mo ─ W.

- К d-элементам относятся 32 элемента периодической системы IV–VII больших периодов.
- В IIIВ-группе у атомов появляется первый электрон на d-орбитали , в последующих В-группах d-подуровень заполняется до 10 электронов .
- С увеличением порядкового номера свойства d-элементов изменяются незначительно .
- У d-элементов медленно происходит возрастание атомного радиуса , также они имеют переменную валентность , связанную с незавершенностью предвнешнего d-электронного подуровня.
- В низших степенях окисления d-элементы обнаруживают металлические свойства , при увеличении порядкового номера в группах В они уменьшаются.

- В растворах d-элементы с высшей степенью окисления обнаруживают кислотные и окислительные свойства , при низших степенях окисления – наоборот.
- Элементы с промежуточной степенью окисления проявляют амфотерные свойства .
- У химических элементов В-групп валентными являются электроны как внешнего , так и предвнешнего и даже третьего снаружи энергетических уровней.
- Увеличение заряда ядра на единицу приводит к добавлению одного электрона на предвнешний или третий снаружи уровень .





























































