
Он без запаха, без цвета,
С углеродом даст он дым,
Им окутана планета –
Без него не быть живым.
Для дыхания он нужен,
В нем сгорают вещества.
В океане он и в луже,
Там, где зелень и листва.
Кто сейчас его узнает?
И при всех здесь назовет?
Тот, конечно, точно знает
Газ известный………………

Кислород, его общая характеристика, физические и химические свойства.нахождение в природе и получение.


Общая характеристика элемента КИСЛОРОД
Химический знак О
Латинское название оксигениум
Относительная атомная масса
Аr(O)=16
Валентность II
2 период, VI А группа
порядковый номер №8
Положение в ПС –
Соединения элементов с кислородом– Оксиды

02/26/2023
.
Простое вещество
O 2
Химическая формула –
Модель молекулы:
32
M r (O 2 ) =
Строение:
молекулярное

Нахождение в природе.
Кислород - самый распространенный химический элемент в земной коре.

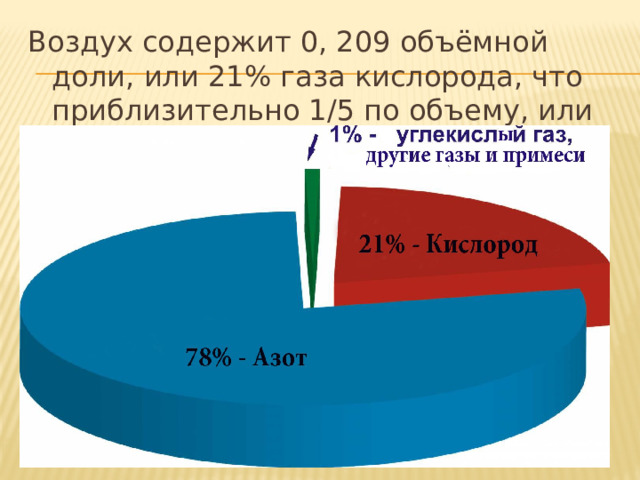
Воздух содержит 0, 209 объёмной доли, или 21% газа кислорода, что приблизительно 1/5 по объему, или 23% по массе.
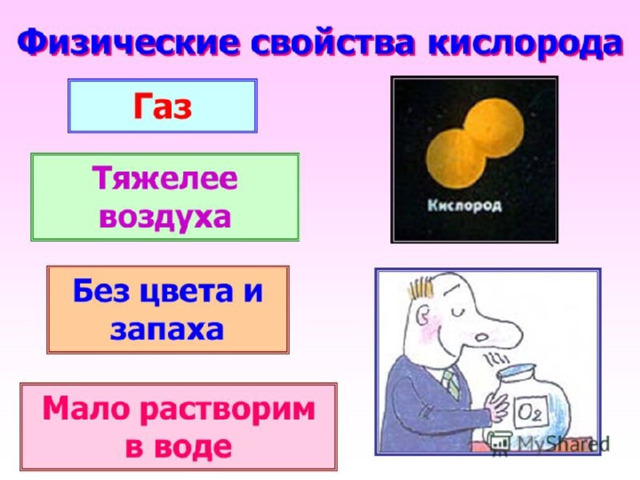
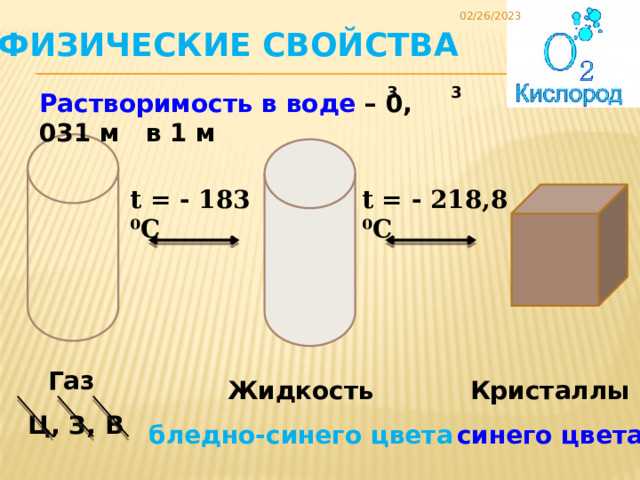
Физические свойства
02/26/2023
3
3
Растворимость в воде – 0, 031 м в 1 м
t = - 183 ⁰C
t = - 218,8 ⁰C
Газ
Ц, З, В
Кристаллы
Жидкость
синего цвета
бледно-синего цвета

Открытие кислорода
Первым этот газ получил шведский химик Карл Вильгельм Шееле в 1772 году.

Открытие кислорода
А через два года, в 1774, не зная об опытах предшественника, - английский химик Джозеф Пристли.

Вот история простая:
Джозеф Пристли как-то раз,
Окись ртути нагревая,
Обнаружил странный газ.
Газ без цвета, без названья,
Ярче в нем горит свеча.
А не вреден для дыханья?
Не узнаешь от врача.
Новый газ из колбы вышел.
Никому он не знаком.
Этим газом дышат мыши
Под стеклянным колпаком,
Человек им тоже дышит...
Джозеф Пристли быстро пишет:
Кошка греется на крыше,
Солнца луч в окошко бьет,
Джозеф Пристли, с ним две мыши,
Открывает кислород.


2HgO = 2Hg + O₂
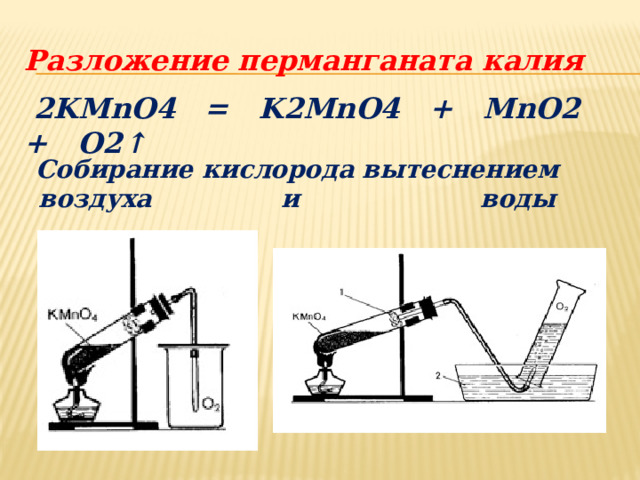
Разложение перманганата калия
2KMnO4 = K2MnO4 + MnO2 + O2 ↑
Собирание кислорода вытеснением воздуха и воды
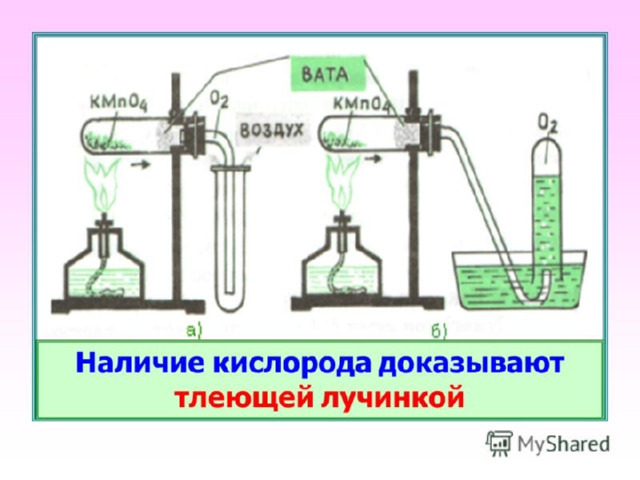

Получение кислорода в лаборатории
Разложение пероксида водорода
MnO2
2H 2 O 2 2H 2 O + O 2 ↑
Разложение бертолетовой соли
MnO2, t
2KClO 3 2KCl + 3O 2 ↑
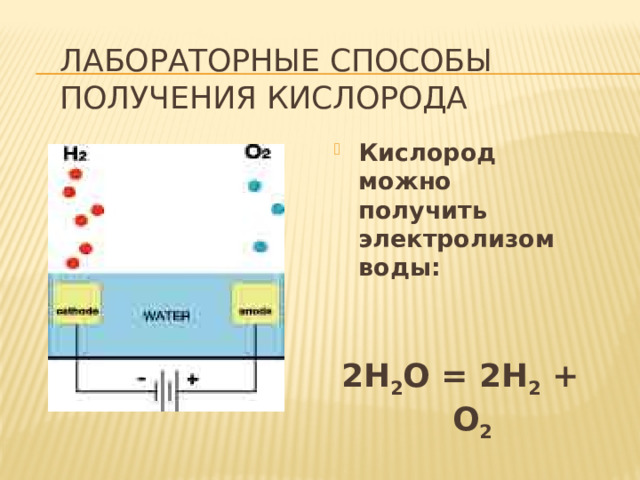
Лабораторные способы получения кислорода
- Кислород можно получить электролизом воды:
2H 2 O = 2H 2 + O 2

Получение кислорода в промышленности
В промышленности кислород получают из воздуха. Воздух представляет собой смесь различных газов, основные компоненты в нем – азот и кислород. Для получения кислорода воздух под давлением сжижают. Так как температура кипения жидкого азота (-196 °С) ниже температуры кипения жидкого кислорода (-183°C), то азот испаряется раньше кислорода. Жидкий кислород отделяют от испарившегося азота и хранят в стальных баллонах под давлением 15 МПа.

выбрать строки, в которых говорится о физических свойствах кислорода
- Когда-то в древней Англии Великий Пристли жил. Все соблюдая правила, Оксид он разложил. Под куполом сосуда Бесцветный газ собрал. Старательно исследуя Его он описал. Не видим и безвкусен, Всех запахов лишен. В воде не растворяется. Свеча сгорает в нем. Ученый в изумлении: Ну что за чудеса? Горят легко в нем многие Простые вещества.
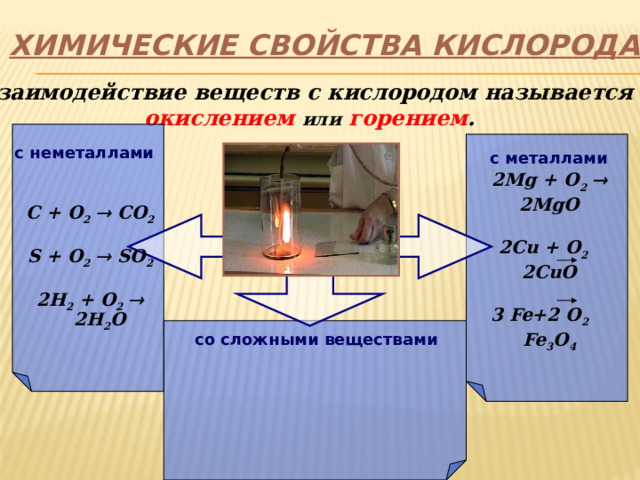
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА
Взаимодействие веществ с кислородом называется
окислением или горением .
2Mg + O 2 2MgO
2Cu + O 2 2CuO
3 Fe+2 O 2 Fe 3 O 4
с неметаллами
с металлами
C + O 2 CO 2
S + O 2 SO 2
2H 2 + O 2 2H 2 O
со сложными веществами




- Кислород – сильный окислитель.
- С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar .
- В результате взаимодействия веществ с кислородом образуется оксиды .
- Оксиды – сложные вещества, которые состоят из двух элементов, одним из которых является кислород.
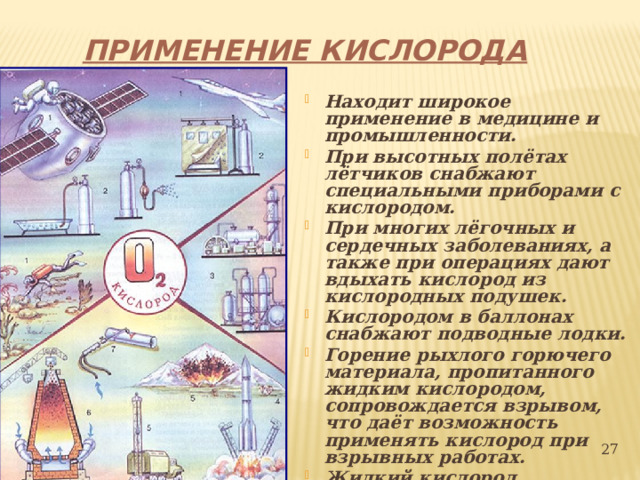
ПРИМЕНЕНИЕ КИСЛОРОДА
- Находит широкое применение в медицине и промышленности.
- При высотных полётах лётчиков снабжают специальными приборами с кислородом.
- При многих лёгочных и сердечных заболеваниях, а также при операциях дают вдыхать кислород из кислородных подушек.
- Кислородом в баллонах снабжают подводные лодки.
- Горение рыхлого горючего материала, пропитанного жидким кислородом, сопровождается взрывом, что даёт возможность применять кислород при взрывных работах.
- Жидкий кислород применяют в реактивных двигателях, в автогенной сварке и резке металлов, даже под водой.
10



















































