Просмотр содержимого презентации
«Кислород, получение, физические свойства»

Примерно века два назад
Открыт он был случайно.
Сейчас знаком с ним стар и млад,
И он для вас не тайна.
Известно, что горят отлично
В нем сера, фосфор, углерод,
Железо, магний.
Энергично сгорает также водород.
Без газа этого на свете
Не жили б звери и народ.
И вам теперь известно, верно?
Его названье …..

ИСТОРИЯ ОТКРЫТИЯ КИСЛОРОДА. СПОСОБЫ ПОЛУЧЕНИЯ. ПОНЯТИЕ О КАТАЛИЗАТОРАХ. ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА
ПОДГОТОВИЛА
УЧИТЕЛЬ ХИМИИ ИЛЬЧЕНКО И.И.

ЦЕЛЬ УРОКА:
- 1. ВСПОМНИТЬ ОСНОВНЫЕ СПОСОБЫ СОБИРАНИЯ ГАЗОВ;
- 2. ПОЗНАКОМИТЬСЯ С ЛАБОРАТОРНЫМИ СПОСОБАМИ ПОЛУЧЕНИЯ КИСЛОРОДА;
- 3. РАССМОТРЕТЬ ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА;
- 4. ПОЛУЧИТЬ ПРЕДСТАВЛЕНИЕ О РЕАКЦИЯХ РАЗЛОЖЕНИЯ;
- 5. ЗАКРЕПИТЬ ЗНАНИЯ О СПОСОБАХ СОБИРАНИЯ ГАЗОВ В ЗАВИСИМОСТИ ОТ ИХ ФИЗИЧЕСКИХ СВОЙСТВ

ВСПОМНИТЕ, ЧТО ВЫ УЗНАЛИ ПРИ ПРОВЕДЕНИИ ЛАБОРАТОРНОГО ОПЫТА?
- 1. КАКИЕ ЕСТЬ ОСНОВНЫЕ СПОСОБЫ СОБИРАНИЯ ГАЗОВ?
- 2. ЧТО НУЖНО ЗНАТЬ О ГАЗЕ, ЧТОБЫ ПРАВИЛЬНО ВЫБРАТЬ СПОСОБ ЕГО СОБИРАНИЯ?


ИСТОРИЯ ОТКРЫТИЯ- О 2
- 1 АВГУСТА 1774 ГОДА АНГЛИЙСКИЙ ХИМИК Джозеф Пристли получил кислород, при помощи разложения оксида ртути
В 1775 году А. Лавуазье установил, что кислород является составной частью
воздуха, кислот и содержится во многих веществах и предложил назвать оксиген - порождающий кислоту

Разложение перманганата калия при нагревании:
2KMnO 4 t K 2 MnO 4 + MnO 2 + O 2

Кислород ФИЗИЧЕСКИЕ СВОЙСТВА:
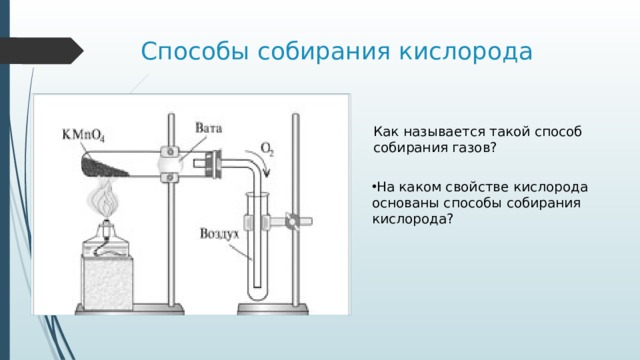
Способы собирания кислорода
Как называется такой способ
собирания газов?
- На каком свойстве кислорода основаны способы собирания кислорода?
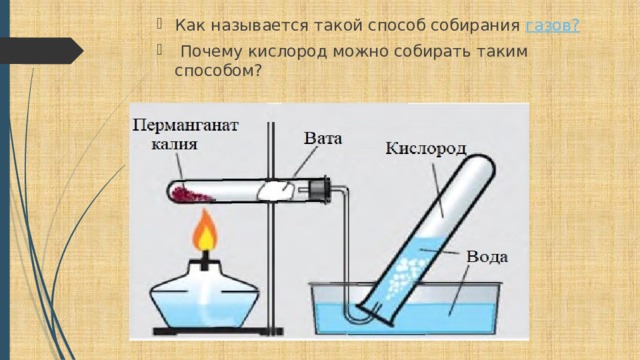
- Как называется такой способ собирания газов?
- Почему кислород можно собирать таким способом?
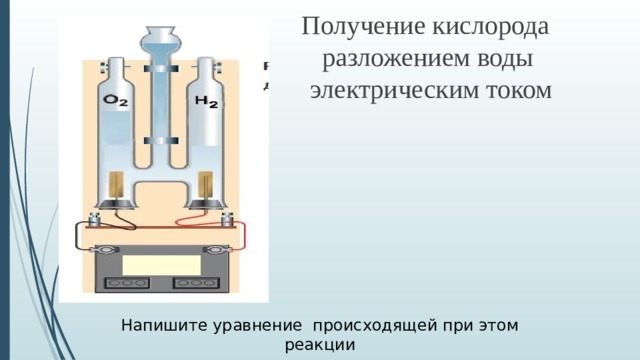
Получение кислорода разложением воды электрическим током
Напишите уравнение происходящей при этом реакции

Получение кислорода в лаборатории
2H 2 O 2 2H 2 O + ?
2KCIO 3 2KCI + ?
2KMnO 4 K 2 MnO 4 +MnO 2 + O 2
2HgO ?+ ?
Чем похожи все эти реакции? Найдите в учебнике с. 99 определение реакций разложения и запишите в тетрадь
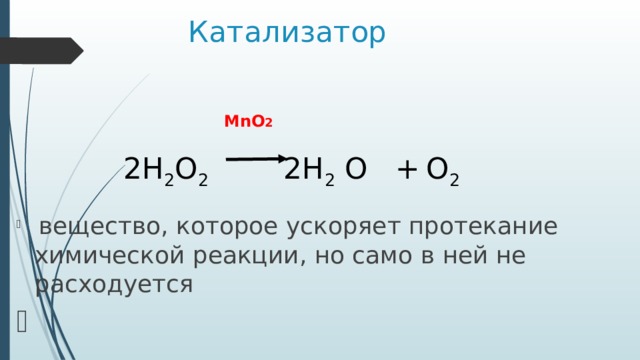
Катализатор
MnO 2
2H 2 O 2 2H 2 O + O 2
- вещество, которое ускоряет протекание химической реакции, но само в ней не расходуется

Закончите предложения:
- 1. «Мне было интересно…»
- 2. «Было трудно…»
- 3. «Я понял, что…»
- 4. «Теперь я могу…»
- «Я научился…»

Домашнее задание
- Выучить материал параграфа 16,
- Выполнить задания 3, 5