Тема №1 Общая и неорганическая химия.
Урок №18 Классификация химических реакций в неорганической и органической химии
Виды химических реакций в неорганической химии
Из определения химии как науки ясно, что под химической реакцией понимают превращения одних веществ в другие. При этом выполняются фундаментальные законы сохранения:
- общий атомный состав продуктов и реагентов одинаковы (атомы сохраняются);
- в реакции сохраняется суммарный заряд;
- энергия, выделяющаяся в ходе прямой реакции, равна энергии, поглощающейся в обратной ей реакции.
Химические реакции классифицируются по различным признакам.
1) Классификация по числу и составу реагирующих и образующихся веществ:
Реакции соединения - это такие реакции, в результате которых из двух или нескольких веществ образуется одно новое вещество, например:
2H2 + O2 = 2H2O или SO3 + H2O = H2SO4
Реакции разложения - это такие реакции, в результате которых из одного сложного вещества образуется несколько новых веществ – простых или сложных, например:
(CuOH)2CO3 = 2CuO + H2O + CO2
Реакции замещения - это реакции, в результате которых атомы простого вещества замещают атомы одного из элементов сложного вещества или молекулы одного вещества замещают некоторые атомы (молекулы) в составе другого вещества, например:
Fe + CuSO4 = FeSO4 + Cu
[Cu(H2O)4]Cl2 + 4NH3 = [Cu(NH3)4]Cl2 + 4H2O
Реакции обмена -это такие реакции, в результате которых два вещества обмениваются своими составными частями, образуя два новых вещества, например:
HCl + KNO2 → KCl + HNO2
Особый вид реакций обмена, протекающий между растворами кислот и щелочей, называют реакциями нейтрализации. При сливании реагентов щелочь и кислота реагируют друг с другом, и реакция среды, образовавшегося раствора, становится нейтральной, например:
H2SO4 + 2КОН = К2SO4 + 2H2O
2) По признаку выделения или поглощения тепла реакции делят на экзотермические и эндотермические. Тепловые эффекты химических реакций.
При образовании связей выделяется энергия, поэтому если бы реакции протекали только между свободными атомами, то все они сопровождались бы выделением энергии. Но химические реакции, как правило, протекают между молекулами веществ.
Сравним количество энергии, выделяющейся при образовании молекулы НС1 из атомов водорода Н и хлора С1, с количеством энергии, выделяющейся при образовании этой же молекулы из простых веществ Н2 и С12:
Н + Cl = НС1 + 431,4 кДж/моль 1/2Н2 + 1/2С12 = НС1 + 92,30 кДж/моль
Энергия взаимодействия простых веществ меньше энергии взаимодействия свободных атомов, так как часть энергии затрачивается на разрыв связей в молекулах водорода (Н-Н) и хлора (C1-C1).
В зависимости от соотношений энергий разрыва и образования соответствующих связей наблюдается выделение или поглощение теплоты.
Реакции, которые протекают с выделением теплоты, называют экзотермическими, например:
Н2 + С12 = 2НС1 + 184,6 кДж
На разрыв связей в молекулах Н2 (Е(Н2) = 435,9 кДж/моль) и С12 (Е(С12) = 242,3 кДж/моль) затрачивается меньше энергии, чем ее выделяется при образовании связей в молекулах НС1 (Е(НС1) = 431,4 кДж/моль):
2 * 431,4 435,9 + 242,3
Реакции, которые протекают с поглощением теплоты, называют эндотермическими, например:
N2 + О2 = 2NO - 180,74 кДж
На разрыв связей в молекулах N2 (Е(N2) = 945,43 кДж/моль) и 02 (Е(02) = 498,38 кДж/моль) энергии затрачивается больше, чем ее выделяется при образовании связей в молекулах N0 (Е(N0) = 631,5 кДж/моль):
2 * 631,5
Количество теплоты, которое выделяется или поглощается при протекании реакции, называют тепловым эффектом реакции. Его обозначают символом «Q» и выражают в килоджоулях (кДж). Для экзотермических реакций Q О (+ Q), для эндотермических реакций Q О (- Q).
Тепловой эффект реакции зависит от условий ее протекания, поэтому его определяют при давлении 101,3 кПа, или 1 атм, и температуре 25 °С, или 298 К. Эти условия называют стандартными.
Тепловой эффект реакции при стандартных условиях выражают через изменение энтальпии Н°реакции
Энтальпия Н — это величина, которая характеризует запас энергии вещества. Если энергия продуктов реакции меньше, чем исходных веществ, то Н 0. Это экзотермическая реакция. Если же энергия продуктов реакции больше, чем исходных веществ, то Н 0 — реакция эндотермическая. Следовательно, знак величины Н противоположен знаку Q:
Термохимические уравнения
Уравнения реакций, в которых указаны тепловые эффекты реакций и агрегатное состояние веществ, называют термохимическими.
В термохимических уравнениях обязательно указывают агрегатное состояние исходных веществ и продуктов реакции: г – газообразное, ж – жидкое, тв. – твердое. Значение теплового эффекта реакции Н записывают после уравнения и отделяют от него точкой с запятой. Например, термохимическое уравнение образования жидкой воды из простых веществ может быть записано двумя способами.
Н2 (г.) + 02 (г.) = 2Н20 (ж.) + 571,68 кДж
Н2 (г.) + 02 (г.) = Н20 (ж.); Н° = - 571,68 кДж
Это термохимическое уравнение показывает, что при взаимодействии 2 моль водорода и 1 моль кислорода образуется 2 моль воды и выделяется 571,68 кДж теплоты. Следовательно, в данном случае энергия продуктов реакции меньше, чем исходных веществ.
Чтобы показать тепловой эффект образования 1 моль вещества, в термохимических уравнениях применяют дробные коэффициенты:
Н2 (г.) + 1/2О2 (г.) = Н20 (ж.); Н° = - 285,84 кДж
Очевидно, что если реакция соединения протекает с выделением теплоты, то обратная ей реакция разложения будет идти с поглощением теплоты. Так, изменение энтальпии при образовании одного моля воды равно -285,84 кДж, а при разложении одного моля воды +285,84 кДж.
По термохимическим уравнениям реакций можно проводить различные расчеты.
Закон Гесса
Большинство термохимических расчетов основано на законе Гесса: тепловой эффект химической реакции при постоянном давлении или постоянном объеме зависит только от природы и физического состояния исходных веществ и продуктов, но не зависит от пути перехода из начального состояния в конечное.
Например, тепловой эффект реакции окисления углерода до оксида углерода (1У) не зависит от того, проводят ли это окисление в одну стадию, сжигая уголь, или в две стадии, получая сначала угарный газ, а затем сжигая его до углекислого газа:
в одну стадию С (тв.) + О2 (г.) = СО2 (г.); Н1°
первая стадия С (тв.) + 1/2О2 (г.) = СО (г.); Н2°
вторая стадия СО (г.) + 1/2О2 (г.) = СО2 (г.); Н3°
Согласно закону Гесса тепловые эффекты связаны между собой соотношением Н1° = Н°2 + Н3, пользуясь которым можно определить один из них, если другие два известны. Таким образом, на основании закона Гесса можно рассчитать тепловые эффекты реакций, для которых экспериментально измерить их невозможно. Например, практически невозможно измерить теплоту окисления углерода до оксида углерода (II), так как продукт реакции всегда будет состоять из смеси оксидов углерода. Но экспериментально можно измерить теплоту полного сгорания углерода до углекислого газа (Н\ = - 393,52 кДж/моль) и теплоту сгорания угарного газа до углекислого (Н = - 283 кДж/моль). Имея эти данные, по закону Гесса легко рассчитать теплоту окисления углерода до оксида углерода (П), т. е. Н2°:
Н2 = Н1 - Н3°; Н = -393,52 - (-283) = - 110,52 (кДж/моль).
Теплоты образования химических соединений. Термохимические расчеты
При расчетах тепловых эффектов химических реакций на остове закона Гесса используют теплоты (энтальпии) образования соединений, которые определены при стандартных условиях.
Стандартная теплота (энтальпия) образования соединешя — это количество теплоты, которое выделяется или поглощается при образовании 1 моль химического соединения в стандартных условиях из простых веществ, устойчивых в этих условиях. Например, из двух аллотропных модификаций кислорода (кислород О2 и озон О3) в стандартных условиях устойчивой формой является кислород О2.
Стандартную теплоту образования выражают в килоджоулях на моль (кДж/моль) и обозначают Н°298 (иногда индексы опускают). Чем меньше значение теплоты образования, тем выше устойчивость соединения при стандартных условиях.
Стандартную теплоту (энтальпию) образования простого вещества принимают равной нулю.
Тепловой эффект химической реакции легко рассчитать, если известны теплоты образования всех участвующих в ней веществ на основании следствия из закона Гесса:
тепловой эффект химической реакции равен сумме теплоп образования продуктов реакции за вычетом суммы теплоп образования исходных веществ с учетом стехиометрических коэффициентов в уравнении реакции.
Так, для реакции аА + бВ = сС + dD
Н реакции = (сН(С) + dH°(D)) - (аН(А) + бН°(В)),
где Н° реакции — тепловой эффект химической реакции; а, б, с, d — стехиометрические коэффициенты;
Н°(А) и Н°(В) — теплоты образования исходных веществ;
Н°(С) и Н°(D) — теплоты образования продуктов реакции.
Задача. При взаимодействии свежеприготовленного кристаллического оксида алюминия и газообразного оксида серы (У1) получен кристаллический сульфат алюминия. Составьте термохимическое уравнение реакции, вычислив на основании стандартных теплот образования веществ ее тепловой эффект. Укажите, какая это реакция — экзотермическая или эндотермическая.
Решение
Составляем уравнение реакции:
А12О3 + 3SО3 = Al2(SO4)3
Вычисляем тепловой эффект реакции.
Согласно следствию из закона Гесса
H°реакции = H°(A12(SO4)3, тв.) - ((H(А12O3, тв.) + 3H°(SO3, г.)).
Подставив в это уравнение значения величин получаем:
Hреакции = 3442,0 - (-1669,8 + 3 • (-396,1)) = - 583,9 (кДж).
Тепловой эффект реакции равен - 583,9 кДж, следовательно, реакция экзотермическая, протекает с выделением теплоты.
Записываем термохимическое уравнение реакции:
А1203 (тв.) + 3SO3 (г.) = A12(S04)3 (тв.); Hреакцпи = - 583,9 кДж.
Ответ: Нреакцин = -583,9 кДж.
3) По возможности протекания процесса в двух взаимно противоположных направлениях, реакции подразделяются на обратимые и необратимые.
Обратимые - это такие реакции, которые могут протекать в двух взаимно противоположных направлениях при небольшом изменении условий (концентраций, температуры, давления), например:
3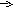
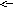 H2 + N2 2NH3
H2 + N2 2NH3
В уравнениях обратимых реакций знак равенства заменяется двумя стрелками, направленными в противоположные стороны.
Необратимые - это реакции, протекающие до конца, т.е. до полного превращения исходных реагентов в конечные продукты; причём обратная реакция не может быть проведена ни при каких условиях. Примером такой принципиально необратимой реакции может служить разложение бертолетовой соли при нагревании:
2KClO3 = 2KCl + 3O2.
Реакция прекратится тогда, когда вся соль превратится в хлорид калия и кислород. Необратимых реакций немного. Большинство реакций являются обратимыми.
4) По изменению степеней окисления атомов элементов, образующих реагенты и продукты реакции, различают основно-кислотные и окислительно-восстановительные реакции.
Основно-кислотно реакции протекают без изменения степеней окисления. К ним относятся реакции между кислотами и основаниями, солями и кислотами, солями и основаниями, а также реакции гидролиза солей, например:
НCl + NaOH = NaCl + Н2О;
BaCl2 + H2SO4 = BaSO4¯ + 2HCl
Окислительно-восстановительные реакции) протекают с изменением степени окисления всех или части элементов, например:
+4 -1 +2 0
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
Степенью окисления называют условный заряд атомов в химическом соединении, если предполагают, что оно состоит только из простых ионов.
+3 -2 0 0 +3 -2
Fe2O3 + 2Al = 2Fe + Al2O3
Как видно из уравнения, два элемента – железо и алюминий изменили степени окисления.
Алюминий из нейтрального атома превратился в условный ион в степени окисления +3, т.е. отдал 3 электрона:
0 +3
A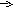 l - 3e Al
l - 3e Al
Элемент (или вещество) , отдающий электроны, называют восстановителем, сам он при этом окисляется.
Условный ион железа в степени окисления +3 превратился в нейтральный атом, т.е получил при этом три электрона.
+3 0
F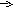 e + 3e Fe
e + 3e Fe
Элемент (или вещество) принимающий электроны, называют окислителем, сам элемент при этом восстанавливается.
5) Катализаторы
Большое влияние на скорость химических реакций оказывает присутствие некоторых веществ. Одни из них увеличивают скорость реакции. Например, в роли ускорителя часто выступает в да. Если поместить в тигель или фарфоровую чашку немного см си порошкообразного алюминия с предварительно растертым порошок йодом и тщательно перемешать ее стеклянной палочкой, видимых изменений не наблюдается. Однако достаточно к этой смеси добавить одну каплю воды, как происходит вспышка — результат бурного взаимодействия йода с алюминием:
Н2О
2А1 + 312 — 2А1I3
Вещества, которые увеличивают скорость химической реакции, но сами не расходуются в результате ее протекания, называют катализаторами.
Изменение скорости химической реакции под действием катализатора называют катализом.
Химические реакции, которые протекают в присутствии катализаторов, называют каталитическими.
В большинстве случаев действие катализатора объясняется тем, что он снижает энергию активации, необходимую для протекания реакции. Влияние катализатора на энергию активации процесса можно проиллюстрировать на примере реакции разложения йодоводорода:
2HI = Н2 + I2
Энергия активации реакции разложения йодоводорода
Условия протекания реакции - без катализатора - 168 кДж/моль
- катализатор Аu - 105 кДж/моль
- катализатор Pt - 59 кДж/моль
Действие катализаторов специфично: ускоряя протекание одной реакции, катализатор может оказаться неэффективным для другой. Так, для окисления оксида серы (1У) в оксид серы (У1) в качестве катализатора используют оксид ванадия (У), который эффективен при окислении аммиака до оксида азота (II).
Активность катализаторов может изменяться при добавлении некоторых веществ.
Посторонние вещества, которые резко снижают действие катализатора, называют каталитическими ядами. Например, в производстве серной кислоты оксид мышьяка (У) является ядом для катализатора, поэтому оксид серы (1У) тщательно очищают от соединений мышьяка.
Вещества, повышающие активность катализаторов, называть промоторами. Так, каталитическая активность оксида ванадия (V) V2О5 по отношению к реакции окисления оксида серы (1У) повышается при добавлении небольших количеств щелочи.
В зависимости от агрегатного состояния реагирующих веществ и катализаторов различают гомогенный и гетерогенный катализ.
При гомогенном катализе катализатор и реагирующие вещества находятся в одной фазе (газовой или жидкой) и между ними существует поверхность раздела, как, например, при окислении сила серы (1У) до оксида серы (У1) в присутствии оксида азота (П), образовании простых и сложных эфиров в присутствии минеральных кислот.
Механизм гомогенного катализа объясняет теория промежуточных соединений, согласно которой в присутствии катализа ра реакция протекает с его участием и в несколько стадий. Так, если реакция
А + В = АВ
без катализатора протекает медленно вследствие большой энергии активации, то катализатор К вступает во взаимодействие с одним из исходных веществ, например А, образуя промежуточное соединение АК:
А + К = АК
Эта реакция протекает быстро, так как ее энергия активации невелика. Образовавшееся промежуточное соединение АК по той же причине легко реагирует со вторым исходным веществом образуя конечный продукт АВ и катализатор К, который вновь участвует в реакции.
Например, действие катализатора оксида азота (II) при окислении оксида серы (1У) можно схематически представить так:
SО2 + 1/2О2 = SО3 без катализатора протекает медленно
N0 — катализатор
NO + 1/2О2 = NО2 - промежуточное соединение
N02 + S02 = S03 + NO
Катализатор принял участие в процессе, но в итоге остался неизменным.
Таким образом, ускорение реакции под действием катализатора происходит благодаря тому, что скорость отдельных стадий во много раз больше скорости суммарной реакции окисления оксид серы (1У) в оксид серы (У1).
При гетерогенном катализе катализатор и реагирующие вещества находятся в разных фазах (обычно катализатор — твердое вещество, реагирующие вещества — газы или жидкости), как например, в реакциях окисления аммиака в присутствии платины, оксида серы (1У) в присутствии оксида ванадия (У).
Все реакции при гетерогенном катализе протекают на поверхности катализатора, поэтому активность твердого катализатора зависит от химического состава, строения, состояния и площади его поверхности.
Поверхность катализатора неоднородна. Полагают, что на ней имеются активные центры, на которых главным образом и протекают каталитические реакции. При этом реагирующее вещество, например водород, адсорбируется на этих центрах, в результате чего в адсорбированных молекулах ослабляются связи между атомами и увеличиваются расстояния между ними. Молекулы становятся более реакционноспособными. Для того чтобы реакция началась, потребуется меньшая энергия активации, чем для той же реакции, но без катализатора.
Таким образом, снижение энергии активации, необходимой для протекания реакции, является главной причиной ускоряющего действия катализаторов. Показателен тот факт, что с участием катализатора реакции протекают при температуре более низкой, чем без него.
Велика роль катализаторов в химическом производстве. Их используют при получении серной кислоты, синтетического каучука, лекарственных препаратов, жидкого топлива из угля, синтезе аммиака, переработке нефти и природного газа и т. д. Применение катализаторов позволяет интенсифицировать многие технологические процессы, осуществлять их при более низкой температуре. Поиски новых, более совершенных катализаторов способствуют повышению производительности труда и снижению себестоимости продукции.
Широко распространены каталитические реакции и в природе. Все биохимические превращения в живых организмах — синтез белков, обмен веществ — протекают в присутствии биологических катализаторов — ферментов, которые будут рассмотрены в курсе органической химии.
Но имеется целый ряд веществ, которые понижают скорость химической реакции. В две пробирки нальем разбавленную соляную кислоту, в одну из них добавим немного уротропина (его можно купить в аптеке). В каждый раствор опустим предварительно зачищенный железный гвоздь. В кислоте гвоздь растворяется, покрываясь пузырьками выделяющегося водорода. В присутствии уротропина выделение водорода практически не наблюдается.
Вещества, которые снижают скорость химической реакции, называют ингибиторами.
6) Классификация реакций по фазовому составу веществ
Вещества могут существовать в трех основных агрегатных состояниях — твердом, жидком и газообразном.
Фазой называют однородную по составу и свойствам часть системы, которая отделена от других фаз поверхностью (границей) раздела. По количеству фаз, которые образуют реагенты и продукты, все химические реакции подразделяют на гомогенные и гетерогенные.
Гомогенные реакции — это такие реакции, в которых реагирующие вещества и продукты находятся в одной фазе, и столкновение реагирующих частиц происходит во всем объеме реакционной смеси. К гомогенным реакциям относят взаимодействия жидкость-жидкость и газ-газ.
2СО(г) + О2(г) = 2СО2(г);
СН4(г) + С12(г) =CH3Cl(г) +HCl(г);
NaOH(p-p) +HCl(p-p) =NaCl(p-p) + Н2О (ж);
2SO2(г) + O2(г) = 2SO3(г)
Гетерогенные реакции — это реакции, в которых реагирующие вещества и продукты находятся в разных фазах. При этом столкновение реагирующих частиц происходит только на границе соприкосновения фаз. К таким реакциям относятся взаимодействия газ-жидкость, газ-твердая фаза, твердая-твердая, и твердая фаза — жидкость.
Например, взаимодействие углекислого газа и гидроксида кальция:
CO2(г) + Ca(OH)2(р-р) = CaCO3(тв) + H2O
Если хотя бы один из участников реакции (включая катализатор) находится в иной фазе по сравнению со всеми остальными, реакцию называют гетерогенной (многофазной):
Zn(к)+HCl(p-p) =ZnCl2(p-p) + Н2(г);
2SО2(г) + О2(г) ↔ 2SО3(г), катализаторV2O5(тв);
Реакции в гетерогенных системах протекают на границе раздела фаз, поэтому на их скорость очень существенное влияние оказывает степень измельчения твердых веществ.
Для классификации реакций по фазовому состоянию полезно уметь определять фазовые состояния веществ. Это достаточно легко сделать, используя знания о строении вещества, в частности, о типах кристаллической решетки.
Вещества с ионной, атомной или металлической кристаллической решеткой, как правило твердые при обычных условиях; вещества с молекулярной решеткой, как правило, жидкости или газы при обычных условиях.
Обратите внимание, что при нагревании или охлаждении вещества могут переходить из одного фазового состояния в другое. В таком случае необходимо ориентироваться на условия проведения конкретной реакции и физические свойства вещества.
Например, получение синтез-газа происходит при очень высоких температурах, при которых вода — пар:
CH4(г) + H2O(г) = CO(г) + 3H2(г)
Таким образом, паровая конверсия метана — гомогенная реакция.







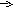
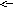 H2 + N2 2NH3
H2 + N2 2NH3



















