«Осень. Обсыпается весь наш бедный сад,
Листья пожелтелые по ветру летят;
Лишь вдали красуются, там на дне долин,
Кисти ярко-красные вянущих рябин.» (А.К.Толстой)
Если бы миллионы разнообразных веществ, а следовательно, и тела, из которых они состоят не претерпевали изменения , мир бы был застывшим, лишенным развития, движения, одним словом безжизненная планета. Под воздействием внешних условий вещества изменяются.
Течет жизнь…и течет она благодаря химическим реакциям и физическим явлениям.
Итак, химических реакций протекающих вокруг человека очень много, они протекают постоянно. Что же необходимо сделать, чтобы не запутаться во всём многообразии химических реакций?
Ответ: В любой науке применяется прием классификации, позволяющий по общим признакам разделить все множество объектов на группы.
Что происходит в ходе химической реакции с веществами?
.В ходе химической реакции из одних веществ образуются другие вещества, отличающиеся от исходных по составу, строению и свойствам.
При изучении курсов неорганической и органической химии мы изучили множество химических реакций.
Дома вам необходимо было подготовить таблицу, которая поможет систематизировать известные реакции.
?Как вы думаете, какой признак объединил все указанные реакции:
Р(белый) Р (красный)
C(графит) С (алмаз)
С4Н10 (бутан) С4 Н 10 (изобутан)
Данные реакции не сопровождаются изменением состава веществ.
?Как называется явление существования разных простых веществ, образованных одним элементом? (Аллотропия)
?Как называется процесс превращения бутана в изобутан? (изомеризация)
Вывод: Процесс взаимопревращений разных аллотропных модификаций одного химического элемента и реакции изомеризации относятся к реакциям, которые не сопровождаются изменением состава веществ.
Классификацию химических реакций, протекающих с изменением состава вещества, можно проводить по самым разным признакам.
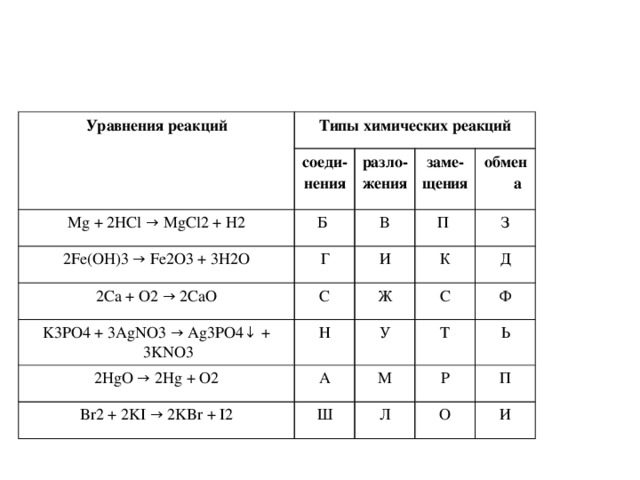
? Какие типы реакций, протекающих с изменением состава вещества вы знаете?
(реакция соединения, разложения, обмена, замещения.)
?Определите, какой признак объединяет эти реакции:
| В неорганической химии | В органической химии |
| S+ O2 = SO2 | CH2=CH2 + H2 = CH3-CH3 |
| SO3 + H2O = H2SO4 | CH2=CH2 + H2O = CH3-CH2-OH |
из нескольких веществ образуется одно, происходит соединение.
?Одинаковый ли механизм протекания реакций такого типа в органической и неорганической химии?
А какие реакции присоединения вы еще знаете?
Вывод: Реакции, в результате которых из двух и более веществ образуется одно сложное вещество называются реакциями соединения в неорганической химии и реакциями присоединения в органической химии.
А какой реакции здесь идет речь? «Скажите что это такое, один нырнул, а всплыло двое» (разложения) Мы с вами выполняли практическую работу «Получение газов», кто из вас получил газ и какой реакцией разложения?
2Н2О2 = 2Н2О + О2
В органической химии реакции разложения
1. Реакция дегидратации (отщепления воды) этанола:
2. Реакция дегидрирования (отщепление водорода) этана:
CH3-CH3 → CH2=CH2 + H2
3. Реакция крекинга (расщепления) пропана:
CH3-СН2-СН3 → СН2=СН2 + СН4
В неорганической химии реакции называются реакциями разложения, в органической – реакциями отщепления.
Просмотрите видеофрагменты: получение железа из его оксида, Получение железа: http://school-collection.edu.ru/catalog/res/d77a30c4-8cff-11db-b606-800200c9a66/?from=d05469af-69bd-11db-bd13-0800200c9c11&interface=catalog&class=54&subject=31
Составьте уравнения данных реакций.
?Какой тип реакции?
В органической химии реакции замещения понимаются шире, то есть замещать может не один атом, а группа атомов или замещается не атом, а группа атомов. К разновидности реакции замещения можно отнести нитрование и галогенирование предельных углеводородов, ароматических соединений, спиртов и фенола
Найдите среди перечисленных реакции замещения.
1)C6H6+ 6H2 = C6H12
2)C6H6 + HNO3 = C6H5NO2 + H2O
3)CH4 + Cl2 = CH3Cl + HCl
Ребята, определите к какому типу можно отнести реакции между предложенными веществами.
Лабораторная работа (работа в группах)
Проведите опыты, соблюдая правила техники безопасности.
Na2SO4 + BaCl2 (реакция обмена) выпадает осадок.
Реакции, в которых два сложных вещества обмениваются своими составными частями называются реакциями обмена. Реакции протекают по правилу Бертолле, т.е. только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (вода).
Реакции обмена в органической химии характерны для спиртов и карбоновых кислот
По изменению степеней окисления химических элементов, образующих вещества:
Окислительно-восстановительные реакции – реакции, идущие с изменением степеней окисления элементов. К ним относятся реакции замещения, соединения, разложения с участием простых веществ
Приведите пример.
Реакции, идущие без изменения степеней окисления химических элементов.
В основном это реакции обмена, соединения, разложения, с участием сложных веществ.
Классификация химических реакций по тепловому эффекту
1) Экзотермические реакции – реакции, протекающие с выделением тепловой энергии (почти все реакции соединения, кроме N2 + O2 = 2NO –Q , H2 + I2 =2HI – Q)
Как называются реакции, протекающие с выделением света?
2C6H6 + 15O2 → 12CO2 +6H2O + Q
2) Эндотермические реакции – реакции, протекающие с поглощением теплоты (в основном реакции разложения) CaCO3 = CaO + CO2
Количество выделенной или поглощенной теплоты называется тепловым эффектом реакции. Уравнение химической реакции, в которой указан тепловой эффект, называется термохимическим уравнением.
Классификация химических реакций по участию катализатора
Каталитические, идущие с участием катализатора
2) Некаталитические, идущие без участия катализатора
Классификация химических реакций по направлению
1) Необратимые реакции – реакции, которые протекают при данных условиях в одном направлении К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды) и все реакции горения.
KOH + HCI = KCI + H2O
2) Обратимые – это реакции, которые при одних и тех же условиях протекают в двух противоположных направлениях
2SO2 + O2↔ 2SO3
В органической химии признак обратимости отражают названия - антонимы процессов:
• гидрирование - дегидрирование,
• гидратация - дегидратация,
• полимеризация - деполимеризация.
Классификация химических реакций по агрегатному состоянию реагирующих веществ (фазовому состоянию)
Гетерогенные реакции – реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях
CaC2(т) + 2H2O(ж) = C2H2↑+ Ca(OH)2(р-р)
2) Гомогенные реакции – реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии
H2(г) + F2(г) = 2HF(г)
| №
п/п | Признак
классификации | Тип
реакции | Пример |
| 1. | По числу и составу исходных веществ и продуктов реакции
| Соединения | CaO+H2O=Ca(OH)2 |
| Разложения | 2H2O=2H2+O2 |
| Замещения | CuCl2+Zn=Cu+ZnCl2 |
| Обмена | NaOH+HCl=NaCl+H2O |
| Изомеризации | Бутан = изобутан |
| Аллотропного превращения | 3O2=2O3 |
| 2. | Наличие окислительно-
восстановительного
процесса | Окислительно-восстановительная | Zn0+2H+Cl =Zn+2Cl2+H20 |
| Без изменения степени окисления | CaCO3=CaO+CO2 |
| 3. | Тепловой эффект | Эндотермическая | 2HgO=2Hg+O2-Q |
| Экзотермическая | CH4+2O2= CO2+H2O+Q |
| 4. | Участие катализатора | Каталитическая | C2H2+HOH=Hg2+=CH3COH |
| Некаталитическая | 2Ca+O2=2CaO |
| 5. | Обратимость реакции | Обратимая | SO2+H2O= H2SO3 |
| Необратимая | BaCl2+Na2SO4=2NaCl+BaSO4 |
| 6. | Исходное состояние
реагирующей
системы | Гомогенная | N2+O2=2NO |
| Гетерогенная | P2O5+3H2O =2H3PO4 |
Закрепление. Классификация химических реакций, как и все другие классификации, условна. Ученые договорились разделить реакции на определенные типы по выделенным ими признакам. Но большинство химических превращений можно отнести к разным типам.
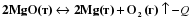 Дать характеристику для химического уравнения по признакам классификации:
Дать характеристику для химического уравнения по признакам классификации:
2. Даны фрагменты уравнений химических реакций
1. ……… = 2KOH+H2+Q
2……….. = 2HI-Q
3. ……… = CaO+CO2-Q
4.2AgNO3+CaCl2=Ca(NO3)2+2 AgCl
5.2SO2+O2-……+Q
1) Выберите уравнения эндотермических реакций.
2) Выберите уравнение химической реакции, соответствующей характеристике: реакция разложения, эндотермическая, некаталитическая, идущая без изменения степени окисления атомов химических элементов.
3) Найдите уравнение реакции обмена, идущей до конца вследствие образования осадка.
4) Выберите уравнение химической реакции замещения.
5) Найдите уравнение обратимой каталитической реакции.
Приложение №3
Тест по теме «Классификация химических реакций»
Вариант 1
Часть А Выберите правильный ответ из предложенных.
А 1. Из перечисленных ниже процессов к химической реакции относится:
горение 2) кипение 3) плавление 4) возгонка
А 2. Какому типу реакции соответствует уравнение:
Zn(OH)2 +H2 SO4 = Zn SO4 + 2 H2 O
oбмена 2) соединение 3) разложение 4) замещение
А 3. Окислительно – восстановительной не является реакция
2Na + Cl2 = 2NaCl 2) 2NaCl + H2 SO4 = Na2 SO4 + 2HCl↑
3) Zn +2HCl= Zn Cl2 + H2 ↑ 4) H2C=O + 2Ag2O= 4 Ag + CO2↑+ H2O
Часть B. Установите соответствие между УХР и типом реакции, к которой она относится.
А) 2 H2 O= 2H2 + O2 1. соединение
Б) CuSO4 + Fe = Cu + FeSO4 2. обмен
В) 4P + 5O2 = 2P2 O5 3. разложение
Г) Zn(OH)2 + H2 SO4 = 2H2O + Zn SO4 4. замещение
Часть C. Допишите УХР:
… = 2Hg + O2
Тест по теме «Классификация химических реакций»
Вариант2
Часть А Выберите правильный ответ из предложенных.
А 1. Из перечисленных ниже процессов к химической реакции относится:
замерзание 2) гниение 3) кристаллизация 4) плавление
А 2. Какому типу реакции соответствует уравнение:
Zn(OH)2 = Zn O+ 2 H2 O
oбмена 2) соединение 3) разложение 4) замещение
А 3. Окислительно – восстановительной является реакция
2Na + Cl2 = 2NaCl 2) 2NaCl + H2 SO4 = Na2 SO4 + 2HCl↑
3) Zn O+2HCl= Zn Cl2 + H2 O 4) H2SO4 + Ag2O= Ag2 SO4 + H2O
Часть B. Установите соответствие между УХР и типом реакции, к которой она относится.
А) 2 H2 O= 2H2 + O2 1. разложение
Б) CuSO4 + Fe = Cu + FeSO4 2. обмен
В) 4Al + 3O2 = 2Al2 O3 3. соединение
Г) Zn(OH)2 + H2 SO4 = 2H2O + Zn SO4 4. замещение
Часть C. Допишите УХР:
… + 2HNO3= Mg(NO3)2 +H2O
Тест по теме «Классификация химических реакций»
Вариант3
Часть А Выберите правильный ответ из предложенных.
А 1. Из перечисленных ниже процессов к химической реакции не относится:
горение 2) кипение 3) окисление 4) ржавление
А 2. Какому типу реакции соответствует уравнение:
Ca(OH)2 + 2HCl = CaCl2 + 2 H2 O
oбмена 2) соединение 3) разложение 4) замещение
А 3. Эндотермической является реакция
2Na + Cl2 = 2NaCl 2) Fe(OH)2 = FeO+ H2O
3) Zn +2HCl= Zn Cl2 + H2 4) H2SO4 + Ag2O= Ag2 SO4 + H2O
Часть B. Установите соответствие между УХР и типом реакции, к которой она относится.
А) 2 H2 O2= 2H2 O+ O2 1. замещение
Б) CuSO4 + Fe = Cu + FeSO4 2. обмен
В) S + O2 = S O2 3. соединение
Г) Zn(OH)2 + H2 SO4 = 2H2O + Zn SO4 4. разложение
Часть C. Допишите УХР:
… + 5O2= 2P2 O5
Тест по теме «Классификация химических реакций»
Вариант 4
Часть А Выберите правильный ответ из предложенных.
А 1. Из перечисленных ниже процессов к химической реакции относится:
замерзание 2) кипение 3) кристаллизация 4) ржавление
А 2. Какому типу реакции соответствует уравнение:
Mg + 2HCl = MgCl2 + 2 H2
oбмена 2) соединение 3) разложение 4) замещение
А 3. Гомогенной является реакция
1) H2 + Cl2 = 2HCl 2) Fe(OH)2 = FeO+ H2O
3) Zn +2HCl= Zn Cl2 + H2 4) H2SO4 + Ag2O= Ag2 SO4 + H2O
Часть B. Установите соответствие между УХР и типом реакции, к которой она относится.
А) 2 H2 O2= 2H2 O+ O2 1. замещение
Б) CuO +2HBr = CuBr2 + H2O 2. обмен
В) S + O2 = S O2 3. разложение
Г) Mg + ZnO= MgO + Zn 4. соединение
Часть C. Допишите УХР:
2SO2 + O2=
11







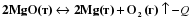 Дать характеристику для химического уравнения по признакам классификации:
Дать характеристику для химического уравнения по признакам классификации: