
Комплексные соединения

Координационная теория А.Вернера
В 1893 г. швейцарским химиком-неоргаником Альфредом Вернером (1866–1919) была сформулирована теория, позволившая понять строение и некоторые свойства комплексных соединений и названная координационной теорией. Поэтому комплексные соединения часто называют координационными соединениями.
![Основные положения координационной теории А. Вернера 1. В составе комплексного соединения один из ионов или атомов является центральным, его называют комплексообразователем . Комплексообразователями могут быть d металлы. Na[Al(OH) 4 ]](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img2.jpg)
Основные положения координационной теории А. Вернера
- 1. В составе комплексного соединения один из ионов или атомов является центральным, его называют комплексообразователем . Комплексообразователями могут быть d металлы.
Na[Al(OH) 4 ]

Основные положения координационной теории А. Вернера
- 2. Вокруг центрального атома комплексообразователя присоединяются либо другие ионы, либо нейтральные молекулы, которых может быть определенное число. Это число называется координационным. Молекулы или ионы расположенные вокруг центрального атома комплексообразователя называются лигандами (от латинского " ligare " - связывать).
Na[Al(OH) 4 ]

Основные положения координационной теории А. Вернера
- Лиганды - это нейтральные молекулы или ионы, неионогенно связанные с комплексообразователем.
- Координационное число - это число лигандов, вокруг комплексообразователя.
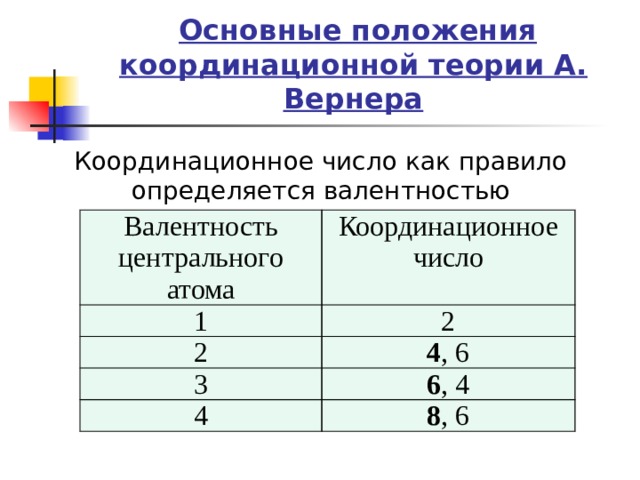
Основные положения координационной теории А. Вернера
Координационное число как правило определяется валентностью комплексообразователя:
Валентность центрального атома
1
Координационное число
2
2
4 , 6
3
4
6 , 4
8 , 6

Основные положения координационной теории А. Вернера
- 3 . Число связей, которыми лиганд присоединяется к комплексообразователю называется дентантностью .
Если связь одна, то лиганд монодентантен, если две - дидентантен и т.д.
Координационное число определяется числом химических связей с лигандами. В случае монодентантности кординационное число равно числу лигандов.
В случае, если лиганд полидентантен, то координационное число равно числу лигандов умноженное на дентантность лигандов.
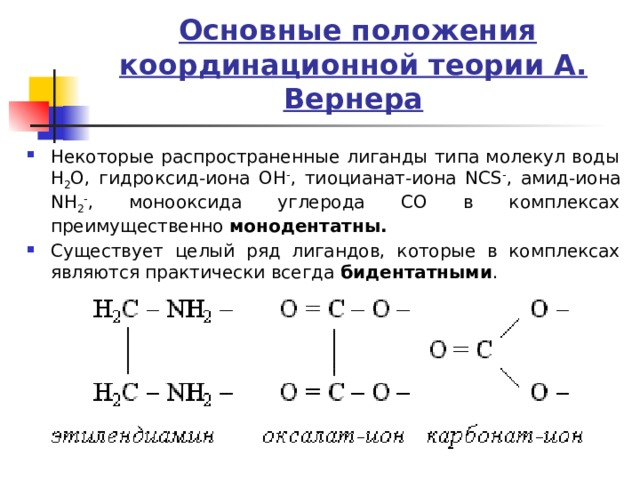
Основные положения координационной теории А. Вернера
- Некоторые распространенные лиганды типа молекул воды H 2 O, гидроксид-иона OH - , тиоцианат-иона NCS - , амид-иона NH 2 - , монооксида углерода CO в комплексах преимущественно монодентатны.
- Существует целый ряд лигандов, которые в комплексах являются практически всегда бидентатными .
![Основные положения координационной теории А. Вернера 4 . Центральный атом комплексообразователь вместе с лигандами образует внутреннюю сферу, которую при написании заключают в квадратные скобки. Na[Al(OH) 4 ]](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img8.jpg)
Основные положения координационной теории А. Вернера
- 4 . Центральный атом комплексообразователь вместе с лигандами образует внутреннюю сферу, которую при написании заключают в квадратные скобки.
Na[Al(OH) 4 ]
![Основные положения координационной теории А. Вернера 5 . За квадратными скобками записываются ионы наиболее удаленные от центрального атома, они образуют внешнюю сферу комплекса. Na[Al(OH) 4 ]](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img9.jpg)
Основные положения координационной теории А. Вернера
5 . За квадратными скобками записываются ионы наиболее удаленные от центрального атома, они образуют внешнюю сферу комплекса.
Na[Al(OH) 4 ]
![Строение комплексных соединений Внешняя Внутренняя сфера сфера K 3 [Fe(CN) 6 ] Координационное число Ион- Комплексо- образователь Лиганды [Cu(NH 3 ) 4 ]Cl 2 Внутренняя сфера Внешняя сфера](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img10.jpg)
Строение комплексных соединений
Внешняя
Внутренняя
сфера
сфера
K 3 [Fe(CN) 6 ]
Координационное
число
Ион-
Комплексо-
образователь
Лиганды
[Cu(NH 3 ) 4 ]Cl 2
Внутренняя
сфера
Внешняя
сфера

Комплексные соединения - это сложные вещества, состоящие из внутренней и внешней сферы, где во внутренней сфере центральный атом комплексообразователь неионогенно соединяется с лигандами.
![Классификация комплексных соединений 1. По составу: а) Катионогенные (если внутренняя сфера расположена на первом месте); [Ag(NH 3 ) 2 ]OH](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img12.jpg)
Классификация комплексных соединений
1. По составу:
а) Катионогенные (если внутренняя сфера расположена на первом месте);
[Ag(NH 3 ) 2 ]OH
![Классификация комплексных соединений б) Анионогенные (если внутренняя сфера расположена на втором месте); Na[Ag(CN) 2 ] Ca[Cr(NH 3 ) 2 (NCS) 4 ] 2](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img13.jpg)
Классификация комплексных соединений
б) Анионогенные (если внутренняя сфера расположена на втором месте);
Na[Ag(CN) 2 ]
Ca[Cr(NH 3 ) 2 (NCS) 4 ] 2
![Классификация комплексных соединений в) Нейтральные ( если отсутствует внешняя сфера). [Cu(NH 3 ) 4 Cl(NO 2 )] [Cr(H 2 O) 3 (OH) 3 ]](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img14.jpg)
Классификация комплексных соединений
в) Нейтральные ( если отсутствует внешняя сфера).
[Cu(NH 3 ) 4 Cl(NO 2 )]
[Cr(H 2 O) 3 (OH) 3 ]
![Классификация комплексных соединений 2. По типу лигандов. а) Аквакомплексы – это комплексные катионы, в которых лигандами являются молекулы H 2 O. Их образуют катионы металлов со степенью окисления +2 и больше, причем способность к образованию аквакомплексов у металлов одной группы периодической системы уменьшается сверху вниз. Примеры аквакомплексов: [Al(H 2 O) 6 ]Cl 3 , [Cr(H 2 O) 6 ](NO 3 ) 3 .](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img15.jpg)
Классификация комплексных соединений
2. По типу лигандов.
а) Аквакомплексы – это комплексные катионы, в которых лигандами являются молекулы H 2 O. Их образуют катионы металлов со степенью окисления +2 и больше, причем способность к образованию аквакомплексов у металлов одной группы периодической системы уменьшается сверху вниз.
Примеры аквакомплексов:
[Al(H 2 O) 6 ]Cl 3 , [Cr(H 2 O) 6 ](NO 3 ) 3 .
![Классификация комплексных соединений б) Гидроксокомплексы – это комплексные анионы, в которых лигандами являются гидроксид-ионы OH – . Комплексообразователями являются металлы, склонные к проявлению амфотерных свойств – Be, Zn, Al, Cr. Например: Na[Al(OH) 4 ], Ba[Zn(OH) 4 ]. в) Аммиакаты – это комплексные катионы, в которых лигандами являются молекулы NH 3 . Например: [Cu(NH 3 ) 4 ]SO 4 , [Ag(NH 3 ) 2 ]Cl.](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img16.jpg)
Классификация комплексных соединений
б) Гидроксокомплексы – это комплексные анионы, в которых лигандами являются гидроксид-ионы OH – . Комплексообразователями являются металлы, склонные к проявлению амфотерных свойств – Be, Zn, Al, Cr.
Например: Na[Al(OH) 4 ], Ba[Zn(OH) 4 ].
в) Аммиакаты – это комплексные катионы, в которых лигандами являются молекулы NH 3 .
Например: [Cu(NH 3 ) 4 ]SO 4 , [Ag(NH 3 ) 2 ]Cl.
![Классификация комплексных соединений г) Ацидокомплексы – это комплексные анионы, в которых лигандами являются анионы неорганических и органических кислот. Например: K 3 [Al(C 2 O 4 ) 3 ], Na 2 [Zn(CN) 4 ], K 4 [Fe(CN) 6 ]. Между этими классами существуют переходные ряды, которые включают комплексы с различными и лигандами.](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img17.jpg)
Классификация комплексных соединений
г) Ацидокомплексы – это комплексные анионы, в которых лигандами являются анионы неорганических и органических кислот.
Например: K 3 [Al(C 2 O 4 ) 3 ], Na 2 [Zn(CN) 4 ], K 4 [Fe(CN) 6 ].
Между этими классами существуют переходные
ряды, которые включают комплексы с различными и лигандами.
![Циклические , или хелатные (клешневидные), комплексные соединения. Они содержат би- или полидентатный лиганд, который как бы захватывает центральный атом подобно клешням рака: Примерами таких комплексов служат оксалатный комплекс железа (III) [Fe(C 2 O 4 ) 3 ] 3- и этилендиаминовый комплекс платины (IV) - [PtEn 3 ] 4+ .](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img18.jpg)
Циклические , или хелатные (клешневидные), комплексные соединения. Они содержат би- или полидентатный лиганд, который как бы захватывает центральный атом подобно клешням рака:
Примерами таких комплексов служат оксалатный комплекс железа (III) [Fe(C 2 O 4 ) 3 ] 3- и этилендиаминовый комплекс платины (IV) - [PtEn 3 ] 4+ .
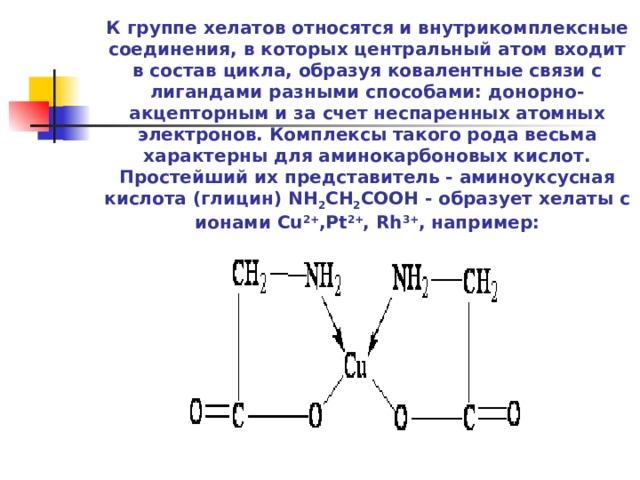
К группе хелатов относятся и внутрикомплексные соединения, в которых центральный атом входит в состав цикла, образуя ковалентные связи с лигандами разными способами: донорно-акцепторным и за счет неспаренных атомных электронов. Комплексы такого рода весьма характерны для аминокарбоновых кислот. Простейший их представитель - аминоуксусная кислота (глицин) NH 2 CH 2 COOH - образует хелаты с ионами Cu 2+ ,Pt 2+ , Rh 3+ , например:
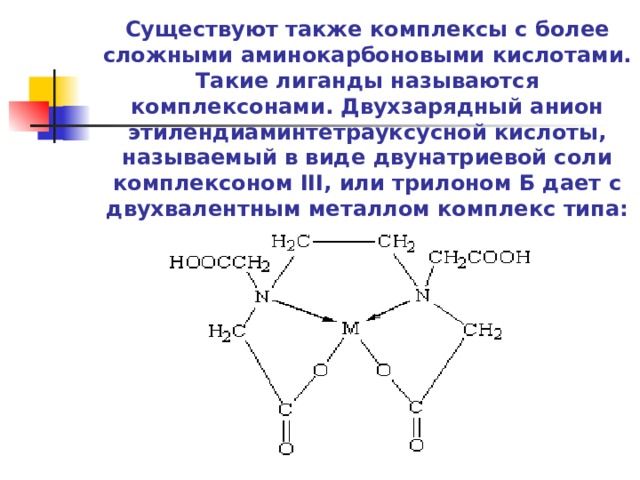
Существуют также комплексы с более сложными аминокарбоновыми кислотами. Такие лиганды называются комплексонами. Двухзарядный анион этилендиаминтетрауксусной кислоты, называемый в виде двунатриевой соли комплексоном III, или трилоном Б дает с двухвалентным металлом комплекс типа:
![Номенклатура комплексных соединений Основы современной номенклатуры комплексных соединений были заложены Альфредом Вернером . До его работ в этой области химии не существовало никакой системы. Комплексные соединения называли, руководствуясь их внешним видом, происхождением или были названы в честь химиков , например: пурпуреосоль (красная соль) [Co(NH 3 ) 5 Cl]Cl 2 лутеосоль (желтая соль) состава [Co(NH 3 ) 6 ]Cl 3 красная кровяная соль K 3 [Fe(CN) 6 ] соль Фишера K 3 [Co(NO 2 ) 6 ] соль Рейнеке NH 4 [Cr(NH 3 ) 2 (NCS) 4 ] и др.](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img21.jpg)
Номенклатура комплексных соединений
Основы современной номенклатуры комплексных соединений были заложены Альфредом Вернером . До его работ в этой области химии не существовало никакой системы. Комплексные соединения называли, руководствуясь их внешним видом, происхождением или были названы в честь химиков , например:
пурпуреосоль (красная соль) [Co(NH 3 ) 5 Cl]Cl 2
лутеосоль (желтая соль) состава [Co(NH 3 ) 6 ]Cl 3
красная кровяная соль K 3 [Fe(CN) 6 ]
соль Фишера K 3 [Co(NO 2 ) 6 ]
соль Рейнеке NH 4 [Cr(NH 3 ) 2 (NCS) 4 ] и др.

Номенклатура комплексных соединений
Современная номенклатура комплексных соединений основана на рекомендациях ИЮПАК (Международный союз общей и прикладной химии) и адаптирована к традициям русского химического языка.
Название комплексного соединения строится также, как и название
любой соли. Первым называют анион, затем катион, при этом используются следующие названия лигандов:
H 2 O – аква
CO – карбонил
Cl - – хлоро
SO 4 2- – сульфато
NH 3 – аммин
Br - – бромо
OH - – гидроксо
NO – нитрозил
CO 3 2- – карбонато
NO 2 - – нитро
H - – гидридо
CN - – циано
O 2- – оксо
NO - – нитрозо
NCS - – тиоцианато
H + – гидро
![а) Катионогенный комплекс название аниона + греческий числитель + название лиганда + русское название металла + валентность металла (если она переменная) [Cu(NH 3 ) 4 ]SO 4 – сульфат тетроамминмеди (II) [Al(H 2 O) 6 ]Cl 3 – хлорид гексоакваалюминия [Co(NH 3 ) 3 H 2 OCl 2 ]NO 3 – нитрат аквадихлоротриамминкобальта (III)](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img23.jpg)
а) Катионогенный комплекс название аниона + греческий числитель + название лиганда + русское название металла + валентность металла (если она переменная)
- [Cu(NH 3 ) 4 ]SO 4 – сульфат тетроамминмеди (II)
- [Al(H 2 O) 6 ]Cl 3 – хлорид гексоакваалюминия
- [Co(NH 3 ) 3 H 2 OCl 2 ]NO 3 – нитрат аквадихлоротриамминкобальта (III)

б) Анионогенный комплекс Греческий числитель + название лиганда + латинское название металла + суффикс "ат" + валентность комплексообразователя + название металла (катиона)
- K 3 [Fe(CN) 6 ] – гексоцианоферрат (III) калия
- K 2 [HgI 4 ] – тетройодомеркурат (II) калия
- Na[Ag(CN) 2 ] – дицианоаргентат натрия
- (NH 4 ) 2 [PtCl 6 ] – гексохлорорлатинат (IV) аммония
![в) Нейтральный комплекс греческий числитель + название лиганда + русское название металла + валентность металла [Zn(NH 3 ) 4 Cl 2 ] – дихлоротетроамминцинк [Co(NH 3 )Cl 3 ] – амминтрихлорокобальт (III) [Pt(NH 3 ) 2 Br 2 ] – дибромодиаммин платина (II)](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img25.jpg)
в) Нейтральный комплекс греческий числитель + название лиганда + русское название металла + валентность металла
- [Zn(NH 3 ) 4 Cl 2 ] – дихлоротетроамминцинк
- [Co(NH 3 )Cl 3 ] – амминтрихлорокобальт (III)
- [Pt(NH 3 ) 2 Br 2 ] – дибромодиаммин платина (II)

Химические свойства комплексных соединений
- 1. Комплексные соединения можно условно разделить на две большие группы: электролиты и неэлектролиты . К неэлектролитам относят прежде всего внутрикомплексные соединения (или хелаты ) и затем – карбонилы металлов, некоторые другие.
Растворимые комплексные соединения, не имеющие внешней сферы, ведут себя в растворах как слабые электролиты.
Комплексные соединения, имеющие ионную внешнюю сферу, в растворе подвергаются диссоциации на комплексный ион и ионы внешней сферы . Они ведут себя в разбавленных растворах как сильные электролиты : диссоциация протекает моментально и практически нацело. Примеры такого рода:
 2 = [Cu(NH 3 ) 4 ] 2+ + 2 OH - [Ni(NH 3 ) 6 ] 2 [Fe(CN) 6 ] = 2 [Ni(NH 3 ) 6 ] 2+ + [Fe(CN) 6 ] 4-](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img27.jpg)
Химические свойства комплексных соединений
[Cu(NH 3 ) 4 ](OH) 2 = [Cu(NH 3 ) 4 ] 2+ + 2 OH -
[Ni(NH 3 ) 6 ] 2 [Fe(CN) 6 ] = 2 [Ni(NH 3 ) 6 ] 2+ + [Fe(CN) 6 ] 4-
![Химические свойства комплексных соединений 2. При действии сильных кислот происходит разрушение гидроксокомплексов, например: а) при недостатке кислоты Na 3 [Al(OH) 6 ] + 3HCl = 3NaCl + Al(OH) 3 + 3H 2 O б) при избытке кислоты Na 3 [Al(OH) 6 ] + 6HCl = 3NaCl + AlCl 3 + 6H 2 O.](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img28.jpg)
Химические свойства комплексных соединений
- 2. При действии сильных кислот происходит разрушение гидроксокомплексов, например:
- а) при недостатке кислоты
Na 3 [Al(OH) 6 ] + 3HCl = 3NaCl + Al(OH) 3 + 3H 2 O
Na 3 [Al(OH) 6 ] + 6HCl = 3NaCl + AlCl 3 + 6H 2 O.
![Химические свойства комплексных соединений Гидроксокомплексы устойчивы только в сильнощелочных растворах. В нейтральной , а тем более в кислой среде, а также при нагревании растворов они разрушаются : [Al(OH) 4 ] - + CO 2 = Al(OH) 3 + HCO 3 - [Be(OH) 4 ] 2- + 2NH 4 + = Be(OH) 2 + 2NH 3 . H 2 O [Zn(OH) 4 ] 2- + 4 H 3 O + = [Zn(H 2 O) 4 ] 2+ + 4 H 2 O Na[Al(OH) 4 ] = NaAlO 2 + 2 H 2 O (при нагревании)](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img29.jpg)
Химические свойства комплексных соединений
- Гидроксокомплексы устойчивы только в сильнощелочных растворах. В нейтральной , а тем более в кислой среде, а также при нагревании растворов они разрушаются :
- [Al(OH) 4 ] - + CO 2 = Al(OH) 3 + HCO 3 -
- [Be(OH) 4 ] 2- + 2NH 4 + = Be(OH) 2 + 2NH 3 . H 2 O
- [Zn(OH) 4 ] 2- + 4 H 3 O + = [Zn(H 2 O) 4 ] 2+ + 4 H 2 O
- Na[Al(OH) 4 ] = NaAlO 2 + 2 H 2 O (при нагревании)
![Химические свойства комплексных соединений Некоторые гидроксокомплексы можно использовать в качестве реагентов для идентификации отдельных ионов в растворе. Например, определение присутствия катиона Na + иногда ведут, выделяя малорастворимый гексагидроксостибат(V) натрия Na[Sb(OH) 6 ] в виде мелкокристаллического белого осадка по реакции: Na + + [Sb(OH) 6 ] - = Na[Sb(OH) 6 ]](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img30.jpg)
Химические свойства комплексных соединений
- Некоторые гидроксокомплексы можно использовать в качестве реагентов для идентификации отдельных ионов в растворе. Например, определение присутствия катиона Na + иногда ведут, выделяя малорастворимый гексагидроксостибат(V) натрия Na[Sb(OH) 6 ] в виде мелкокристаллического белого осадка по реакции:
Na + + [Sb(OH) 6 ] - = Na[Sb(OH) 6 ]
![Химические свойства комплексных соединений 3. Нагревание (термолиз) всех аммиакатов приводит к их разложению. Аммиакаты разрушаются при любых воздействиях, которые удаляют (при нагревании) или разрушают (действием окислителя) молекулу аммиака , переводят аммиак в кислотной среде в катион аммония (катион аммония не содержит неподеленных пар электронов и поэтому не может выполнять функции лиганда), либо связывают центральный атом комплекса, например, в виде малорастворимого осадка: [Ni(NH 3 ) 6 ]Cl 2 = NiCl 2 + 6 NH 3 (г) [Cu(NH 3 ) 4 ]SO 4 + 6 Br 2 = CuSO 4 + 12 HBr + 2 N 2 (г) [Ni(NH 3 ) 6 ]SO 4 + 3 H 2 SO 4 = NiSO 4 + 3 (NH 4 ) 2 SO 4 [Cu(NH 3 ) 4 ](OH) 2 + Na 2 S + 4 H 2 O = CuS+ 2 NaOH + 4 NH 3 . H 2 O](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img31.jpg)
Химические свойства комплексных соединений
- 3. Нагревание (термолиз) всех аммиакатов приводит к их разложению.
Аммиакаты разрушаются при любых воздействиях, которые удаляют (при нагревании) или разрушают (действием окислителя) молекулу аммиака , переводят аммиак в кислотной среде в катион аммония (катион аммония не содержит неподеленных пар электронов и поэтому не может выполнять функции лиганда), либо связывают центральный атом комплекса, например, в виде малорастворимого осадка:
[Ni(NH 3 ) 6 ]Cl 2 = NiCl 2 + 6 NH 3 (г)
[Cu(NH 3 ) 4 ]SO 4 + 6 Br 2 = CuSO 4 + 12 HBr + 2 N 2 (г)
[Ni(NH 3 ) 6 ]SO 4 + 3 H 2 SO 4 = NiSO 4 + 3 (NH 4 ) 2 SO 4
[Cu(NH 3 ) 4 ](OH) 2 + Na 2 S + 4 H 2 O = CuS+ 2 NaOH + 4 NH 3 . H 2 O
![Образование комплексных соединений При добавлении водного раствора аммиака к белому осадку хлорида серебра(I) образуется бесцветный устойчивый ион диамминсеребра(I), при этом осадок AgCl растворяется : AgCl(т) + 2 NH 3 . H 2 O = [Ag(NH 3 ) 2 ] + + Cl - + 2H 2 O Голубой осадок гидроксида меди(II) под действием водного раствора аммиака также переходит в растворимое комплексное соединение синего цвета: Cu(OH) 2 + 4 NH 3 . H 2 O =[Cu(NH 3 ) 4 ] 2+ + 2 OH - + 4 H 2 O](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img32.jpg)
Образование комплексных соединений
- При добавлении водного раствора аммиака к белому осадку хлорида серебра(I) образуется бесцветный устойчивый ион диамминсеребра(I), при этом осадок AgCl растворяется :
AgCl(т) + 2 NH 3 . H 2 O = [Ag(NH 3 ) 2 ] + + Cl - + 2H 2 O
- Голубой осадок гидроксида меди(II) под действием водного раствора аммиака также переходит в растворимое комплексное соединение синего цвета:
Cu(OH) 2 + 4 NH 3 . H 2 O =[Cu(NH 3 ) 4 ] 2+ + 2 OH - + 4 H 2 O
![Образование комплексных соединений Аммиачные комплексы обычно получают при взаимодействии солей или гидроксидов металлов с аммиаком в водных или неводных растворах , либо обработкой тех же солей в кристаллическом состоянии газообразным аммиаком : AgCl(т) + 2 NH 3 . H 2 O = [Ag(NH 3 ) 2 ]Cl + 2 H 2 O Cu(OH) 2 (т) + 4 NH 3 . H 2 O = [Cu(NH 3 ) 4 ](OH) 2 + 4 H 2 O NiSO 4 + 6 NH 3 . H 2 O = [Ni(NH 3 ) 6 ]SO 4 + 6 H 2 O CoCl 2 + 6 NH 3 (г) = [Co(NH 3 ) 6 ]Cl 2](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img33.jpg)
Образование комплексных соединений
- Аммиачные комплексы обычно получают при взаимодействии солей или гидроксидов металлов с аммиаком в водных или неводных растворах , либо обработкой тех же солей в кристаллическом состоянии газообразным аммиаком :
AgCl(т) + 2 NH 3 . H 2 O = [Ag(NH 3 ) 2 ]Cl + 2 H 2 O
Cu(OH) 2 (т) + 4 NH 3 . H 2 O = [Cu(NH 3 ) 4 ](OH) 2 + 4 H 2 O
NiSO 4 + 6 NH 3 . H 2 O = [Ni(NH 3 ) 6 ]SO 4 + 6 H 2 O
CoCl 2 + 6 NH 3 (г) = [Co(NH 3 ) 6 ]Cl 2
![Образование комплексных соединений Получение ацидокоплексов. Например дитиосульфатоаргентат(I)-ион получается по обменной реакции: Ag + + 2 SO 3 S 2- = [Ag(SO 3 S) 2 ] 3- и гексанитрокобальтат(III)-ион, который осаждается в виде мелких желтых кристаллов калиевой соли при смешивании растворов, содержащих хлорид кобальта(II), нитрит калия и уксусную кислоту: CoCl 2 + 7 KNO 2 + 2 CH 3 COOH = = K 3 [Co(NO 2 ) 6 ] + NO + 2 KCl + 2 CH 3 COOK + H 2 O В этой окислительно-восстановительной реакции происходит изменение степени окисления кобальта от +II до +III. Эта реакция используется для определения примеси калия в солях натрия.](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img34.jpg)
Образование комплексных соединений
- Получение ацидокоплексов.
Например дитиосульфатоаргентат(I)-ион получается по обменной реакции:
Ag + + 2 SO 3 S 2- = [Ag(SO 3 S) 2 ] 3-
и гексанитрокобальтат(III)-ион, который осаждается в виде мелких желтых кристаллов калиевой соли при смешивании растворов, содержащих хлорид кобальта(II), нитрит калия и уксусную кислоту:
CoCl 2 + 7 KNO 2 + 2 CH 3 COOH = = K 3 [Co(NO 2 ) 6 ] + NO + 2 KCl + 2 CH 3 COOK + H 2 O
В этой окислительно-восстановительной реакции происходит изменение степени окисления кобальта от +II до +III. Эта реакция используется для определения примеси калия в солях натрия.
![Образование комплексных соединений Платина химически растворяется в смеси концентрированных азотной и соляной кислот (так называемой “царской водке”) с образованием гексахлороплатината(IV) водорода H 2 [PtCl 6 ]: 3 Pt + 4 HNO 3 + 18 HCl = 3 H 2 [PtCl 6 ] + 4 NO + 8 H 2 O Гексахлороплатинат(IV) водорода был первым реагентом, с применения которого началась аналитическая химия калия, рубидия и цезия, поскольку гексахлороплатинаты(IV) этих элементов K 2 [PtCl 6 ], Rb 2 [PtCl 6 ] и Cs 2 [PtCl 6 ] малорастворимы в воде.](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img35.jpg)
Образование комплексных соединений
Платина химически растворяется в смеси концентрированных азотной и соляной кислот (так называемой “царской водке”) с образованием гексахлороплатината(IV) водорода H 2 [PtCl 6 ]:
3 Pt + 4 HNO 3 + 18 HCl = 3 H 2 [PtCl 6 ] + 4 NO + 8 H 2 O
Гексахлороплатинат(IV) водорода был первым реагентом, с применения которого началась аналитическая химия калия, рубидия и цезия, поскольку гексахлороплатинаты(IV) этих элементов K 2 [PtCl 6 ], Rb 2 [PtCl 6 ] и Cs 2 [PtCl 6 ] малорастворимы в воде.
![Образование комплексных соединений Гексацианоферрат(II) калия образуется по реакции: 6 KCN + FeSO 4 = K 4 [Fe(CN) 6 ] + K 2 SO 4 Из водного раствора гексацианоферрат(II) калия выделяется в виде желтых кристаллов состава K 4 [Fe(CN) 6 ] . 3 H 2 O. Это соединение широко используется в аналитической практике для определения присутствия в образцах катионов железа(III): [Fe(H 2 O) 6 ] 3+ + K + + [Fe(CN) 6 ] 4- = KFe[Fe(CN) 6 ] + 6 H 2 O Продуктом этой реакции является малорастворимый гексацианоферрат(II) железа(III)-калия KFe[Fe(CN) 6 ] ярко-синего цвета.](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img36.jpg)
Образование комплексных соединений
- Гексацианоферрат(II) калия образуется по реакции:
6 KCN + FeSO 4 = K 4 [Fe(CN) 6 ] + K 2 SO 4
- Из водного раствора гексацианоферрат(II) калия выделяется в виде желтых кристаллов состава K 4 [Fe(CN) 6 ] . 3 H 2 O. Это соединение широко используется в аналитической практике для определения присутствия в образцах катионов железа(III):
[Fe(H 2 O) 6 ] 3+ + K + + [Fe(CN) 6 ] 4- = KFe[Fe(CN) 6 ] + 6 H 2 O
- Продуктом этой реакции является малорастворимый гексацианоферрат(II) железа(III)-калия KFe[Fe(CN) 6 ] ярко-синего цвета.
![Образование комплексных соединений Хелатные комплексы. Например, a-аминоуксусная кислота ( глицин ) может реагировать с гидроксидом меди с образованием сине-фиолетового прочного комплекса, растворимого в воде: Cu(OH) 2 + 2 NH 2 CH 2 COOH = [Cu(NH 2 CH 2 COO) 2 ] + 2 H 2 O Лиганд NH 2 CH 2 COO - (глицинат-ион) относят к категории бидентатных лигандов, образующих две химические связи с комплексообразователем – через атом кислорода карбоксильной группы и через атом азота аминогруппы:](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img37.jpg)
Образование комплексных соединений
Например, a-аминоуксусная кислота ( глицин ) может реагировать с гидроксидом меди с образованием сине-фиолетового прочного комплекса, растворимого в воде:
Cu(OH) 2 + 2 NH 2 CH 2 COOH = [Cu(NH 2 CH 2 COO) 2 ] + 2 H 2 O
Лиганд NH 2 CH 2 COO - (глицинат-ион) относят к категории бидентатных лигандов, образующих две химические связи с комплексообразователем – через атом кислорода карбоксильной группы и через атом азота аминогруппы:
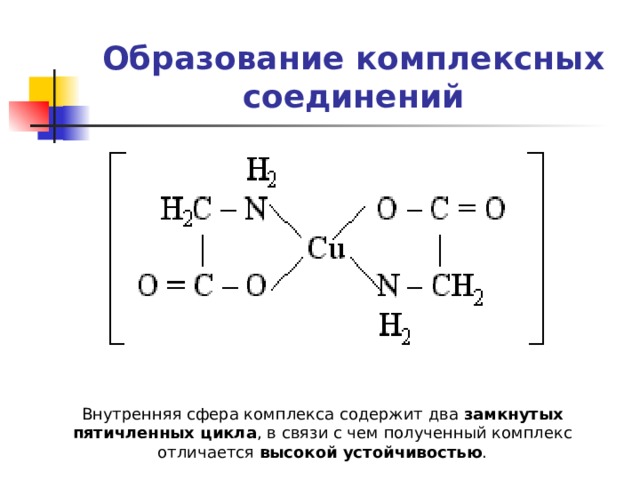
Образование комплексных соединений
Внутренняя сфера комплекса содержит два замкнутых пятичленных цикла , в связи с чем полученный комплекс отличается высокой устойчивостью .

Выполните задания:
- 1.В следующих комплексных соединениях укажите центральный атом, лиганды, внутреннюю и внешнюю сферы; определите заряд комплексной частицы, степень окисления центрального атома и его координационное число. Назовите эти соединения и укажите к какому типу комплексных соединений оно относится.
 2 [Pt(NH 3 ) 5 (OH)]Br 3 [Cr(CO) 6 ] K[Au(CN) 2 Cl 2 ] Ca[Cr(NH 3 ) 2 (NCS) 4 ] 2 [Cr(H 2 O) 6 ]Cl 3](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img40.jpg)
1.В следующих комплексных соединениях укажите центральный атом, лиганды, внутреннюю и внешнюю сферы; определите заряд комплексной частицы, степень окисления центрального атома и его координационное число. Назовите эти соединения и укажите к какому типу комплексных соединений оно относится.
- Ca[Cr(NH 3 ) 2 (NCS) 4 ] 2
![1.В следующих комплексных соединениях укажите центральный атом, лиганды, внутреннюю и внешнюю сферы; определите заряд комплексной частицы, степень окисления центрального атома и его координационное число. Назовите эти соединения и укажите к какому ипу комплексных соединений оно относится. [Al(H 2 O) 6 ] 2 (SO 4 ) 3 Na 3 [FeF 6 ]; [Cu(NH 3 ) 4 Cl(NO 2 )] Na[Sb(OH) 6 ] [Co(H 2 O)(NH 3 ) 4 Cl]Cl 2 [Ti(H 2 O) 6 ]Cl 3](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img41.jpg)
1.В следующих комплексных соединениях укажите центральный атом, лиганды, внутреннюю и внешнюю сферы; определите заряд комплексной частицы, степень окисления центрального атома и его координационное число. Назовите эти соединения и укажите к какому ипу комплексных соединений оно относится.
- [Al(H 2 O) 6 ] 2 (SO 4 ) 3
- [Co(H 2 O)(NH 3 ) 4 Cl]Cl 2

2.Составьте формулы следующих комплексных соединений:
гексахлоропалладат(IV) аммония
дихлороаргентат(I) цезия
сульфат дихлоротетраамминкобальта(III)
гексакарбонилхром
хлорид нитропентаамминкобальта(III)

3. Рассмотрите возможность электролитической диссоциации в водном растворе комплексных соединений:
гидроксид диамминсеребра(I)
тетрахлороплатинат(II) калия
гексацианоферрат(III) калия
тетрагидроксоцинкат(II) натрия

Похищение золота
- В 1848 г. с одного уральского прииска стало исчезать золото. Это обнаружилось зимой, вскоре после того, как туда завезли банки с цианидом натрия, чтобы травить крыс. Все попытки найти похитителя не увенчались успехом. Охранники тщательно проверили даже вывозимый с прииска мусор, но там, пожалуй, не было ничего подозрительного кроме бутылей с отработанной кислотой. Найти вора помогла случайность. На скользкой улице поселка старателей сани управляющего задели работника «пробирной лаборатории», и тот выронил саквояж. Что-то разбилось, повалил дым... Наутро около дома владельца саквояжа нашли пустые бутыли с надписью "отработанная кислота", а в погребе обнаружили целую лабораторию: коробки с цинковой пылью, склянки с соляной кислотой, колбы, воронки и даже... золотой порошок, упакованный и подготовленный к отправке на черный рынок. Эксперт-химик уличил вора. На чем были основаны выводы эксперта?

Похищение золота

«Закомплексованный» йод

«Закомплексованный» йод

Секрет Якоба Вайца

Секрет Якоба Вайца
«Симпатические чернила» Якоба Вайца — это растворы хлорида кобальта(II). Надпись, сделанная таким раствором, не будет заметна: хлорид гексааквакобальта бледно-розового цвета. Если его подогреть, комплекс изменяет состав и превращается в синий дихлородиаквакобальт
. Подышав на листок или подержав его над паром, можно увлажнить бумагу, и изображение снова пропадет.

Значение комплексных соединений
- Координационные соединения имеют исключительно большое значение в природе. Достаточно сказать, что почти все ферменты, многие гормоны, лекарства, биологически активные вещества представляют собой комплексные соединения. Например, гемоглобин крови, благодаря которому осуществляется перенос кислорода от легких к клеткам ткани, является комплексным соединением, содержащим железо, а хлорофилл, ответственный за фотосинтез в растениях, – комплексным соединением магния.
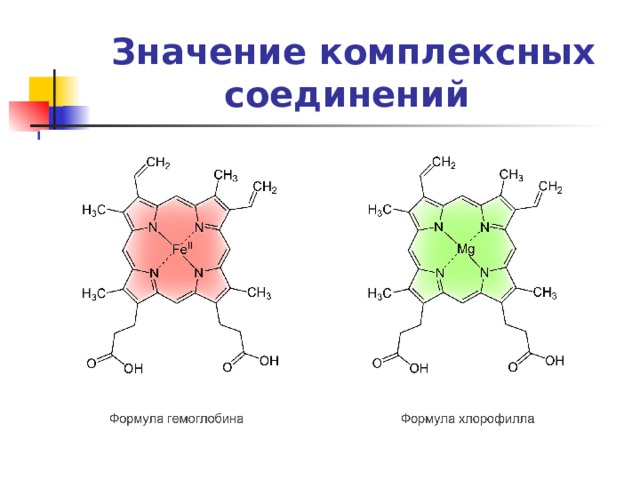
Значение комплексных соединений
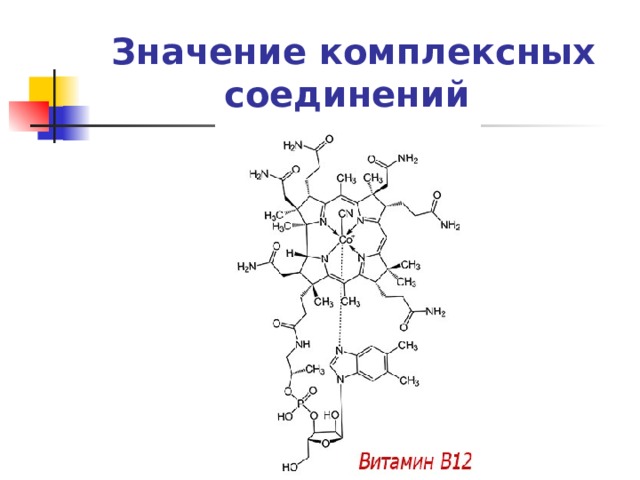
Значение комплексных соединений
![Значение комплексных соединений Значительную часть природных минералов, в том числе полиметаллических руд и силикатов, также составляют координационные соединения. Более того, химические методы извлечения металлов из руд, в частности меди, вольфрама, серебра, алюминия, платины, железа, золота и других, также связаны с образованием легкорастворимых, легкоплавких или летучих комплексов. Например: Na 3 [AlF 6 ] – криолит, KNa 3 [AlSiO 4 ] 4 – нефелин (минералы, комплексные соединения, содержащие алюминий).](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img53.jpg)
Значение комплексных соединений
- Значительную часть природных минералов, в том числе полиметаллических руд и силикатов, также составляют координационные соединения. Более того, химические методы извлечения металлов из руд, в частности меди, вольфрама, серебра, алюминия, платины, железа, золота и других, также связаны с образованием легкорастворимых, легкоплавких или летучих комплексов. Например: Na 3 [AlF 6 ] – криолит, KNa 3 [AlSiO 4 ] 4 – нефелин (минералы, комплексные соединения, содержащие алюминий).

- Современная химическая отрасль промышленности широко использует координационные соединения как катализаторы при синтезе высокомолекулярных соединений, при химической переработке нефти, в производстве кислот.

Написать уравнения реакций, при помощи которых можно осуществить превращения:

Изомерия комплексных соединений
- Среди комплексных соединений, так же как и в органической химии, широко распространено явление изомерии . Под изомерией понимают способность веществ образовывать несколько соединений одинакового состава, отличающихся взаимным расположением атомов в молекуле, а следовательно, различных по свойствам.
У комплексных соединений явление изомерии обусловлено:
- различиями в строении и координации лигандов
- различиями в строении внутренней координационной сферы
- разным распределением частиц между внутренней и внешней сферой. Основные виды изомерии комплексных соединений – гидратная, ионная, изомерия лигандов и геометрическая.

1. Гидратная изомерия
- Гидратные изомеры - это вещества имеющие одинаковый состав, но различную по функциям
( по характеру связи) молекулу воды).
- Заключается в различном распределении молекул растворителя между внутренней и внешней сферами комплексного соединения, в различном характере химической связи молекул воды с комплексообразователем.
- Классическим примером гидратной изомерии является существование трех изомерных гидратов хлорида хрома(III) с общей формулой CrCl 3 . 6 H 2 O.
![1. Гидратная изомерия Первый изомер , [Cr(H 2 O) 6 ]Cl 3 – хлорид гексааквахрома(III) – представляет собой кристаллы серо-сиреневого цвета, которые при растворении в воде образуют фиолетовый раствор. Такую окраску раствору придают катионы [Cr(H 2 O) 6 ] 3+ . Из раствора под действием ионов Ag + осаждаются все три хлорид-аниона: [Cr(H 2 O) 6 ]Cl 3 + 3 AgNO 3 = [Cr(H 2 O) 6 ](NO 3 ) 3 + 3 AgCl¯](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img58.jpg)
1. Гидратная изомерия
- Первый изомер , [Cr(H 2 O) 6 ]Cl 3 – хлорид гексааквахрома(III) – представляет собой кристаллы серо-сиреневого цвета, которые при растворении в воде образуют фиолетовый раствор. Такую окраску раствору придают катионы [Cr(H 2 O) 6 ] 3+ . Из раствора под действием ионов Ag + осаждаются все три хлорид-аниона:
- [Cr(H 2 O) 6 ]Cl 3 + 3 AgNO 3 = [Cr(H 2 O) 6 ](NO 3 ) 3 + 3 AgCl¯
![1. Гидратная изомерия Второй изомер – [Cr(H 2 O) 5 Cl]Cl 2 . H 2 O, моногидрат хлорида хлоропентааквахрома(III), придает раствору голубовато-зеленый цвет, а ионы Ag + осаждают только два хлорид-иона: [Cr(H 2 O) 5 Cl]Cl 2 + 2 AgNO 3 = [Cr(H 2 O) 5 Cl](NO 3 ) 2 + 2 AgCl¯ Т ретий изомер – [Cr(H 2 O) 4 Cl 2 ]Cl . 2 H 2 O, дигидрат хлорида дихлоротетрааквахрома(III), окрашивает раствор в темно-зеленый цвет, а ионы Ag + осаждают из его раствора только один хлорид-ион: [Cr(H 2 O) 4 Cl 2 ]Cl + AgNO 3 = [Cr(H 2 O) 4 Cl 2 ]NO 3 + AgCl¯](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img59.jpg)
1. Гидратная изомерия
- Второй изомер – [Cr(H 2 O) 5 Cl]Cl 2 . H 2 O, моногидрат хлорида хлоропентааквахрома(III), придает раствору голубовато-зеленый цвет, а ионы Ag + осаждают только два хлорид-иона:
[Cr(H 2 O) 5 Cl]Cl 2 + 2 AgNO 3 = [Cr(H 2 O) 5 Cl](NO 3 ) 2 + 2 AgCl¯
- Т ретий изомер – [Cr(H 2 O) 4 Cl 2 ]Cl . 2 H 2 O, дигидрат хлорида дихлоротетрааквахрома(III), окрашивает раствор в темно-зеленый цвет, а ионы Ag + осаждают из его раствора только один хлорид-ион:
- [Cr(H 2 O) 4 Cl 2 ]Cl + AgNO 3 = [Cr(H 2 O) 4 Cl 2 ]NO 3 + AgCl¯
![2. Ионная изомерия. Связана с различным распределением заряженных лигандов между внешней и внутренней сферами комплексного соединения. Ионные изомеры по-разному диссоциируют в водном растворе. Так, нитрат дихлоротетраамминкобальта(III) [Co(NH 3 ) 4 Cl 2 ]NO 3 при растворении в воде диссоциирует на ионы: [Co(NH 3 ) 4 Cl 2 ]NO 3 = [Co(NH 3 ) 4 Cl 2 ] + + NO 3 - При добавлении к такому раствору AgNO 3 осадка хлорида серебра не образуется. Ионный изомер упомянутого выше комплекса, хлорид нитратохлоротетраамминкобальта(III) [Co(NH 3 ) 4 Cl(NO 3 )]Cl, при растворении в воде диссоцирует иначе: [Co(NH 3 ) 4 Cl(NO 3 )]Cl = [Co(NH 3 ) 4 Cl(NO 3 )] + + Cl - Из этого раствора при добавлении AgNO 3 выделяется осадок AgCl.](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img60.jpg)
2. Ионная изомерия.
- Связана с различным распределением заряженных лигандов между внешней и внутренней сферами комплексного соединения.
- Ионные изомеры по-разному диссоциируют в водном растворе. Так, нитрат дихлоротетраамминкобальта(III) [Co(NH 3 ) 4 Cl 2 ]NO 3 при растворении в воде диссоциирует на ионы:
[Co(NH 3 ) 4 Cl 2 ]NO 3 = [Co(NH 3 ) 4 Cl 2 ] + + NO 3 -
- При добавлении к такому раствору AgNO 3 осадка хлорида серебра не образуется. Ионный изомер упомянутого выше комплекса, хлорид нитратохлоротетраамминкобальта(III) [Co(NH 3 ) 4 Cl(NO 3 )]Cl, при растворении в воде диссоцирует иначе:
[Co(NH 3 ) 4 Cl(NO 3 )]Cl = [Co(NH 3 ) 4 Cl(NO 3 )] + + Cl -
- Из этого раствора при добавлении AgNO 3 выделяется осадок AgCl.
![3. Изомерия лигандов Изомерия лигандов подразделяется на связевую (которая определяется разным типом координации одного и того же лиганда), и собственно изомерию лиганда. Примерами связевой изомерии может служить существование нитро- и нитрито-комплексов кобальта(III) состава K 3 [Co(NO 2 ) 6 ] и K 3 [Co(ONO) 6 ], в которых координация лиганда NO 2 - осуществляется, соответственно, через атом азота или атом кислорода. Другой пример – координация тиоцианат-иона NCS - через атом азота или через атом серы, с образованием тиоцианато-N- или тиоцианато-S-комплексов. Кроме того, лиганды сложного строения (например, аминокислоты) могут сами по себе образовывать изомеры, координация которых ведет к образованию комплексов одинакового состава с разными свойствами.](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img61.jpg)
3. Изомерия лигандов
- Изомерия лигандов подразделяется на связевую (которая определяется разным типом координации одного и того же лиганда), и собственно изомерию лиганда.
- Примерами связевой изомерии может служить существование нитро- и нитрито-комплексов кобальта(III) состава K 3 [Co(NO 2 ) 6 ] и K 3 [Co(ONO) 6 ], в которых координация лиганда NO 2 - осуществляется, соответственно, через атом азота или атом кислорода. Другой пример – координация тиоцианат-иона NCS - через атом азота или через атом серы, с образованием тиоцианато-N- или тиоцианато-S-комплексов.
- Кроме того, лиганды сложного строения (например, аминокислоты) могут сами по себе образовывать изомеры, координация которых ведет к образованию комплексов одинакового состава с разными свойствами.

4. Геометрическая изомерия.
- Геометрическая изомерия вызвана неодинаковым размещением лигандов во внутренней сфере относительно друг друга. Необходимым условием геометрической изомерии является наличие во внутренней координационной сфере не менее двух различных лигандов. Геометрическая изомерия проявляется преимущественно у комплексных соединений, имеющих октаэдрическое строение, строение плоского квадрата или квадратной пирамиды.
- Комплексы, имеющие строение плоского квадрата, при наличии двух разных лигандов уже могут иметь два изомера ( цис- и транс- ):
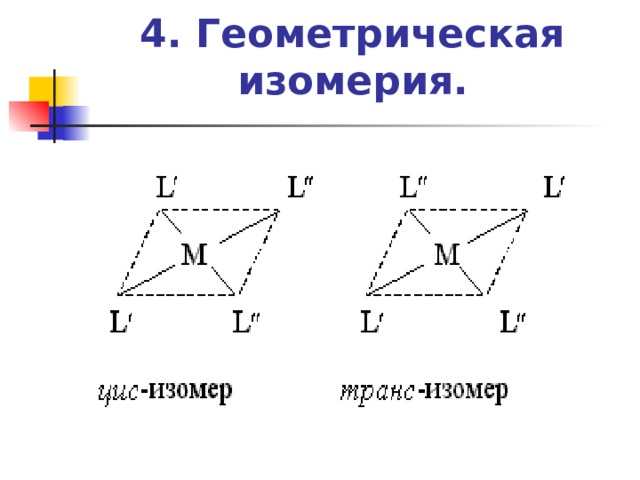
4. Геометрическая изомерия.
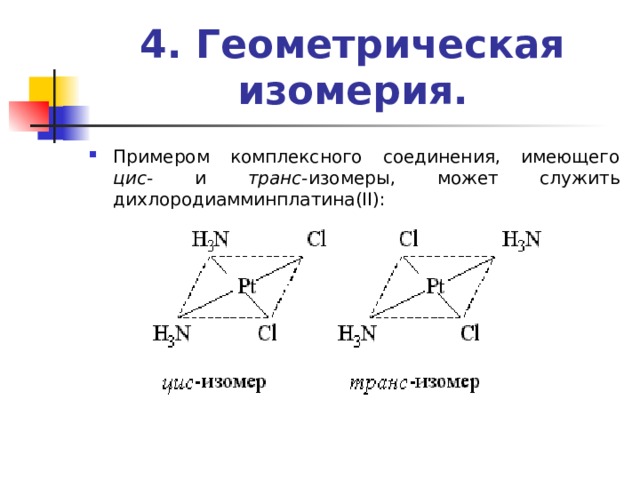
4. Геометрическая изомерия.
- Примером комплексного соединения, имеющего цис - и транс -изомеры, может служить дихлородиамминплатина(II):
![4. Геометрическая изомерия. Например, катион дигидроксотетраамминкобальта(III) [Co(NH 3 ) 4 (OH) 2 ] + имеет два изомера:](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img65.jpg)
4. Геометрическая изомерия.
- Например, катион дигидроксотетраамминкобальта(III) [Co(NH 3 ) 4 (OH) 2 ] + имеет два изомера:
![5. Оптическая изомерия Оптическая изомерия связана со способностью некоторых комплексных соединений существовать в виде двух форм, не совмещаемых в трехмерном пространстве и являющихся зеркальным отображением друг друга, как левая рука и правая. Поэтому оптическую изомерию называют иногда еще зеркальной изомерией . Например, темно-зеленые кристаллы тригидрата триоксалатокобальтата(III) аммония (NH 4 ) 3 [Co( ox ) 3 ] . 3 H 2 O существуют в виде двух оптических изомеров, комплексный анион которых имеет октаэдрическое строение. Поскольку полное изображение бидентатного оксалатного лиганда неудобно, его часто обозначают в виде дуги, соединяющей вершины октаэдра:](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img66.jpg)
5. Оптическая изомерия
- Оптическая изомерия связана со способностью некоторых комплексных соединений существовать в виде двух форм, не совмещаемых в трехмерном пространстве и являющихся зеркальным отображением друг друга, как левая рука и правая. Поэтому оптическую изомерию называют иногда еще зеркальной изомерией .
- Например, темно-зеленые кристаллы тригидрата триоксалатокобальтата(III) аммония (NH 4 ) 3 [Co( ox ) 3 ] . 3 H 2 O существуют в виде двух оптических изомеров, комплексный анион которых имеет октаэдрическое строение. Поскольку полное изображение бидентатного оксалатного лиганда неудобно, его часто обозначают в виде дуги, соединяющей вершины октаэдра:
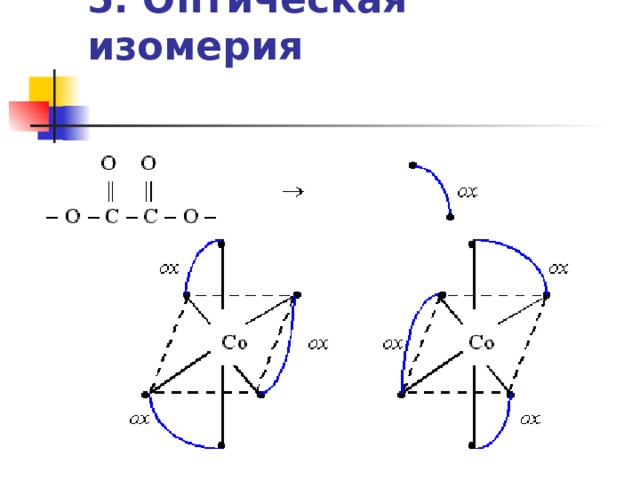
5. Оптическая изомерия
![5. Оптическая изомерия Как видно из схемы, расположение лигандов в оптических изомерах комплексного аниона [Co( ox ) 3 ] 3- таково, что анионы соотносятся между собой как предмет и его зеркальное изображение. Как бы мы не повернули анионы, их составные части никогда полностью не совпадут, так же как не совпадает левая рука с правой. Оптические изомеры отличаются тем, что их растворы способны вращать плоскость поляризации светового луча. Один изомер вращает плоскость поляризации влево и поэтому называется L -изомером, другой – вправо и называется D -изомером. Аналогичная система обозначений применяется для изомеров органических соединений.](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img68.jpg)
5. Оптическая изомерия
- Как видно из схемы, расположение лигандов в оптических изомерах комплексного аниона [Co( ox ) 3 ] 3- таково, что анионы соотносятся между собой как предмет и его зеркальное изображение. Как бы мы не повернули анионы, их составные части никогда полностью не совпадут, так же как не совпадает левая рука с правой.
- Оптические изомеры отличаются тем, что их растворы способны вращать плоскость поляризации светового луча. Один изомер вращает плоскость поляризации влево и поэтому называется L -изомером, другой – вправо и называется D -изомером. Аналогичная система обозначений применяется для изомеров органических соединений.
![Определите тип изомерии в наборах комплексных соединений: а) [Cr(H 2 O) 6 ]Cl 3 и [Cr(H 2 O) 5 Cl]Cl 2 . H 2 O](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img69.jpg)
Определите тип изомерии в наборах комплексных соединений:
- а) [Cr(H 2 O) 6 ]Cl 3 и [Cr(H 2 O) 5 Cl]Cl 2 . H 2 O
![Определите тип изомерии в наборах комплексных соединений: б) [Co(NH 3 ) 5 Br]SO 4 и [Co(NH 3 ) 5 SO 4 ]Br](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img70.jpg)
Определите тип изомерии в наборах комплексных соединений:
- б) [Co(NH 3 ) 5 Br]SO 4 и [Co(NH 3 ) 5 SO 4 ]Br
![Определите тип изомерии в наборах комплексных соединений: в) [Pt(NH 3 ) 5 Cl]Cl 3 и [Pt(NH 3 ) 4 (Cl) 2 ]Cl 2 . NH 3](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img71.jpg)
Определите тип изомерии в наборах комплексных соединений:
- в) [Pt(NH 3 ) 5 Cl]Cl 3 и [Pt(NH 3 ) 4 (Cl) 2 ]Cl 2 . NH 3









![Основные положения координационной теории А. Вернера 1. В составе комплексного соединения один из ионов или атомов является центральным, его называют комплексообразователем . Комплексообразователями могут быть d металлы. Na[Al(OH) 4 ]](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img2.jpg)





![Основные положения координационной теории А. Вернера 4 . Центральный атом комплексообразователь вместе с лигандами образует внутреннюю сферу, которую при написании заключают в квадратные скобки. Na[Al(OH) 4 ]](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img8.jpg)
![Основные положения координационной теории А. Вернера 5 . За квадратными скобками записываются ионы наиболее удаленные от центрального атома, они образуют внешнюю сферу комплекса. Na[Al(OH) 4 ]](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img9.jpg)
![Строение комплексных соединений Внешняя Внутренняя сфера сфера K 3 [Fe(CN) 6 ] Координационное число Ион- Комплексо- образователь Лиганды [Cu(NH 3 ) 4 ]Cl 2 Внутренняя сфера Внешняя сфера](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img10.jpg)

![Классификация комплексных соединений 1. По составу: а) Катионогенные (если внутренняя сфера расположена на первом месте); [Ag(NH 3 ) 2 ]OH](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img12.jpg)
![Классификация комплексных соединений б) Анионогенные (если внутренняя сфера расположена на втором месте); Na[Ag(CN) 2 ] Ca[Cr(NH 3 ) 2 (NCS) 4 ] 2](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img13.jpg)
![Классификация комплексных соединений в) Нейтральные ( если отсутствует внешняя сфера). [Cu(NH 3 ) 4 Cl(NO 2 )] [Cr(H 2 O) 3 (OH) 3 ]](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img14.jpg)
![Классификация комплексных соединений 2. По типу лигандов. а) Аквакомплексы – это комплексные катионы, в которых лигандами являются молекулы H 2 O. Их образуют катионы металлов со степенью окисления +2 и больше, причем способность к образованию аквакомплексов у металлов одной группы периодической системы уменьшается сверху вниз. Примеры аквакомплексов: [Al(H 2 O) 6 ]Cl 3 , [Cr(H 2 O) 6 ](NO 3 ) 3 .](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img15.jpg)
![Классификация комплексных соединений б) Гидроксокомплексы – это комплексные анионы, в которых лигандами являются гидроксид-ионы OH – . Комплексообразователями являются металлы, склонные к проявлению амфотерных свойств – Be, Zn, Al, Cr. Например: Na[Al(OH) 4 ], Ba[Zn(OH) 4 ]. в) Аммиакаты – это комплексные катионы, в которых лигандами являются молекулы NH 3 . Например: [Cu(NH 3 ) 4 ]SO 4 , [Ag(NH 3 ) 2 ]Cl.](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img16.jpg)
![Классификация комплексных соединений г) Ацидокомплексы – это комплексные анионы, в которых лигандами являются анионы неорганических и органических кислот. Например: K 3 [Al(C 2 O 4 ) 3 ], Na 2 [Zn(CN) 4 ], K 4 [Fe(CN) 6 ]. Между этими классами существуют переходные ряды, которые включают комплексы с различными и лигандами.](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img17.jpg)
![Циклические , или хелатные (клешневидные), комплексные соединения. Они содержат би- или полидентатный лиганд, который как бы захватывает центральный атом подобно клешням рака: Примерами таких комплексов служат оксалатный комплекс железа (III) [Fe(C 2 O 4 ) 3 ] 3- и этилендиаминовый комплекс платины (IV) - [PtEn 3 ] 4+ .](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img18.jpg)


![Номенклатура комплексных соединений Основы современной номенклатуры комплексных соединений были заложены Альфредом Вернером . До его работ в этой области химии не существовало никакой системы. Комплексные соединения называли, руководствуясь их внешним видом, происхождением или были названы в честь химиков , например: пурпуреосоль (красная соль) [Co(NH 3 ) 5 Cl]Cl 2 лутеосоль (желтая соль) состава [Co(NH 3 ) 6 ]Cl 3 красная кровяная соль K 3 [Fe(CN) 6 ] соль Фишера K 3 [Co(NO 2 ) 6 ] соль Рейнеке NH 4 [Cr(NH 3 ) 2 (NCS) 4 ] и др.](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img21.jpg)

![а) Катионогенный комплекс название аниона + греческий числитель + название лиганда + русское название металла + валентность металла (если она переменная) [Cu(NH 3 ) 4 ]SO 4 – сульфат тетроамминмеди (II) [Al(H 2 O) 6 ]Cl 3 – хлорид гексоакваалюминия [Co(NH 3 ) 3 H 2 OCl 2 ]NO 3 – нитрат аквадихлоротриамминкобальта (III)](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img23.jpg)

![в) Нейтральный комплекс греческий числитель + название лиганда + русское название металла + валентность металла [Zn(NH 3 ) 4 Cl 2 ] – дихлоротетроамминцинк [Co(NH 3 )Cl 3 ] – амминтрихлорокобальт (III) [Pt(NH 3 ) 2 Br 2 ] – дибромодиаммин платина (II)](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img25.jpg)

 2 = [Cu(NH 3 ) 4 ] 2+ + 2 OH - [Ni(NH 3 ) 6 ] 2 [Fe(CN) 6 ] = 2 [Ni(NH 3 ) 6 ] 2+ + [Fe(CN) 6 ] 4-](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img27.jpg)
![Химические свойства комплексных соединений 2. При действии сильных кислот происходит разрушение гидроксокомплексов, например: а) при недостатке кислоты Na 3 [Al(OH) 6 ] + 3HCl = 3NaCl + Al(OH) 3 + 3H 2 O б) при избытке кислоты Na 3 [Al(OH) 6 ] + 6HCl = 3NaCl + AlCl 3 + 6H 2 O.](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img28.jpg)
![Химические свойства комплексных соединений Гидроксокомплексы устойчивы только в сильнощелочных растворах. В нейтральной , а тем более в кислой среде, а также при нагревании растворов они разрушаются : [Al(OH) 4 ] - + CO 2 = Al(OH) 3 + HCO 3 - [Be(OH) 4 ] 2- + 2NH 4 + = Be(OH) 2 + 2NH 3 . H 2 O [Zn(OH) 4 ] 2- + 4 H 3 O + = [Zn(H 2 O) 4 ] 2+ + 4 H 2 O Na[Al(OH) 4 ] = NaAlO 2 + 2 H 2 O (при нагревании)](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img29.jpg)
![Химические свойства комплексных соединений Некоторые гидроксокомплексы можно использовать в качестве реагентов для идентификации отдельных ионов в растворе. Например, определение присутствия катиона Na + иногда ведут, выделяя малорастворимый гексагидроксостибат(V) натрия Na[Sb(OH) 6 ] в виде мелкокристаллического белого осадка по реакции: Na + + [Sb(OH) 6 ] - = Na[Sb(OH) 6 ]](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img30.jpg)
![Химические свойства комплексных соединений 3. Нагревание (термолиз) всех аммиакатов приводит к их разложению. Аммиакаты разрушаются при любых воздействиях, которые удаляют (при нагревании) или разрушают (действием окислителя) молекулу аммиака , переводят аммиак в кислотной среде в катион аммония (катион аммония не содержит неподеленных пар электронов и поэтому не может выполнять функции лиганда), либо связывают центральный атом комплекса, например, в виде малорастворимого осадка: [Ni(NH 3 ) 6 ]Cl 2 = NiCl 2 + 6 NH 3 (г) [Cu(NH 3 ) 4 ]SO 4 + 6 Br 2 = CuSO 4 + 12 HBr + 2 N 2 (г) [Ni(NH 3 ) 6 ]SO 4 + 3 H 2 SO 4 = NiSO 4 + 3 (NH 4 ) 2 SO 4 [Cu(NH 3 ) 4 ](OH) 2 + Na 2 S + 4 H 2 O = CuS+ 2 NaOH + 4 NH 3 . H 2 O](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img31.jpg)
![Образование комплексных соединений При добавлении водного раствора аммиака к белому осадку хлорида серебра(I) образуется бесцветный устойчивый ион диамминсеребра(I), при этом осадок AgCl растворяется : AgCl(т) + 2 NH 3 . H 2 O = [Ag(NH 3 ) 2 ] + + Cl - + 2H 2 O Голубой осадок гидроксида меди(II) под действием водного раствора аммиака также переходит в растворимое комплексное соединение синего цвета: Cu(OH) 2 + 4 NH 3 . H 2 O =[Cu(NH 3 ) 4 ] 2+ + 2 OH - + 4 H 2 O](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img32.jpg)
![Образование комплексных соединений Аммиачные комплексы обычно получают при взаимодействии солей или гидроксидов металлов с аммиаком в водных или неводных растворах , либо обработкой тех же солей в кристаллическом состоянии газообразным аммиаком : AgCl(т) + 2 NH 3 . H 2 O = [Ag(NH 3 ) 2 ]Cl + 2 H 2 O Cu(OH) 2 (т) + 4 NH 3 . H 2 O = [Cu(NH 3 ) 4 ](OH) 2 + 4 H 2 O NiSO 4 + 6 NH 3 . H 2 O = [Ni(NH 3 ) 6 ]SO 4 + 6 H 2 O CoCl 2 + 6 NH 3 (г) = [Co(NH 3 ) 6 ]Cl 2](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img33.jpg)
![Образование комплексных соединений Получение ацидокоплексов. Например дитиосульфатоаргентат(I)-ион получается по обменной реакции: Ag + + 2 SO 3 S 2- = [Ag(SO 3 S) 2 ] 3- и гексанитрокобальтат(III)-ион, который осаждается в виде мелких желтых кристаллов калиевой соли при смешивании растворов, содержащих хлорид кобальта(II), нитрит калия и уксусную кислоту: CoCl 2 + 7 KNO 2 + 2 CH 3 COOH = = K 3 [Co(NO 2 ) 6 ] + NO + 2 KCl + 2 CH 3 COOK + H 2 O В этой окислительно-восстановительной реакции происходит изменение степени окисления кобальта от +II до +III. Эта реакция используется для определения примеси калия в солях натрия.](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img34.jpg)
![Образование комплексных соединений Платина химически растворяется в смеси концентрированных азотной и соляной кислот (так называемой “царской водке”) с образованием гексахлороплатината(IV) водорода H 2 [PtCl 6 ]: 3 Pt + 4 HNO 3 + 18 HCl = 3 H 2 [PtCl 6 ] + 4 NO + 8 H 2 O Гексахлороплатинат(IV) водорода был первым реагентом, с применения которого началась аналитическая химия калия, рубидия и цезия, поскольку гексахлороплатинаты(IV) этих элементов K 2 [PtCl 6 ], Rb 2 [PtCl 6 ] и Cs 2 [PtCl 6 ] малорастворимы в воде.](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img35.jpg)
![Образование комплексных соединений Гексацианоферрат(II) калия образуется по реакции: 6 KCN + FeSO 4 = K 4 [Fe(CN) 6 ] + K 2 SO 4 Из водного раствора гексацианоферрат(II) калия выделяется в виде желтых кристаллов состава K 4 [Fe(CN) 6 ] . 3 H 2 O. Это соединение широко используется в аналитической практике для определения присутствия в образцах катионов железа(III): [Fe(H 2 O) 6 ] 3+ + K + + [Fe(CN) 6 ] 4- = KFe[Fe(CN) 6 ] + 6 H 2 O Продуктом этой реакции является малорастворимый гексацианоферрат(II) железа(III)-калия KFe[Fe(CN) 6 ] ярко-синего цвета.](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img36.jpg)
![Образование комплексных соединений Хелатные комплексы. Например, a-аминоуксусная кислота ( глицин ) может реагировать с гидроксидом меди с образованием сине-фиолетового прочного комплекса, растворимого в воде: Cu(OH) 2 + 2 NH 2 CH 2 COOH = [Cu(NH 2 CH 2 COO) 2 ] + 2 H 2 O Лиганд NH 2 CH 2 COO - (глицинат-ион) относят к категории бидентатных лигандов, образующих две химические связи с комплексообразователем – через атом кислорода карбоксильной группы и через атом азота аминогруппы:](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img37.jpg)


 2 [Pt(NH 3 ) 5 (OH)]Br 3 [Cr(CO) 6 ] K[Au(CN) 2 Cl 2 ] Ca[Cr(NH 3 ) 2 (NCS) 4 ] 2 [Cr(H 2 O) 6 ]Cl 3](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img40.jpg)
![1.В следующих комплексных соединениях укажите центральный атом, лиганды, внутреннюю и внешнюю сферы; определите заряд комплексной частицы, степень окисления центрального атома и его координационное число. Назовите эти соединения и укажите к какому ипу комплексных соединений оно относится. [Al(H 2 O) 6 ] 2 (SO 4 ) 3 Na 3 [FeF 6 ]; [Cu(NH 3 ) 4 Cl(NO 2 )] Na[Sb(OH) 6 ] [Co(H 2 O)(NH 3 ) 4 Cl]Cl 2 [Ti(H 2 O) 6 ]Cl 3](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img41.jpg)











![Значение комплексных соединений Значительную часть природных минералов, в том числе полиметаллических руд и силикатов, также составляют координационные соединения. Более того, химические методы извлечения металлов из руд, в частности меди, вольфрама, серебра, алюминия, платины, железа, золота и других, также связаны с образованием легкорастворимых, легкоплавких или летучих комплексов. Например: Na 3 [AlF 6 ] – криолит, KNa 3 [AlSiO 4 ] 4 – нефелин (минералы, комплексные соединения, содержащие алюминий).](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img53.jpg)




![1. Гидратная изомерия Первый изомер , [Cr(H 2 O) 6 ]Cl 3 – хлорид гексааквахрома(III) – представляет собой кристаллы серо-сиреневого цвета, которые при растворении в воде образуют фиолетовый раствор. Такую окраску раствору придают катионы [Cr(H 2 O) 6 ] 3+ . Из раствора под действием ионов Ag + осаждаются все три хлорид-аниона: [Cr(H 2 O) 6 ]Cl 3 + 3 AgNO 3 = [Cr(H 2 O) 6 ](NO 3 ) 3 + 3 AgCl¯](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img58.jpg)
![1. Гидратная изомерия Второй изомер – [Cr(H 2 O) 5 Cl]Cl 2 . H 2 O, моногидрат хлорида хлоропентааквахрома(III), придает раствору голубовато-зеленый цвет, а ионы Ag + осаждают только два хлорид-иона: [Cr(H 2 O) 5 Cl]Cl 2 + 2 AgNO 3 = [Cr(H 2 O) 5 Cl](NO 3 ) 2 + 2 AgCl¯ Т ретий изомер – [Cr(H 2 O) 4 Cl 2 ]Cl . 2 H 2 O, дигидрат хлорида дихлоротетрааквахрома(III), окрашивает раствор в темно-зеленый цвет, а ионы Ag + осаждают из его раствора только один хлорид-ион: [Cr(H 2 O) 4 Cl 2 ]Cl + AgNO 3 = [Cr(H 2 O) 4 Cl 2 ]NO 3 + AgCl¯](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img59.jpg)
![2. Ионная изомерия. Связана с различным распределением заряженных лигандов между внешней и внутренней сферами комплексного соединения. Ионные изомеры по-разному диссоциируют в водном растворе. Так, нитрат дихлоротетраамминкобальта(III) [Co(NH 3 ) 4 Cl 2 ]NO 3 при растворении в воде диссоциирует на ионы: [Co(NH 3 ) 4 Cl 2 ]NO 3 = [Co(NH 3 ) 4 Cl 2 ] + + NO 3 - При добавлении к такому раствору AgNO 3 осадка хлорида серебра не образуется. Ионный изомер упомянутого выше комплекса, хлорид нитратохлоротетраамминкобальта(III) [Co(NH 3 ) 4 Cl(NO 3 )]Cl, при растворении в воде диссоцирует иначе: [Co(NH 3 ) 4 Cl(NO 3 )]Cl = [Co(NH 3 ) 4 Cl(NO 3 )] + + Cl - Из этого раствора при добавлении AgNO 3 выделяется осадок AgCl.](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img60.jpg)
![3. Изомерия лигандов Изомерия лигандов подразделяется на связевую (которая определяется разным типом координации одного и того же лиганда), и собственно изомерию лиганда. Примерами связевой изомерии может служить существование нитро- и нитрито-комплексов кобальта(III) состава K 3 [Co(NO 2 ) 6 ] и K 3 [Co(ONO) 6 ], в которых координация лиганда NO 2 - осуществляется, соответственно, через атом азота или атом кислорода. Другой пример – координация тиоцианат-иона NCS - через атом азота или через атом серы, с образованием тиоцианато-N- или тиоцианато-S-комплексов. Кроме того, лиганды сложного строения (например, аминокислоты) могут сами по себе образовывать изомеры, координация которых ведет к образованию комплексов одинакового состава с разными свойствами.](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img61.jpg)



![4. Геометрическая изомерия. Например, катион дигидроксотетраамминкобальта(III) [Co(NH 3 ) 4 (OH) 2 ] + имеет два изомера:](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img65.jpg)
![5. Оптическая изомерия Оптическая изомерия связана со способностью некоторых комплексных соединений существовать в виде двух форм, не совмещаемых в трехмерном пространстве и являющихся зеркальным отображением друг друга, как левая рука и правая. Поэтому оптическую изомерию называют иногда еще зеркальной изомерией . Например, темно-зеленые кристаллы тригидрата триоксалатокобальтата(III) аммония (NH 4 ) 3 [Co( ox ) 3 ] . 3 H 2 O существуют в виде двух оптических изомеров, комплексный анион которых имеет октаэдрическое строение. Поскольку полное изображение бидентатного оксалатного лиганда неудобно, его часто обозначают в виде дуги, соединяющей вершины октаэдра:](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img66.jpg)

![5. Оптическая изомерия Как видно из схемы, расположение лигандов в оптических изомерах комплексного аниона [Co( ox ) 3 ] 3- таково, что анионы соотносятся между собой как предмет и его зеркальное изображение. Как бы мы не повернули анионы, их составные части никогда полностью не совпадут, так же как не совпадает левая рука с правой. Оптические изомеры отличаются тем, что их растворы способны вращать плоскость поляризации светового луча. Один изомер вращает плоскость поляризации влево и поэтому называется L -изомером, другой – вправо и называется D -изомером. Аналогичная система обозначений применяется для изомеров органических соединений.](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img68.jpg)
![Определите тип изомерии в наборах комплексных соединений: а) [Cr(H 2 O) 6 ]Cl 3 и [Cr(H 2 O) 5 Cl]Cl 2 . H 2 O](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img69.jpg)
![Определите тип изомерии в наборах комплексных соединений: б) [Co(NH 3 ) 5 Br]SO 4 и [Co(NH 3 ) 5 SO 4 ]Br](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img70.jpg)
![Определите тип изомерии в наборах комплексных соединений: в) [Pt(NH 3 ) 5 Cl]Cl 3 и [Pt(NH 3 ) 4 (Cl) 2 ]Cl 2 . NH 3](https://fsd.multiurok.ru/html/2020/01/18/s_5e22cec06b0b7/img71.jpg)










