Тема: «Неметаллы»
Цель:
-
Дать общую характеристику неметаллов, актуализировать знания учащихся о физических свойствах неметаллов, о типах кристаллических решеток; развивать умения применять знания, сравнивать и делать выводы; воспитывать химическую аккуратность по отношению к окружающей среде.
Задачи:
Образовательные:
-
Дать общую характеристику неметаллов элементов и простых веществ.
-
Изучить положение неметаллов в ПС;
-
Изучить особенности строения атомов неметаллов;
-
Изучить явление аллотропии на примере неметаллов;
-
Изучить физические свойства неметаллов;
Развивающие:
-
Расширение кругозора и развитие интереса к предмету через информационно - коммуникативные и проектные технологии;
-
Развитие критического мышления, способности к рефлексии;
-
Обеспечение системности учения; умения анализировать;
Воспитательные:
-
Воспитание положительной мотивации учения;
-
Воспитание правильной самооценки и чувства ответственности;
-
Воспитание культуры поведения, общения и культуры умственного труда.
Ход урока:
Положение атомов неметаллов в ПСХЭ Д.И. Менделеева
Неметаллы расположены в правом верхнем углу ПСХЭ.
Всего 22 элемента являются неметаллами в периодической системе.
Задания № 1: по периодическому номеру химического элемента определите: 7,6,16, 14.
1. Название химического элемента;
2. Положение элемента (период, группа, подгруппа);
3. Количество протонов, нейтронов, электронов в ядре атома химического элемента;
4. Запишите его электронную конфигурацию;
5. Валентность (высшая и низшая);
6. Формулу высшего оксида.
Для атомов - неметаллов характерно:
-
Небольшой атомный радиус;
-
Большее число электронов на внешнем уровне (4-8е);
-
Элементы-неметаллы расположены только в главных подгруппах, значит, происходит заполнение электронами только внешнего энергетического уровня;
-
Для атомов - неметаллов характерны высокие значения электроотрицательности.
Физические свойства Неметаллов:
-
Для неметаллов простых в-в характерны все 3 агрегатных состояния при обычных условиях.
-
А) твердые (S,I2, графит);
-
Б) жидкие (бром);
-
В) газообразные (O2, N2, H2, Cl2, F2);
-
Г) Цветовая гамма разнообразная.
Такое разнообразие свойств неметаллов является следствие образования неметаллами двух типов кристаллических решеток: молекулярной (все газы, белый фосфор) и атомной (алмаз, графит, кремний).
Химические свойства неметаллов:
Химические элементы-неметаллы могут проявлять как окислительные, так и восстановительные свойства, в зависимости от химического превращения, в котором они принимают участие.
Атомы самого электроотрицательного элемента - фтора - не способны отдавать электроны, он всегда проявляет только окислительные свойства, другие элементы могут проявлять и восстановительные свойства, хотя намного в меньшей степени, чем металлы. Наиболее сильными окислителями являются фтор, кислород и хлор, преимущественно восстановительные свойства проявляют водород, бор, углерод, кремний, фосфор, мышьяк и теллур. Промежуточные окислительно-восстановительные свойства имеют азот, сера, йод.
Взаимодействие с простыми веществами
1. Взаимодействие с металлами:
2Na + Cl2 = 2NaCl,
Fe + S = FeS,
6Li + N2 = 2Li3N,
2Ca + O2 = 2CaO
В этих случаях неметаллы проявляют окислительные свойства, они принимают электроны, образуя отрицательно заряженные частицы.
2. Взаимодействие с другими неметаллами:
Взаимодействуя с водородом, большинство неметаллов проявляет окислительные свойства, образуя летучие водородные соединения - ковалентные гидриды:
3H2 + N2 = 2NH3
H2 + Br2 = 2HBr
3. Взаимодействуя с кислородом, все неметаллы, кроме фтора, проявляют восстановительные свойства:
S + O2 = SO2
4P + 5O2 = 2P2O5
4.При взаимодействии с фтором фтор является окислителем, а кислород - восстановителем:
2F2 + O2 = 2OF2
5. Неметаллы взаимодействуют между собой, более электроотрицательный металл играет роль окислителя, менее электроотрицательный - роль восстановителя:
S + 3F2 = SF6
C + 2Cl2 = CCl4
Получение неметаллов:
Способы получения неметаллов отличаются многообразием и специфичностью, общих подходов не существует. Рассмотрим основные способы получения некоторых неметаллов.
Получение галогенов. Самые активные галогены - фтор и хлор - получают электролизом. Фтор - электролизом расплава KHF2, хлор - электролизом расплава или раствора хлорида натрия:
2Г- - 2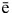 = Г2.
= Г2.
Другие галогены можно также получить электролизом или вытеснением из их солей в растворе с помощью более активного галогена:
Cl2 + 2NaI = 2NaCl + I2
Получение водорода. Основной промышленный способ получения водорода - конверсия метана (каталитический процесс):
CH4 + H2O = CO + 3H2
Получение кремния. Кремний получают восстановлением коксом из кремнезема:
SiO2 + 2C = Si + 2CO.
Получение фосфора.
Фосфор получают восстановлением из фосфата кальция, который входит в состав апатита и фосфорита:
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO.
Кислород и азот получают фракционной перегонкой жидкого воздуха.
Сера и углерод встречаются в природе в самородном виде.
Селен и теллур получают из отходов производства серной кислоты, так как эти элементы встречаются в природе вместе с соединениями серы.
Мышьяк получают из мышьяковистого колчедана по сложной схеме превращений, включающей стадии получения оксида и восстановления из оксида углеродом.
Бор получают восстановлением оксида бора магнием.
Применение неметаллов:
Водород используется в химической промышленности для синтеза аммиака, хлороводорода и метанола, применяется для гидрогенизации жиров. Используется в качестве восстановителя при производстве многих металлов, например, молибдена и вольфрама, из их соединений.
Хлор применяют для производства соляной кислоты, винилхлорида, каучука и многих органических веществ и пластмасс, в текстильной и бумажной промышленности используют в качестве отбеливающего средства, в быту - для обеззараживания питьевой воды.
Бром и йод используют в синтезе полимерных материалов, для приготовления лекарственных препаратов и др.
Кислород применяется при сжигании топлива, при выплавке чугуна и стали, для сварки металлов, необходим для жизнедеятельности организмов.
Сера используется для производства серной кислоты, изготовления спичек, пороха, для борьбы с вредителями сельского хозяйства и лечения некоторых болезней, в производстве красителей, взрывчатых веществ, люминофоров.
Азот и фосфор применяются при производстве минеральных удобрений, азот применяется при синтезе аммиака, для создания инертной атмосферы в лампах, используется в медицине. Фосфор применяется при производстве фосфорной кислоты.
Алмаз используется при обработке твердых изделий, в буровых работах и ювелирном деле, графит - для изготовления электродов, тиглей для выплавки металлов, в производстве карандашей, резины и др.
Задание № 2: составить простой кроссворд, основанный на физических свойствах металлов и неметаллов.
Домашнее задание:
1. Изучить теоретический материал по данной теме;
2. Выполнить задание № 1, № 2.



























