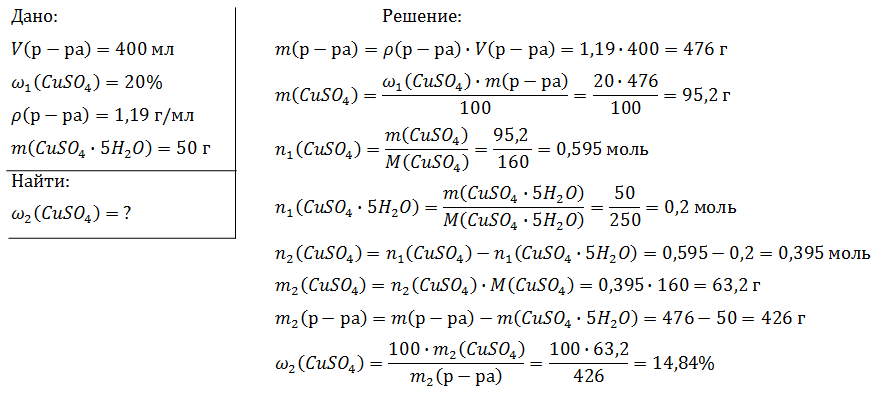Тема урока: Способы выражения концентрации растворов: массовая доля растворенного вещества, молярная концентрация.
Цели:
-
Образовательные:
-
1. Закрепить знания о, массовой доли растворенного вещества в растворе.
-
2. Закрепить знания и умения, учащихся при решении задач на проценты, совершенствовать навыки решения текстовых задач с помощью химических формул.
-
3. Сформировать навыки решения расчетных задач с применением молярной концентрации.
-
Воспитательная:
-
4. Воспитание мотивации к учению.
-
Развивающая:
-
5. Развитие познавательного интереса к урокам химии.
Тип урока: комбинированный урок.
Оборудование: презентация, периодическая система Д.И.Менделеева, карточки с заданиями для учащихся.
Лабораторное оборудование и вещества: На столах учащихся: мерный цилиндр, лабораторные весы с разновесами, стеклянная палочка, химический стакан, колба с водой,
пробирка с солью (по вариантам).
План урока
I.Организация группы к учебной работе.
1. Приветствие.
2. Организационный момент.
3. Создание комфортной доброжелательной обстановки в классе.
II. Актуализация и фиксирование индивидуальных затруднений в пробном действии
Организует повторение материала, изученного на предыдущем уроке и основных терминов, и понятий, необходимых для освоения нового материала.
Проверяется наличие у учеников выполненных письменных работ. Обсуждаются задания, которые вызвали затруднения
Фронтальная беседа с классом:
-
что такое дисперсные системы?
-
какими бывают дисперсные системы?
-
какими свойствами обладают дисперсные системы?
-
значение дисперсных систем.
1.Работа у доски.
Решение задачи на массовую долю растворенного вещества в растворе
Вычислите массу воды, которую нужно добавить к 50 г 20 %-ного раствора соляной кислоты, чтобы уменьшить её концентрацию до 10 %. Ответ укажите в граммах с точностью до целых.
Решение:
Найдем массу кислоты:
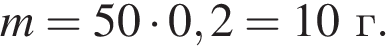
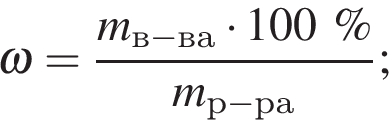
пусть 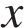 — масса воды, которую нужно добавить, тогда:
— масса воды, которую нужно добавить, тогда:
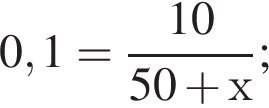
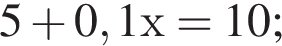
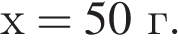
2. Работа с группой.
Преподаватель раздаёт на каждую парту лист с химическим диктантом /приложение 1/ и даёт такие комментарии:
– Ребята, я предлагаю вам выполнить это задание для того, чтобы вы вспомнили ключевые понятия прошлого урока. Многие характеристики кислорода помогут нам более детально разобраться в теме сегодняшнего урока.(приложение 1)
Далее преподаватель показывает на слайде “ключ” ответов:
– Я прошу вас продемонстрировать результат выполненной работы; поднимите руку те дети, кто получил положительную оценку. (Если в классе окажутся дети с неудовлетворительной оценкой, учитель предложит им выполнить это задание ещё раз на следующем уроке).
III.Мотивация
На практике часто приходится иметь дело с растворами, имеющими строго заданное содержание в них растворенного вещества.
Во-первых, это приготовление различных лекарственных растворов. Если в аптеке случайно произойдет ошибка с количеством лекарства в его растворе, то последствия могут быть самыми плачевными.
Во-вторых, многие химические реакции проводят в растворах. И здесь ошибки могут приводить к печальным результатам. Например, если фотограф ошибется при растворении проявителя, то фотографии либо не проявятся, либо будут испорчены.
Другой пример: если залить в аккумулятор раствор, в котором содержание серной кислоты будет меньше или больше требуемого, то аккумулятор либо не будет работать, либо выйдет из строя
IV. Объяснение нового материала.
Преподаватель: -Тема сегодняшнего урока «Способы выражения концентрации растворов: массовая доля растворенного вещества, молярная концентрация».
И сегодня вы должны
• расширить и систематизировать представления о способах выражения
концентрации растворов;
• изучить новые способы выражения концентраций растворов;
• учиться применять полученные теоретические знания при решении задач;
• развивать интеллектуальные умения и навыки.
- Концентрация — величина, характеризующая количественный состав раствора.
Согласно правилам ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л), то есть это соотношение неоднородных величин. Те величины, которые являются отношением однотипных величин (отношение массы растворённого
вещества к массе раствора, отношение объёма растворённого вещества к объёму раствора) правильно называть долями.
Однако на практике для обоих видов выражения состава применяют термин концентрация и говорят о концентрации растворов.
- Существуют несколько способов выражения концентраций растворов:
1 Массовая доля (весовые проценты, процентная концентрация)
2 Объёмная доля
3 Молярность (молярная концентрация)
4 Мольная доля
5 Моляльность (моляльная концентрация)
6 Титр раствора
7 Нормальность (молярная концентрация эквивалента)
8 Растворимость вещества
- Мы с вами рассмотрим массовую долю растворенного вещества в растворе и молярную концентрацию.
Понятие массовой доли растворенного вещества в растворе вы изучали в курсе химии 8 класса и решали задачи. Вспомните определение массовой доли и формулу ее расчета.
Обучающиеся: - Массовая доля растворённого вещества - это отношение массы растворённого вещества к массе раствора.
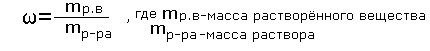 (слайд №5)
(слайд №5)
Решим задачу: Смешали 80 г раствора с массовой долей нитрата натрия 25 % и 20 г раствора этой же соли с массовой долей 40 %. Вычислите массовую долю соли в полученном растворе. Ответ дайте в процентах с точностью до целых.
Массовая доля вещества в растворе вычисляется по формуле:
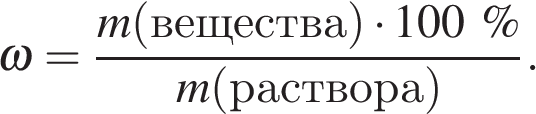
Найдем массу вещества:
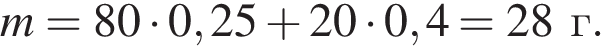
Найдем массу раствора:

Имеем:
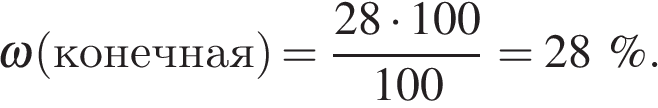
Преподаватель: - В бинарных растворах часто существует однозначная зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра). Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спирта, жира в молоке, сахара). Часто для выражения концентрации (например, серной кислоты в аккумуляторах) пользуются просто их плотностью. Распространены ареометры предназначенные для определения концентрации растворов веществ.
- Решим задачу. (Задачу у доски решает обучающийся)
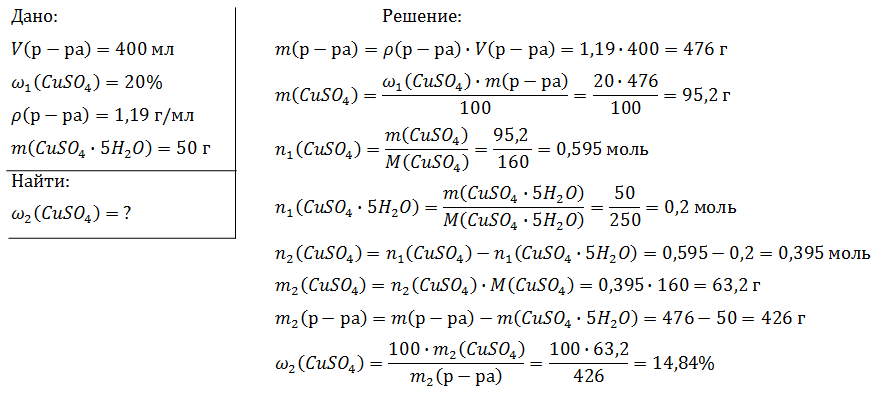
- Следующий вид выражения концентрации раствора – это молярность или молярная концентрация.
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
C(B) = n(B) / V = m(B) / (M(B) · V),
где М(B) - молярная масса растворенного вещества г/моль.
Молярная концентрация измеряется в моль/л и обозначается "M". Например, 2 M NaOH - двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г (M(NaOH) = 40 г/моль).
Молярность чаще выражают в моль/л или ммоль/л. Возможны следующие обозначения молярной концентрации - С, См, М.
Так, раствор с концентрацией 1,0 моль/л называют одномолярным, можно записать – 1М,
0,1 моль/л – децимолярным – 0,1М, 0,01 моль/л – сантимолярным – 0,01М (слайд №7)
- Решим задачу:
Задача:
Раствор объемом 500 мл содержит NaOH массой 5 г. Определить молярную концентрацию этого раствора.
Д а н о:
V(р-ра)=500мл, или 0,5 л
m(NaOH )=5г;
____________________
Найти: C(NaOH )
Решение:
1. Вычислим число моль в 5 г NaOH :
ⱱ(NaOH)=m(NaOH)/M(NaOH); ⱱ =5г/40г/моль=0,125 моль
2. Определим молярную концентрацию раствора:
C=ⱱ (NaOH)/V(р-ра);
C=0,125 моль/0,5=0,25моль/л;
Ответ:C=0,25моль/л
Вычислить массу хлорида натрия NaCl, содержащегося в растворе объемом 200 мл, если его молярная концентрация 2 моль/л.
Д а н о
V(р-ра)=200мл, или 0,2 л
C(NaCl )=2 моль/л
Найти: m(NaCl )
Решение:
1. Вычислим число моль m(NaCl ), которое содержится в растворе объёмом 0,2л:
C= ⱱ (NaCl)/V(р-ра); ⱱ(NaCl)=С·V(р-ра);
ⱱ(NaCl)=2моль/л·0,2л=0,4 моль
2. Вычислим массу NaCl:
m(NaCl)=M(NaCl) * ⱱ(NaCl); M(NaCl)=58,5г/моль
m(NaCl)=58,5г/моль·0,4 моль=23,4г NaCl
Ответ:m(NaCl)=23,4г
III. Закрепление изученного – выполнение лабораторной работы «Приготовление растворов с заданной молярной концентрацией».
Повторение правил техники безопасности
- А теперь выполним лабораторную работу №1 «Приготовление растворов с заданной молярной концентрацией»
Для этого решите задачу по вариантам. Задания даны на карточках-инструктажах
Затем приготовьте раствор заданной концентрацией взвесив рассчитанную массу на весах и отмерьте нужный объем воды мерным цилиндром.
Вспомним правила работы с лабораторными весами и правила измерения объёма жидкости с помощью измерительного цилиндра.
Составьте отчет о работе в произвольной форме.
После выполнения работы сдайте тетради на проверку, уберите свое рабочее место и запишите домашнее задание
Подведение итогов урока. Выставление оценок
Рефлексия -Что мы узнали сегодня нового? – Что мы научились выполнять? – Какие были затруднения? – Что показалось самым интересным? – Что удивило вас?
– Спасибо за сотрудничество!
IV. Домашнее задание: Домашнее задание:
Рефлексия
ФИО ученика______________________________________________________________________
-Что мы узнали сегодня нового? ______________________________________________________
__________________________________________________________________________________
– Что мы научились выполнять?______________________________________________________
__________________________________________________________________________________
– Какие были затруднения?__________________________________________________________
– Что показалось самым интересным? ________________________________________________
Приложение 1
Дисперсные системы. Растворы. Процессы происходящие в растворах.
Вариант 1.
А1.Чистое (индивидуальное) вещество, в отличие от смеси, - это:
1)чугун; 2) пищевая сода; 3) воздух; 4) нефть.
А2. Дисперсная система, в которой в газовой дисперсионной среде распределены частицы жидкости, - это:
1)аэрозоль; 2)пена; 3) эмульсия; 4)золь.
А3. Суспензия – это дисперсная система, в которой:
-
газообразные частицы распределены в жидкости;
-
газообразные частицы распределены в газе;
-
частицы жидкости распределены в жидкой, не растворяющей ее среде;
-
твердые частицы распределены в жидкости.
А4.Истинным раствором является:
-
речной ил; 2) кровь; 3)соляная кислота; 4) молоко.
А5.Оцените справедливость утверждений.
А. С повышением температуры растворимость всех веществ увеличивается.
Б. Коагуляция коллоидного раствора происходит при добавлении электролита
1) верно только А. 2) верно только Б.
3) верны оба утверждения; 4) оба утверждения неверны.
Дисперсные системы. Растворы. Процессы происходящие в растворах.
Вариант 2.
А1.Чистое (индивидуальное) вещество, в отличие от смеси, - это:
1)известковая вода; 2) нержавеющая сталь; 3)царская водка; 4)медный купорос.
А2. Дисперсная система, в которой в жидкой дисперсионной среде распределены частицы жидкости, - это:
1)гель; 2) эмульсия; 3) аэрозоль; 4)суспензия.
А3. Аэрозоль – это дисперсная система, в которой:
1) твердые частицы распределены в жидкой дисперсионной среде;
2) газообразные частицы распределены в газе;
3) твердые и жидкие частицы распределены в газовой среде;
4) частицы жидкости распределены в жидкой, не растворяющей ее среде.
А4.Истинным раствором является:
-
кисель; 2)раствор сульфата меди (II); 3)известковое молоко; 4) молоко.
А5.Оцените справедливость утверждений.
А. С повышением давления растворимость газов увеличивается.
Б. В отличие от истинных растворов коллоидные растворы рассеивают проходящий через них свет
1) верно только А. 2) верно только Б.
3) верны оба утверждения; 4) оба утверждения неверны.
Ответы:
| Вариант 1 1.2 2.1 3.4 4.3 5.2
| Вариант 2 1.4 2.2 3.3 4.2 5.3 |
Приложение 2
Лабораторная работа № 1
Приготовление растворов с заданной молярной концентрацией
Цель работы: научиться готовить раствор с заданной молярной концентрацией, проверить на практике действенность теоретических знаний о способах выражения концентрации веществ в растворе
Реактивы: хлорид натрия, хлорид кальция, дистиллированная вода.
Оборудование: весы, мерные колбы.
Ход работы:
Задания:
Рассчитайте массу соли, которую необходимо взять для приготовления:
Вариант I - 100мл 0,1 М раствора хлорида натрия.
Вариант II - 100мл 0,2 М раствора хлорида калия.
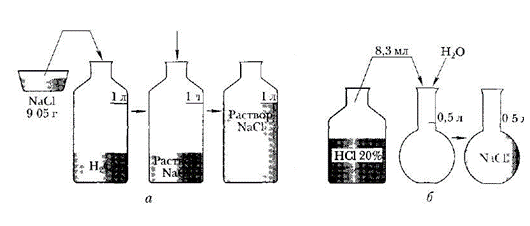
Алгоритм приготовления определённого объёма раствора с заданной молярной концентрацией:
-
Рассчитать массу хлорида натрия.
-
Для расчетов использовать формулы:
C = ν / V; ν = C V; m = ν M; m = C V M
-
Взвесить на весах рассчитанную навеску.
-
Перенести навеску соли в мерную колбу.
-
Прилить в колбу немного воды и перемешать стеклянной палочкой до полного растворения соли.
-
Налить в мерную колбу воды до метки.
-
Чтобы не перелить воду, последние капли добавлять с помощью пипетки.
-
Закройте мерную колбу пробкой и несколько раз переверните вверх дном, придерживая пробку пальцем. (Каждый раз, когда раствор в колбе будет принимать нормальное положение, открывайте пробку).
Вывод: Научились ли Вы готовить растворы определенного объема с заданной молярной концентрацией?







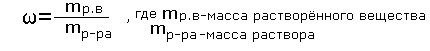 (слайд №5)
(слайд №5)