Конспект урока по химии для 8 класса.
Тема урока: «Закон постоянства состава веществ. Химические формулы».
Цели урока:
образовательная: ознакомить с учащихся с законом постоянства состава веществ и его применением; научить записывать химические формулы простых и сложных веществ, пользуясь химическими символами и индексами;
развивающая: продолжить развивать навыки анализа материала, умение делать выводы, обобщать, сравнивать, осознанно и обоснованно вести диалог;
воспитательная: продолжить воспитывать личность, способную критически мыслить в процессе обучения.
Тип урока: изучение нового материала.
Базовые понятия: химические формулы, индекс, коэффициент.
Оборудование: ИКТ, оценочные листы, опорные таблицы.
Учебник химия 8 класс, Г. Е. Рудзитис и Ф. Г. Фельдман, презентация, карточки с заданиями.
Межпредметные связи: с математикой, биологией, русским языком.
Ход урока.
Организационный момент (о работе с оценочными листами).
Актуализация ЗУН «Мозговой штурм» (индивидуальная и групповая работа).
Что такое вещества?
Какие вещества называются простыми?
Что такое молекула?
Что такое атом?
Дайте определение химического элемента.
Опрос домашнего задания (презентация).
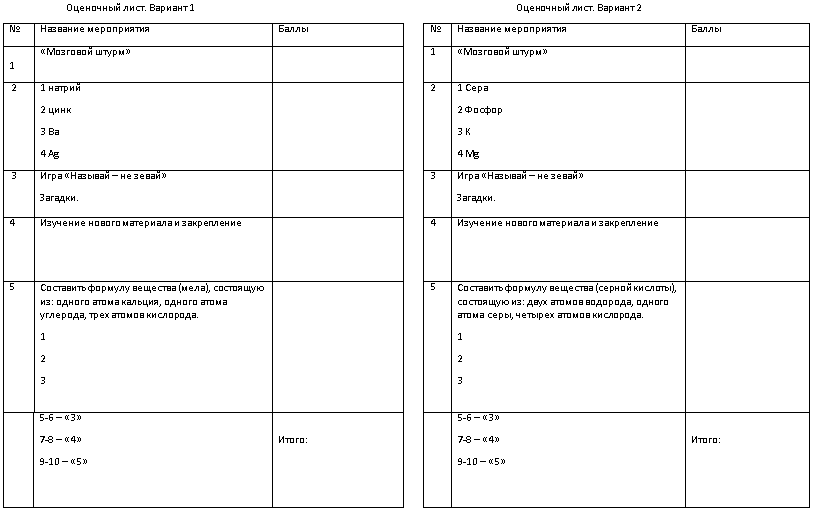
Запишите химические знаки и русские названия следующих элементов:
I-вариант. II-вариант.
Натрий 1. Сера
Цинк 2. Фосфор
Ba 3. K
Ag 4. Mg
Правильный ответ.
I-вариант. II-вариант.
Na 1.S
Zn 2.P
Барий 3. Калий
Серебро 4. Магний
Взаимопроверка.
Игра «Называй не зевай».
Учитель предлагает таблички с химическими знаками, учащиеся называют элементы и произношение знака.
Работа у доски (два ученика). «Отгадай загадку». Правильно записанные символы элементов помогут составить искомое слово и прочитать по-русски. Запиши в строчку аш, о, це. Что у тебя на лице? (нос).
Це, о, калий на часок зашли в кафе и пили? (сок).
Изучение нового материала.
Проблема: различается ли по составу чистое вещество вода, текущая из крана, родниковая и полученная синтетическим путём? Эта проблема легла в основу открытия одного из законов химии. Какого? § 13 стр.45 (Закон постоянства состава веществ). Состав веществ записывают с помощью…(химических формул). Записывается тема урока. Целеполагание.
Работа с учебником и презентацией. (учащиеся находят ответы в учебнике). Когда и кем был открыт закон постоянства состава веществ? Как читается закон? Учитель: Закон справедлив только для веществ молекулярного строения.
(Модель молекулы воды) Рассчитаем соотношение масс водорода и кислорода в молекуле воды. Ar(H)=1; Ar(O)=16; 2Ar (H) : Ar (O)= (2•1) : (1•16)= 1:8 Состав воды постоянен.
Задача № 1.
Сколько граммов и какого вещества останется, если смешать 8г кислорода и 3г водорода. Какого же значение закона постоянства состава веществ?
Задача № 2.
Определить массу водорода, реагирующего без остатка с 16г. кислорода.
Решение: 1г. водорода соединяется с 8г. кислорода.
х г. водорода --- c 16г. кислорода.
1г. : х г. = 8г. : 16г.
Х= (1•16) : 8 = 2г. водорода.
При изучении химии очень важно научиться составлять формулы химических веществ. Это химический язык, буквами в котором служат символы химических элементов, с помощью которого химики из разных стран могут общаться и понимать друг друга. Работа с учебником и у доски.
Учитель: Для изучения нового материала нам нужны понятия.
Химическая формула-это условная запись состава вещества посредством химических знаков и индексов.
Индекс-это цифра, которую записывают справа внизу у знака элемента, она показывает число атомов элемента, входящих в состав данного вещества.
Записать химические формулы воды, углекислого газа и кислорода, железа. Каково значение данных веществ в жизни человека?
Учитель: H2O если в составе молекулы один атом элемента, то индекс цифрой 1 не записывается.
Читается аш-два-о.
Одна молекула воды.
Суммарное число атомов в молекуле 3.
Для записи количества молекул или отдельных атомов используется коэффициент. Его ставят перед химической формулой или атомом, если молекула одна и атом один, то коэффициент 1 опускается.
3H2O три молекулы воды; читается три-аш-два-о; суммарное число атомов девять.
Ученик: (шаростержневая модель молекулы углекислого газа).
СO2 Читается? Число молекул?
Вопрос к классу: Вода и углекислый газ-простые или сложные вещества? Почему?
Ученик: (молекула кислорода состоит из двух атомов).
O2 Читается? Число молекул?
2О Что обозначает запись?
Формулы металлов обозначаются знаком: железа Fe.
Почему кислород и железо простые вещества?
Закрепление:
Составить формулу глюкозы, которая состоит из шести атомов углерода, двенадцати атомов водорода и шести атомов кислорода;
Прочитать;
Определить суммарное число атомов в молекуле.
Самостоятельная работа.
1. Составить формулы веществ, состоящих из:
I-вариант. II-вариант.
(мела) (серной кислоты)
одного атома кальция двух атомов водорода
одного атома углерода одного атома серы
трёх атомов кислорода четырёх атомов кислорода
2. Прочитать;
3. Определить суммарное количество атомов.
Правильный ответ.
CaCO3 H2SO4
кальций-це-о- три аш-два-эс-о-четыре
5 7
Взаимопроверка.
Выставление баллов и отметки по критериям (в оценочный лист и дневник).
Домашнее задание.
Изучить §13, 14 стр.47. Выполнить задания на стр.46 №*2; стр.49 №3, 4.
VII. Рефлексия. Своей работой на уроке: доволен (довольна)
я не совсем доволен (довольна)
я не доволен (не довольна), потому что…
Приложение 1.