| -Аммиак – это самое важное из водородных соединений азота - И на сегодняшнем уроке состоится знакомство с этим необычным веществом. Я предлагаю вам следующий план работы на уроке.( на слайде) 1. Итак, начнем мы наше знакомство с аммиаком с изучения состава и строения молекулы. - Поставьте цифру 1 и запишите « Состав и строение молекулы» - Формула аммиака «Эн аш три», пожалуйста, кто может записать ее на доске. -Укажите степень окисления элементов. - Укажите вид связи в молекуле. - Аммиак – это историческое название. Дайте верное название. - Дальше рассмотрим строение молекулы. Но, для этого нам нужно вспомнить электронное строение атома азота и водорода. Кто может изобразить на доске? (- формула азота, заряд ядра, число энергетических уровней, распределение электронов по уровням, электронная формула, графическая формула- распределение электронов по ячейкам) - На последнем уровне азота 5 электронов, при этом два из них спарены, три не спаренных. -А сколько электронов имеет водород? Его электронная формула ( 1S1). Спасибо. -Предположите, как образуется молекула аммиака? - 3 не спаренных электрона объединяются с 3-мя электронами водорода. - За счет чего возникает ковалентная полярная связь? ( за счет образования общих электронных пар). -В сторону какого элемента в молекуле аммиака будет смещена электронная плотность? (азота) -Почему? (т.к он более ЭО) Т.О, сделаем вывод о строении молекулы аммиака: в молекуле аммиака есть три ковалентные связи, образованные за счет общих электронных пар и на атоме азота имеются два не поделенных электрона. Здесь все ясно? У вас есть вопросы? 2. Перейдем к физическими свойствам аммиака. Ставим цифру 2 записываем - «Физические свойства» Я предлагаю изучить свойства самостоятельно по учебнику на стр…. и записать их в тетрадь. - Теперь давайте выясним какие свойства вы перечислили ( тот кто говорит, что он легче воздуха, тому задать вопрос – как собрать аммиак в лабораторных условиях) Итак, аммиак - это…….. У кого – то есть дополнения? (слайд) 3. Теперь познакомимся со способами получения аммиака. Ставим цифру 3 – «Получение» Предположите, самый2 простой способ получения аммиака? ( водород + азот) - Верно, это промышленный способ его получения. Напишем букву А) в промышленности - Кто может записать эту реакцию? - А теперь дайте ей характеристику: 1-это реакция по типу вступающих в реакцию и образующихся веществ - ? ( соединения) 2 – по тепловому эффекту (экзотермическая) 3- по изменению степени окисления (ОВР) 4- по обратимости (обратимая) 5- по наличию веществ, ускоряющих реакцию Молодцы! В лаборатории химики получают другим способом: действием гашеной извести (Са(ОН)2) на соли аммония, например, хлорид аммония: Демонстрация опыта «Получение аммиака в лаборатории» - Смешиваем хлорид аммония и гидроксид кальция, добавим немного воды, реакция уже началась, но чтобы она протекала быстрее, что нужно сделать? ( нагреть) - Нагреваем, повторим, как нужно держать пробирку для собирания газа? ( дном вверх) - Запах аммиака знаком многим, особенно девочкам, которые использовали краску для волос, т.е аммиак легко распознать по запаху. Кто желает его ощутить? Вспомните правила ТБ. -А теперь я прошу тебя (тот же ребенок) поднести к трубке с газом влажную фенолфталеиновую бумажку и описать произошедшие изменения. Почему изменился цвет? ( Аммиак проявляет основные свойства) - Вот почему его называли «щелочной воздух» - Вы сказали , что аммиак хорошо растворяется в воде. В каких объемах? (1:700) Посмотрим как это происходит. Демонстрация опыта «Растворение аммиака в воде» Са(ОН)2+NH4Cl=CaCl2+NH3+2H2O - Запишите данную реакцию. Итак, как мы можем получить аммиак? 4. Сразу же перейдем к химическим свойствам аммиака: - Запишите цифру 4 – «Химические свойства» При рассмотрении аммиака в воде, часть молекул взаимодействует с водой , рассмотрим как протекает данная реакция. а) с водой - Как вы знаете у атома азота есть неподеленная электронная пара электронов, а у катиона водорода в молекуле воды – вакантная орбиталь. Т.О азот будет отдавать свою пару электронов – т.е он будет донором. Водород будет ее принимать - он будет – акцептором, его дело предоставить электронам азота удобную «квартиру» - атомную орбиталь. В результате НЭП переходит на свободную орбиталь катиона водорода, т.о. формируется ковалентная связь образуется сложный катион аммония. ( он заряжен положительно) Такой механизм образования ковалентной связи называется донорно-акцепторный. Н 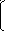  . . . . . . . .
![]() ![]() ![]() ![]() Н N Н + Н+ О Н- ↔ Н – N – Н ОН - Н N Н + Н+ О Н- ↔ Н – N – Н ОН -
│ Н акцептор Н ион аммония донор Образовавшееся вещество называется гидроксид аммония. Это водный раствор аммиака. Почему он окрашивает ф-ф в малиновый цвет? ( Гидроксид аммония – это слабое основание) - Даная реакция обратима, поэтому аммиак легко улетучивается, и мы можем ощущать его запах - Итак, в катионе аммония атом азота образует с атомами водорода три ковалентные знакомые нам полярные связи (т. к. Э. О. азота больше, чем у водорода) за счет общих электронных пар. Неподеленная электронная пара атома азота способна участвовать в образовании четвертой ковалентной связи по донорно – акцепторному механизму с атомами, имеющими вакантную орбиталь. - Следует запомнить так же, что в ионе аммония валетность азота IV, а степень окисления -3. Водный раствор аммиака имеет широкое значение: так, например, 10%-й раствор аммиака в воде называется нашатырный спирт и применяется медицине при обморочных состояниях, 25% раствор аммиака в воде называют аммиачной водой и используют в технике. - Аммиак легко взаимодействует с кислотами - В растворе кислот много ионов водорода. Как вы думаете, будет ли аммиак взаимодействовать с кислотами? - Конечно, и механизм протекания данной реакции аналогичен предыдущему. Запишем - б) с кислотами и разберем эту реакцию  Н Н
 . . . . . . . .
Н –N– H + H+ Cl- → H –N – H Cl- или NH4Cl │ │ Н Н В ходе реакции образуется соль, которая называется хлорид аммония ( нашатырь). Эту реакцию мы видели вначале урока, хлорид аммония – это и есть «белый дым», который выливался из колбы, это мельчайшие кристаллики соли. __________________________________________________ Вот что писал детский поэт про химические свойства аммиака: Добрый старый аммиак,
Он богач, и он бедняк,
Богат неподеленными своими электронами,
Но только, вот беда, ему
В растворе скучно одному.
Он погулять готов всегда:
Там кислота, а тут вода…
Потом, обобранный до нитки,
Он плачет: «Где мои пожитки?
Какое это беззаконие:
Стал катионом я аммония!» _____________________________________________________ -Следующее свойство – это горение аммиака . -Запишем «3) горение» ДЕМОНСТРАЦИЯ: В склянку с раствором аммиака опускаем горящую лучинку – наблюдаем, как она гаснет. - Итак, аммиак не горит! Но на самом деле реакция горения аммиака возможна, но при определенных условиях: посмотрите эти реакции в учебнике на стр. 49 в таблице 13. А теперь я попрошу вас поработать в паре и выполнить следующее задание: обсудите, какие продукты реакции образуются в этих реакциях, и в какой из них азот теряет больше электронов. -Готовы, проверим. | 






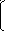
 . . . .
. . . . Н
Н . . . .
. . . .

















