Контрольно-измерительные материалы
Приложение к рабочим программам
по химии на 2018/2019 учебный год
Пояснительная записка
1. Паспорт контрольно-измерительных материалов
В результате освоения учебной дисциплины «Химия» обучающийся должен овладеть следующими требованиями к предметным результатам:
1) сформированность представлений о месте химии в современной научной картине мира; понимание роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач;
2) владение основополагающими химическими понятиями, теориями, законами и закономерностями; уверенное пользование химической терминологией и символикой;
3) владение основными методами научного познания, используемыми в химии: наблюдение, описание, измерение, эксперимент; умение обрабатывать, объяснять результаты проведенных опытов и делать выводы; готовность и способность применять методы познания при решении практических задач;
4) сформированность умения давать количественные оценки и проводить расчеты по химическим формулам и уравнениям;
5) владение правилами техники безопасности при использовании химических веществ;
6) сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
2. Назначение КИМов
Контрольно-измерительные материалы предназначены для проверки уровня усвоения учебного материала на основании образовательного минимума содержания образования и требований к уровню подготовки выпускников школ. Они составлены на основе педагогической практики с учетом различных методических разработок.
3. Документы, определяющие содержание КИМов
Содержание контрольно-измерительного материала по химии определяется на основе Федерального компонента государственного образовательного стандарта среднего общего образования по химии, базовый уровень (приказ Минобразования России от 05.03.2004 № 1089 «Об утверждении Федерального компонента государственных стандартов начального общего, основного общего и среднего общего образования»).
4. Подходы к отбору содержания и разработке структуры КИМа
На основании ФГОС, ФК ГОС по химии базового уровня разработан кодификатор, определяющий перечень элементов содержания и перечень способов деятельности, выносимых на итоговую проверку.
Разработка КИМа по химии осуществляется с учетом следующих общих положений:
КИМ ориентирован на проверку усвоения системы знаний и умений, которая рассматривается в качестве инвариантного ядра содержания действующих программ по химии для средней школы. В Федеральном компоненте Государственного стандарта среднего общего образования эта система знаний и умений представлена в виде требований к уровню подготовки выпускников по химии (базовый уровень);
проверка сформированности усвоения основных элементов содержания курса химии осуществляется на двух уровнях сложности: базовом и повышенном;
учебный материал, проверяемый заданиями КИМа, отбирается с учетом его общекультурной значимости для общеобразовательной подготовки выпускников средней школы.
Контрольно-измерительные материалы
для 8 класса
Контрольная работа № 1
Вариант 1
1. В каком ряду расположены сложные вещества?
1)S, Аl, N2
2)СO2, Fе, Н2O
3)НNО3, СаО, РН3
4)Si, Р4, Fе2O3
2. Каков количественный и качественный состав молекулы серной кислоты Н2SО4?
1) 1 атом водорода, 1 атом серы, 4 атома кислорода
2) 2 атома водорода, 1 атом углерода, 4 атома кислорода
3) 2 атома водорода, 1 атом серы, 4 атома кислорода
4) 2 атома кислорода, 1 атом серы, 4 атома водорода
3. Какова относительная молекулярная масса молекулы С2Н2O4?
1)130
2)29
3)90
4)49
4. Какое соединение обладает наибольшей относительной молекулярной массой?
1)МgO
2)ВаО
3)S
4)SгО
4)СаО
5. Установите соответствие.
| Молекулярная формула | Количественный и качественный состав вещества |
| А. НВг Б. С2Н2 В. РbО Г. СS2, | 1) 2 атома углерода и 2 атома водорода 2) 1 атом водорода и 1 атом бора 3) 1 атом свинца и 1 атом кислорода 4) 1 атом водорода и 1 атом брома 5) 1 атом серы и 2 атома углерода 6) 1 атом углерода и 2 атома серы |
6. Вычислите соотношение масс и массовые доли элементов в соединении К2СгО4. (хромат калия).
Неметаллы для завершения слоя легче:
отдают электроны; 2) принимают электроны; 3) отдают или принимают электроны; 4) у них слой завершённый.
Неметаллы занимают в периодической системе:
1) нижний левый угол; 2) верхний правый угол; 3) первые три периода целиком; 4) нижнюю часть ПСХЭ.
7.В обычном состоянии – жидкое вещество:
хлор; 2) водород; 3) бром; 4) иод.
8.Инертный газ:
1) азот; 2) ксенон; 3) кислород; 4) фтор.
9. Газ, который используют для изготовления световой рекламы:
1) гелий; 2) неон; 3) аргон; 4) ксенон.
10. Аллотропной модификацией кислорода является:
1) азот; 2) озон; 3) дейтерий; 4) гелий.
11. Выберите неправильное суждение:
1) кислород – газ без цвета; 2) озон имеет бледно-фиолетовый цвет; 3) кислород имеет голубоватый цвет; 4) озон имеет «запах грозы»
12. Установите соответствие между аллотропным видоизменением углерода и свойствами, которыми эта модификация обладает:
МОДИФИКАЦИЯ СВОЙСТВО
1) графит А) мягкий
2) алмаз Б) не проводит ток
В) электропроводный
Г) твёрдый
Д) имеет металлический блеск
Вариант 2
1. В каком ряду расположены сложные вещества?
1)S, Аl, N2
2)СO2, Fе, Н2O
3)НNО3, СаО, РН3
4)Si, Р4, Fе2O3
2. Каков количественный и качественный состав молекулы гидрокарбоната кальция Са(НСО3)2?
1) 1 атом водорода, 1 атом углерода, 3 атома кислорода,
1 атом кальция
2) 2 атома водорода, 1 атом углерода, 6 атомов кислорода, 1 атом калия
3) 2 атома водорода, 2 атома углерода, 6 атомов кислорода, 1 атом кальция
4) 5 атомов кислорода, 3 атома углерода, 3 атома водорода, 1 атом кальция
3. Какова относительная молекулярная масса молекулы Н2СгO4?
1)117 2)118
3)101,5 4)69
4. Какое соединение обладает наименьшей относительной молекулярной массой?
1)ТеО3 2)SеО3
3)SO3 4)РоO3
5. Установите соответствие.
| Молекулярная формула | Количественный и качественный состав вещества |
| А.НСl Б. С6Н10 В.NО Г. РН3 | 1) 6 атомов серы и 10 атомов водорода 2) 1 атом водорода и 1 атом хлора 3) 1 атом фосфора и 3 атома водорода 4) 1 атом водорода и 1 атом хрома 5) 1 атом азота и 1 атом кислорода 6) 6 атомов углерода и 10 атомов водорода |
6. Вычислите соотношение масс и массовые доли элементов в соединении Na2SiO3 (силикат натрия).
7.Металлы для завершения слоя:
1) отдают электроны; 2) принимают электроны; 3) отдают или принимают электроны; 4) у них слой завершённый.
8. Связь в металлах между катионами осуществляют:
1) свободные электроны; 2) анионы; 3) протоны; 4) нейтроны.
9. Самый пластичный из драгоценных металлов:
1) серебро; 2) платина; 3) золото; 4) ртуть.
10.Медь алхимики считали символом:
1) Венеры; 2) Марса; 3) Солнца; 4) Сатурна.
11. Наиболее мягкий металл:
1) хром; 2) титан; 3) молибден; 4) свинец.
12. Обладает наибольшей электропроводностью:
1) железо; 2) золото; 3) алюминий; 4) серебро.
13. Расставьте перечисленные металлы в порядке увеличения плотности:
1) медь; 2) железо; 3) свинец; 4) алюминий; 5) золото.
Ответ дайте в виде последовательности цифр.
Контрольная работа № 2
Вариант 1.
1. Перепишите названия и составьте формулы веществ:
нитрат натрия, оксид меди (II), гидроксид кальция, сульфат калия, иодид магния.
2. Перепишите формулы и дайте названия веществам:
Na2SiO3, H2SO4, Al(OH)3, SO3, H3PO4, FeCl3.
3. Составить уравнения реакций, определить тип реакции:
а) оксид меди (II) + соляная кислота = хлорид меди (II) + вода
б) железо + нитрат меди (II) = нитрат железа (II) + медь
4. Решите задачу: определите массу фосфида магния (Mg3P2), которая может быть получена при взаимодействии 7,2 г магния с фосфором.
Вариант 2.
1. Перепишите названия и составьте формулы веществ:
нитрат калия, оксид железа (II), гидроксид бария, сульфат натрия, хлорид магния.
2. Перепишите формулы и дайте названия веществам:
К2SiO3, H2SO3, Са(OH)2, SO2, HNO3, FeCl2.
3. Составить уравнения реакций, определить тип реакции:
а) оксид цинка + соляная кислота = хлорид цинка + вода
б) алюминий + кислород = оксид алюминия
4. Решите задачу: определите массу фосфида магния (Mg3P2), которая может быть получена при взаимодействии 15,5 г фосфора с магнием.
Контрольная работа № 3
КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
ВАРИАНТ -1
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А 1. Группа формул веществ, включающая формулы основания, кислоты, соли и основного оксида
1 BaO, AlCl3, H3PO4, Pb(NO3)2 3) FeSO4 , SO2 , H2CO3, Fe(OH)2
2) CuO, H2SO3, KNO3, Ba(OH)2 4) Ca(OH)2 , NaCl, Na2S, Na2O
А 2. Формула хлорида хрома (III)
1) CrClO3 3) CrCl3
2) CrOHCl2 4) CrCl2
А 3. Изменение свойств оксидов от основных к кислотным происходит в ряду веществ с формулами:
1) SO3 — MgO —Al2O3 3) P2O5 — Li2O — SiO2
2) MgO — Al2O3 — SiO2 4) Li2O — P2O5 — CаO
А 4. Пара формул веществ, реагирующих с оксидом кальция:
1) Ca (OH)2, H2O 3) HCl, NaOH
2) NaCl, K 2O 4) CO2, HCl
А 5. Металл, реагирующий с водным раствором сульфата меди (II):
1) Цинк 2) Платина 3) Ртуть 4) Серебро
А 6. Верны ли следующие высказывания?
А. В уравнении реакции: Х + 2HNO3 = 2KNO3 + H2O
веществом Х является вещество с формулой K2O
Б. В уравнении реакции: Х + 2HNO3 = 2KNO3 + H2O
веществом Х является вещество с формулой K
1) верно только А 3) верно только Б
2) верны оба суждения 4) оба суждения не верны
Часть 2.
В задании В1 на установление соответствия запишите последовательность цифр без пробелов и других символов.
В1. Установите соответствие между формулой гидроксида и соответствующего ему оксида.
ФОРМУЛА ГИДРОКСИДА ФОРМУЛА ОКСИДА
А. H3PO4 1. SO2
Б. Fe(OH)3 2. FeO
В. H2SO4 3. Fe2O3
Г. Ba(OH)2 4. BaO
5. P2O5
6. SO3
Ответом к заданию В 2 является последовательность цифр в порядке возрастания.
В 2. Вещества, реагирующие с раствором серной кислоты:
1. Zn 4. NaOH
2. Ba(OH)2 5. Cu
3. CO2 6. MgO
В 3. Вещества, реагирующие с раствором гидроксида бария:
1. Соляная кислота 4. Оксид меди (II)
2. Сульфат калия 5. Оксид серы (IV)
3. Гидроксид калия 6. Нитрат натрия
Часть 3
Запишите номер задания и полное решение
С 1. Предложите не менее трех способов получения хлорида цинка. Составьте уравнения реакций в молекулярном и ионном виде, укажите тип реакций.
Контрольная работа № 3
КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
ВАРИАНТ - 2
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А 1. Группа формул веществ, включающая формулы основания, кислоты, соли и основного оксида
1). HCl , SO3 , NaNO3, Ca(OH)2 3). CuCl2, К2О, NaNO3, Ca(OH)2
2). CuCl2, H3PO4, KOH, CO2 4). HNO3, FeS, Cu(OH)2, FeO
А 2. Формула хлорида железа (III)
1). FeCl2 3). FeCl3
2). FeSO4 4). FeOHCl
А 3. Изменение свойств оксидов от кислотных к основным происходит в ряду веществ с формулами:
1) P2O5 — Al2O3 — MgO 3) Al2O3— SiO2 — MgO
2) CaO — CO2 — Al2 O3 4) P2O5 — MgO — SiO2
А 4. Пара формул веществ, реагирующих с оксидом углерода (IV):
1) H2O, P2O5 3) К2 О, О2
2) NaOH, H2O 4) Ca(OH)2, H2SO4
А 5. Металл, реагирующий с водным раствором нитрата железа (II):
1) Алюминий 2) Золото 3) Медь 4) Платина
А 6. Верны ли следующие высказывания?
А. В уравнении реакции: CaO + X = CaSO4 + H2O
веществом Х является вещество с формулой H2SO3.
Б. В уравнении реакции: CaO + X = CaSO4 + H2O
веществом Х является вещество с формулой H2SO4.
1) верно только А 3) верно только Б
2) верны оба суждения 4) оба суждения не верны
Часть 2.
В задании В1 на установление соответствия запишите последовательность цифр без пробелов и других символов.
В 1. Установите соответствие между формулой оксида и соответствующего ему гидроксида.
ФОРМУЛА ОКСИДА ФОРМУЛА ГИДРОКСИДА
А. Fe2O3 1. Н2СО3
Б. CO2 2. Fe(OН)3
В. CaO 3. Fe(OH)2
Г. P2O5 4. Ca(OH)2
5. H3 PO4
6. H PO2
Ответом к заданию В 2 является последовательность цифр в порядке возрастания.
В 2. Металлы, реагирующие с раствором разбавленной серной кислоты:
1. Mg 4. Al
2. Zn 5. Cu
3. Ag 6. Fe
В 3. Вещества, реагирующие с раствором гидроксида калия:
1. Серная кислота 4. Нитрат натрия
2. Гидроксид магния 5. Хлорид меди (II)
3. Оксид фосфора (V) 6. Оксид железа (II)
Часть 3
Запишите номер задания и полное решение
Предложите не менее трех способов получения фосфата натрия. Составьте уравнения реакций в молекулярном и ионном виде, укажите тип реакций.
Контрольная работа № 3
КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
ВАРИАНТ - 4
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А 1. Группа формул веществ, включающая формулы представителей четырех классов неорганических соединений;
1) HNO3, CaO, Na2S, KOH 3) MgO, HCl, Cu(OH)2, CO2
2) Al2O3, H2SO4, LiOH, HBr 4) HCl , CaSO3 , NaNO3, Ca(OH)2
А 2. Формула хлорида меди (II):
1) CuCl2 3) CuCl
2) CuS 4) CuI2
А 3. Изменение свойств оксидов от основных к кислотным происходит в ряду веществ с формулами:
1) SiO2 —MgO — P2O5 3) MgO — SiO2 —P2O5
2) P2 O5 — MgO — Li2 O 4) CaO — CO2 — Al2 O3
А 4 Пара формул веществ, реагирующих с оксидом лития:
1) H2O, CaO 3) NaOH, HCl
2) NaOH, H2O 4) CO2, H2SO4
А 5. Металл, реагирующий с водным раствором хлорида железа (II):
А. Платина Б. Серебро В. Цинк Г. Медь
А 6. Верны ли следующие высказывания?
А. В уравнении реакции: Х + H2SO4 = CuSO4 + H2O
веществом Х является вещество с формулой CuO:
Б. В уравнении реакции: Х + H2SO4 = CuSO4 + H2O
веществом Х является вещество с формулой Cu2O:
1) верно только А 3) верно только Б
2) верны оба суждения 4) оба суждения не верны
Часть 2.
В задании В1 на установление соответствия запишите последовательность цифр без пробелов и других символов.
В 1. Установите соответствие между формулой гидроксида и соответствующего ему оксида.
ФОРМУЛА ГИДРОКСИДА ФОРМУЛА ОКСИДА
А. KOH 1. Cu O
Б. Cu(OH)2 2. CrO3
В. Cr(OH)3 3. Cr2 O3
Г. H2CrO4 4. CuO
5. K2O
6. Cu2O
Ответом к заданию В 2 является последовательность цифр в порядке возрастания.
В 2. Вещества, реагирующие с разбавленной серной кислотой:
1. Hg 4. CO2
2. HCl 5. NaOH
3. Mg 6. BaCl2
В 3. Вещества, реагирующие с раствором гидроксида кальция:
1. Вода 4. Оксид серы (IV)
2. Азотная кислота 5. Углекислый газ
3. Оксид магния 6. Сульфат меди
Часть 3
Запишите номер задания и полное решение
Предложите не менее трех способов получения хлорида кальция. Составьте уравнения реакций в молекулярном и ионном виде, укажите тип реакций.
Контрольная работа №4 .
ИТОГОВАЯ КОНТРОЛЬНАЯ РАБОТА ЗА КУРС 8 КЛАССА
ВАРИАНТ -1
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А 1. Число атомов всех химических элементов в молекуле серной кислоты равно:
1) 3 2) 4 3) 7 4) 6
А 2. Число протонов, нейтронов и электронов в атоме фтора 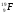 1) p+ – 9; n0 – 10; ē - 19 3) p+ – 9; n0 – 10; ē - 9
1) p+ – 9; n0 – 10; ē - 19 3) p+ – 9; n0 – 10; ē - 9
2) p+ – 10; n0 – 9; ē - 10 4) p+ – 9; n0 – 9; ē - 19
А 3. Группа формул веществ с ковалентным типом связи:
1) H2S, P4, CO2 3) HCl, NaCl, H2O
2) H2, Na, CuO 4) CaO, SO2, CH4
А 4. Вещество, при растворении которого в воде электролитической диссоциации практически не происходит:
1) гидроксид натрия 3) хлорид серебра
2) сульфат калия 4) нитрат алюминия
А 5. Одновременно могут находиться в растворе ионы:
1) Na+, H+, Ba2+, OH- 3) Mg2+, K+, NO3-, SO42 -
2) Fe2+, Na+, OH- , SO42- 4) Ca2+, H+, CO32-, Cl -
А 6. Верны ли следующие высказывания?
А. Оксид углерода (IV) – кислотный оксид
Б. Оксид натрия – основный оксид.
1) верно только А 3) верно только Б
2) верны оба суждения 4) оба суждения не верны
Часть 2.
В задании В1 на установление соответствия запишите последовательность цифр без пробелов и других символов.
В1. Установите соответствие между формулой вещества и классом соединения:
Формула вещества: Класс соединения:
А) MgO 1) соль
Б) H2SO4 2) основный оксид
В) KOH 3) нерастворимое основание
Г) Ba(NO3)2 4) кислотный оксид
5) кислота
6) растворимое основание
Ответом к заданию В 2 является последовательность цифр в порядке возрастания.
В 2. В реакцию с раствором серной кислоты вступают:
1) медь 4) магний
2) оксид меди (II) 5) хлорид бария
3) гидроксид натрия 6) оксид серы (IV)
Часть 3
Запишите номер задания и полное решение
C1. Составьте уравнения химических реакций согласно схеме
Fe → FeCl2 → Fe(OH)2 → FeO → Fe
Назовите все вещества, укажите тип реакции.
ИТОГОВАЯ КОНТРОЛЬНАЯ РАБОТА ЗА КУРС 8 КЛАССА
ВАРИАНТ -2
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А 1. Число атомов всех химических элементов в молекуле фосфорной кислоты равно:
1) 3 2) 6 3) 10 4) 8
А 2. Число протонов, нейтронов и электронов в атоме хлора 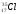
1) p+ – 18; n0 – 18; ē - 18 3) p+ – 17; n0 – 18; ē - 18
2) p+ – 17; n0 – 17; ē – 17 4) p+ – 17; n0 – 18; ē - 17
А 3. Группа формул веществ с ионным типом химической связи:
1) Na2S, KCl, HF 3) CO2, BaCl2, NaOH
2) K2O, NaH, NaF 4) Ca, O2, AlCl3
А 4.Вещество, которое в водном растворе полностью диссоциирует:
1) оксид меди 3) сульфат бария
2) нитрат калия 4) гидроксид железа (III)
А 5. Одновременно не могут находиться в растворе ионы:
1) H+, Ba2+, OH- , NO3- 3) Zn2+, K+, Cl -, SO42 -
2) Fe2+, Na+, NO3 - , SO42- 4) K+, Na+, OH-, Cl -
А 6. Верны ли следующие высказывания?
А. Оксид фосфора (V) – кислотный оксид
Б. Соляная кислота – одноосновная кислота
1) верно только А 3) верно только Б
2) верны оба суждения 4) оба суждения не верны
Часть 2.
В задании В1 на установление соответствия запишите последовательность цифр без пробелов и других символов.
В1. Установите соответствие между формулой вещества и классом соединения:
Формула вещества: Класс соединения:
А) Н3РО4 1) соль
Б) SO3 2) основный оксид
В) Сu(OH)2 3) нерастворимое основание
Г) CaCl2 4) кислотный оксид
5) кислота
6) растворимое основание
Ответом к заданию В 2 является последовательность цифр в порядке возрастания.
В 2. С раствором гидроксида натрия реагируют:
1) сульфат меди (II) 4) азотная кислота
2) оксид меди (II) 5) магний
3) гидроксид калия 6) оксид углерода (IV)
Часть 3
Запишите номер задания и полное решение
C1. Составьте уравнения химических реакций согласно схеме
Fe(OH)3 → Fe2O3 → Fe → FeSO4 → Fe(OH)2
Назовите все вещества, укажите тип реакции.
ИТОГОВАЯ КОНТРОЛЬНАЯ РАБОТА ЗА КУРС 8 КЛАССА
ВАРИАНТ -3
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А 1. Число атомов всех химических элементов в молекуле азотной кислоты равно:
1) 3 2) 4 3) 7 4) 5
А 2. Число протонов, нейтронов и электронов в атоме калия 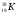 :
:
1) p+ – 19; n0 – 20; ē - 19 3) p+ – 20; n0 – 19; ē - 20
2) p+ – 19; n0 – 20; ē - 39 4) p+ – 19; n0 – 19; ē - 19
А 3. Группа формул веществ с ковалентным типом связи:
1) BaCl2, Cl2, SO3 3) NaOH, NH3, HF
2) H2, Ca, ZnCl2 4) N2, H2O, SO2
А 4.Вещество, при растворении которого в воде электролитической диссоциации практически не происходит:
1) гидроксид меди (II) 3) нитрат цинка
2) серная кислота 4) хлорид магния
А 5. Одновременно могут находиться в растворе ионы:
1) К+, Cl-, Сa2+, CO32- 3) Mg2+, H+, NO3-, CO32 -
2) Al3+, Na+, NO3 - , SO42- 4) Fe3+, H+, OH-, Cl -
А 6. Верны ли следующие высказывания?
А. Серная кислота - двухосновная
Б. Оксид калия – основный оксид.
1) верно только А 3) верно только Б
2) верны оба суждения 4) оба суждения не верны
Часть 2.
В задании В1 на установление соответствия запишите последовательность цифр без пробелов и других символов.
В1. Установите соответствие между формулой вещества и классом соединения:
Формула вещества: Класс соединения:
А) LiOH 1) соль
Б) SO2 2) основный оксид
В) HNO3 3) нерастворимое основание
Г) CaCO3 4) кислотный оксид
5) кислота
6) растворимое основание
Ответом к заданию В 2 является последовательность цифр в порядке возрастания.
В 2. В реакцию с раствором соляной кислоты вступают:
1) цинк 4) карбонат натрия
2) гидроксид магния 5) хлорид бария
3) оксид натрия 6) оксид серы (VI)
Часть 3
Запишите номер задания и полное решение
C1. Составьте уравнения химических реакций согласно схеме
Na → NaOH → Cu(OH)2 → CuO → Cu
Назовите все вещества, укажите тип реакции.
ИТОГОВАЯ КОНТРОЛЬНАЯ РАБОТА ЗА КУРС 8 КЛАССА
ВАРИАНТ -4
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А 1. Число атомов всех химических элементов в молекуле сернистой кислоты
1) 3 2) 7 3) 5 4) 6
А 2. Число протонов, нейтронов и электронов в атоме натрия 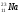
1) p+ – 11; n0 – 12; ē - 23 3) p+ – 11; n0 – 11; ē - 11
2) p+ – 12; n0 – 11; ē - 12 4) p+ – 11; n0 – 12; ē - 11
А 3. Группа формул веществ с ионным типом связи:
1) ВаО, Na2S, MgCl2 3) BaS, SO2, CaF2
2) Na2O, NaCl, HCl 4) BaO, ZnO, HCl
А 4.Вещество, при растворении которого в воде электролитической диссоциации практически не происходит:
1) нитрат бария 3) серная кислота
2) хлорид серебра 4) фосфат железа (II)
А 5. Одновременно не могут находиться в растворе ионы:
1) K+, Al3+, Cl-, NO3- 3) Na+, Ba2+, Cl-, CO32 -
2) H+, Mg2+, NO3- , SO42- 4) Ca2+, H+, NO3-, Cl -
А 6. Верны ли следующие высказывания?
А. Азотная кислота – кислородсодержащая.
Б. Соляная кислота – кислородсодержащая.
1) верно только А 3) верно только Б
2) верны оба суждения 4) оба суждения не верны
Часть 2.
В задании В1 на установление соответствия запишите последовательность цифр без пробелов и других символов.
В1. Установите соответствие между формулой вещества и классом соединения:
Формула вещества: Класс соединения:
А) Zn(OH)2 1) соль
Б) H2SO3 2) основный оксид
В) NaCl 3) нерастворимое основание
Г) CaO 4) кислотный оксид
5) кислота
6) растворимое основание
Ответом к заданию В 2 является последовательность цифр в порядке возрастания.
В 2. С раствором гидроксида кальция реагируют:
1) серная кислота 4) медь
2) оксид углерода (IV) 5) хлорид натрия
3) карбонат натрия 6) оксид калия
Часть 3
Запишите номер задания и полное решение
C1. Составьте уравнения химических реакций согласно схеме
HCl → ZnCl2 → Zn(OH)2 → Zn(NO3)2
ZnO
Назовите все вещества, укажите тип реакции.
Контрольно-измерительные материалы
для 9 класса
 Спецификация
Спецификация
| Название раздела | № задания | Тип задания |
| Строение атома | А1 | Задание с выбором ответа Задание с кратким ответом |
| Взаимосвязь строение атома и свойств химических элементов | А2, В1 | Задание с выбором ответа Задание с кратким ответом |
| Химическая связь | А3 | Задание с выбором ответа |
| Степень окисления химических элементов | А4 | Задания с выбором ответа |
| Классификация неорганических соединений | А5, В2 | Задание с выбором ответа Задание с кратким ответом |
| Типы химических реакций (соединение, разложение, замещение, обмена), окислительно-восстановительные реакции | А6 | Задание с выбором ответа |
| Химические свойства оксидов | А7 | Задание с выбором ответа |
| Химические свойства кислот и солей | А8 | Задание с выбором ответа |
| Электролитическая диссоциация, сильные и слабые электролиты | А9 | Задание с выбором ответа |
| Вычисление массовой доли химического элемента в веществе | А10 | Задание с выбором ответа |
| Окислительно-восстановительные реакции, окислитель и восстановитель | С1 | Задание с развернутым ответом |
Входной контроль по неорганической химии (9 класс).
Спецификация.
Назначение работы: проверка остаточных знаний по курсу неорганической химии, подготовка школьников к итоговой аттестации в 9 классе по химии.
Документы, определяющие содержание работы:
Обязательный минимум содержания основного общего образования по химии.
Федеральный компонент государственного стандарта общего и базового среднего образования.
Структура контрольной работы
В работе выделены три части, которые различаются по содержанию и степени сложности включаемых в них заданий.
Часть А включает 10 заданий с выбором ответа, содержание которых в целом охватывает основные вопросы органической химии, изучаемые в 8 классе. Их обозначение в работе А1, А2, А3… А10 (уровень сложности базовый). Выполнение этих заданий позволяет оценить подготовку учащихся на базовом уровне.
Часть В включает 2заданий повышенной сложности с кратким свободным ответом. Их обозначение в работе В1, В2.
Часть С содержит 2 задания с развернутым свободным ответом (уровень сложности – высокий).
Задания контрольной работы ориентированы на проверку элементов содержания трех содержательных блоков: «Вещество», «Химическая реакция», «Познание и применение веществ человеком».
Кодификатор элементов содержания, используемый для составления КИМ.
| код блока | код элемента | элементы содержания, проверяемые заданиями КИМ | № задания |
| 1 | 1.1 | Строение атома. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева | А2 |
| 1 | 1.2 | Периодический закон и Периодическая система химических элементов Д.И. Менделеева | А2 |
| 1 | 1.2.2 | Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов Д.И. Менделеева | А4 |
| 1 | 1.3 | Строение веществ. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая | А3 |
| 1 | 1.4 | Валентность химических элементов. Степень окисления химических элементов | А7 |
| 1 | 1.6 | Атомы и молекулы. Химический элемент. Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических соединений | А1 В2 |
| 2 | 2.1 | Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях | А10 В1 |
| 2 | 2.2 | Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению теплоты | А8 |
| 2 | 2.5 | Реакции ионного обмена и условия их осуществления | А5 |
| 2 | 2.6 | Окислительно-восстановительные реакции. Окислитель и восстановитель | А9 |
| 2 | 3.3 | Взаимосвязь различных классов неорганических веществ | А6 С2 |
| 3 | 4.5 | Проведение расчетов на основе формул и уравнений реакций | С1 |
Проверяемые виды деятельности:
Называть и определять вещества, их свойства, признаки и классификации веществ, типы реакций и др.
Составлять формулы веществ, уравнения химических реакций.
Характеризовать свойства и применение веществ.
Объяснять закономерности в изменении свойств веществ, сущности химических реакций.
Проводить вычисления по химическим формулам и уравнениям.
Время выполнения работы – 45 минут.
Система оценивания.
Верное выполнение каждого задания части А оценивается 1 баллом, части В –1-2 баллами. Задание части С имеет пять элементов содержания, каждый из которых оценивается в 1 балл, а задание в целом – в 5 баллов.
Оценка за выполнение работы определяется по пятибалльной шкале:
от 29 до 39 баллов – оценка 5,
от 20 до 28 баллов – оценка 4,
от 12 до 19 баллов – оценка 3,
менее 12 баллов – оценка 2.
Дополнительные материалы
Периодическая система химических элементов Д.И.Менделеева.
Таблица растворимости солей, кислот и оснований в воде.
Электрохимический ряд напряжений металлов.
Калькулятор.
Контрольная работа по неорганической химии (входной контроль).
1 вариант
Инструкция для учащихся
Тест состоит из частей А, В и С. На его выполнение отводится 45 минут. Задания рекомендуется выполнять по порядку. Если задание не удается выполнить сразу, перейдите к следующему. Если останется время, вернитесь к пропущенным заданиям.
Часть А
К каждому заданию части А даны несколько ответов, из которых только один верный. Выберите верный, по Вашему мнению, ответ.
А1. Число атомов всех химических элементом в молекуле Н3Р04
1) 8 2) 5 3) 4 4) 3
А2. Схема распределения электронов по энергетическим уровням химического элемента, образующего соединения, соответствующие общим формулам ЭН3 и Э2O5,
1) 2ё, 3ё 3) 2ё, 8ё, 3ё
2) 2ё, 5ё 4) 2ё, 8ё, 7ё
А3. Группа формул веществ с ионной связью
1) НСl, СаСl2, H2SO4 3) КОН, H2S, Н2CO3,
2) HI, Р2O5, Н3РO4 4) KNO2, NaOH, МgO
А4. Ряд элементов, расположенных в порядке уменьшения атомного радиуса,
1) А1 Si Р 3) О N С
2) F С1 Вг 4) В А1 Ga
А5. Реакция обмена идёт до конца между растворами следующих веществ
1) хлоридом аммония и серной кислотой 3) серной кислотой и гидроксидом калия
2) сульфатом натрия и азотной кислотой 4) нитратом бария и хлоридом калия
А6. Формула вещества X в цепочке превращений Ва — ВаО — X — ВаСО3
1) BaSО4 2) Ва(ОН)2 3) ВаС12 4) Ba(NO3)2
А7. Валентность углерода в соединениях СО, СO2, СН4 соответственно равна
1) I, II, IV 3) I, II, I
2) II, IV, IV 4) II, II, IV
A8. Характеристика реакции, уравнение которой Mg + 2НСl = MgCl2 + H2
1) соединения, экзотермическая, ОВР
2) разложения, эндотермическая, ОВР
3) замещения, эндотермическая, не ОВР
4) замещения, экзотермическая, ОВР
А9. Окислителем в уравнении реакции коррозии железа 4Fe + 3O2 + 6Н2O = 4Fe(OH)3 является
1) Fe0 2) 020 3) Н+1 4) О-2
А10. Верны ли суждения о свойствах кислот?
А. При взаимодействии раствора соляной кислоты с медью образуется хлорид меди и газ водород.
Б. Кислоты реагируют со всеми основаниями с образованием соли и воды.
1) верно только А 3) верны оба суждения
2) верно только Б 4) оба суждения неверны
Часть В
Ответом к заданиям этой части(В1-В2) является последовательность цифр или число, которые следует записать в бланк ответов №1 справа от номера соответствующего задания, начиная с первой клеточки.
В1. Вещества, с которыми реагирует оксид бария
1) хлорид натрия 4) гидроксид натрия
2) вода 5) оксид углерода (II)
3) соляная кислота
В2. Установите соответствие между формулой вещества и классом соединений, к которым оно относится.
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС СОЕДИНЕНИЙ |
| А) HNO3 Б) CO2 В) CaO | 1) основание 2) кислотный оксид 3) кислота 4) основный оксид 5) соль |
Часть С
С1. Рассчитайте объём водорода, который мы делится при взаимодействии алюминия массой 10,4 г с избытком раствора соляной кислоты.
С2. Металл натрий сожгли в колбе, заполнен ной газом жёлто-зелёного цвета. К водному раствору полученного продукта добавили раствор нитрата серебра, при этом образовался белый творожистый осадок.
Составьте уравнения проведённых химических реакций.
Ответы и решения. (1 вар)
| А1 | А2 | А3 | А4 | А5 | А6 | А7 | А8 | А9 | А10 | | 1 | 2 | 4 | 1 | 3 | 2 | 2 | 4 | 2 | 2 | |
|
|
|
|
|
|
|
|
|
| | В1 | В2 |
|
|
|
|
|
| С1 | С2 | | 235 | А3 Б2 В4 |
|
|
|
|
|
|
|
|
|
|
|
|
Содержание верного ответа задания С 1 и указания по его оцениванию |
Баллы |
| Элементы ответа: |
|
| Ответ правильный и полный, включает все названные выше элементы | 5 |
| Правильно записаны 4 элемента ответа | 4 |
| Правильно записаны 3 элемента ответа | 3 |
| Правильно записано 2 элемента ответа | 2 |
| Правильно записан 1 элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Содержание верного ответа задания С 2 и указания по его оцениванию |
Баллы |
| Элементы ответа: Приведены уравнения реакций, соответствующие схеме: |
|
| Ответ правильный и полный, включает все названные выше элементы | 5 |
| Правильно записаны 4 уравнения реакций | 4 |
| Правильно записаны 3 уравнения реакций | 3 |
| Правильно записаны 2 уравнения реакций | 2 |
| Правильно записано 1 уравнение реакции | 1 |
| Все элементы ответа записаны неверно | 0
|
Контрольная работа по неорганической химии (входной контроль)
2вариант
Инструкция для учащихся
Тест состоит из частей А, В и С. На его выполнение отводится 45 минут. Задания рекомендуется выполнять по порядку. Если задание не удается выполнить сразу, перейдите к следующему. Если останется время, вернитесь к пропущенным заданиям.
Часть А
К каждому заданию части А даны несколько ответов, из которых только один верный. Выберите верный, по Вашему мнению, ответ.
А1. Число атомов всех химических элементов в формульной единице A12(SО4)3
1) 5 2) 7 3)12 4) 17
А2. Схема распределения электронов по энергетическим уровням химического элемента, образующего соединения, соответствующие общим формулам ЭН4 и ЭO2,
1) 2ё, 4ё 3) 2ё, 8ё, 2ё
2) 2ё, 6ё 4) 2ё, 8ё, 6ё
А3. Группа формул веществ с ковалентной полярной связью
1) НС1, СаС12, Н2 3) HI, Р2О5, SF6
2) КОН, H2S, СО2 4) KNО2, РН3, MgO
А4. Ряд элементов, расположенных в порядке ослабления неметаллических свойств,
1) В C N 3) А1 Si Р
2) F С1 Вг 4) С N О
А5. Вещества, между растворами которых возможна реакция обмена
1) нитрат натрия и карбонат калия 3) карбонат натрия и азотная кислота
2) фосфорная кислота и хлорид натрия 4) сульфат алюминия и соляная кислота
А6. Формула вещества Х в цепочке превращений Cu CuO X Cu(OH)2
1) Сu2O 3) СuS
2) СuSО4 4) СаО и Н2О
А7. Валентность серы в соединениях H2S, SO2, SO3 соответственно равна
1) II, III, IV 3) IV, V, VI
2) II, IV, VI 4) IV, VI, II
A8. Характеристика реакции, уравнение которой Cu(OH)2 -- CuO + H20
1) соединения, ОВР, эндотермическая
2) разложения, не ОВР, эндотермическая
3) разложения, ОВР, экзотермическая
4) замещения, не ОВР, экзотермическая
А9. Уравнению реакции 2NO + О2 = 2NО2 соответствует схема превращения
1) N+2 N+5 3) N+3 N+2
2) N+4 N0 4) N+2 N+4
А10. Верны ли суждения об основаниях?
А. Щёлочи реагируют с кислотными оксидами и кислотами с образованием соли и воды.
Б. Нерастворимые в воде основания при умерен ном нагревании разлагаются.
1) верно только А 3) верны оба суждения
2) верно только Б 4) оба суждения неверны
Часть В
Ответом к заданиям этой части( В1-В2) является последовательность цифр или число, которые следует записать в бланк ответов №1 справа от номера соответствующего задания, начиная с первой клеточки.
В1. Вещества, с которыми реагирует соляная кислота
1) сульфат натрия 4) гидроксид натрия
2) медь 5) оксид углерода (IV)
3) нитрат серебра
В2. Установите соответствие между формулами веществ и классом соединений, к которым они относятся.
| ФОРМУЛЫ ВЕЩЕСТВ | КЛАСС СОЕДИЕНИЙ |
| А) NaOH Б) HBr В) K3PO4 | 1) соль 2) кислотный оксид 3) кислота 4) основный оксид 5) основание |
Часть С
С1. Рассчитайте объем кислорода, необходимый для сжигания фосфора массой 15,5 г.
С2. Через известковую воду пропустили оксид углерода (IV). Выпавший осадок отделили и прокалили. Как называется полученное вещество? Напишите уравнения химических реакций соответствующих превращений
Ответы и решения. (2вар)
| А1 | А2 | А3 | А4 | А5 | А6 | А7 | А8 | А9 | А10 | |
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| | В1 | В2 |
|
|
|
|
| С1 | С2 |
| |
|
|
|
|
|
|
|
|
|
|
|
| Содержание верного ответа задания С 1 и указания по его оцениванию |
Баллы |
| Элементы ответа: |
|
| Ответ правильный и полный, включает все названные выше элементы | 5 |
| Правильно записаны 4 элемента ответа | 4 |
| Правильно записаны 3 элемента ответа | 3 |
| Правильно записано 2 элемента ответа | 2 |
| Правильно записан 1 элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Содержание верного ответа задания С 2 и указания по его оцениванию |
Баллы |
| Элементы ответа: Приведены уравнения реакций, соответствующие схеме: -
|
|
| Ответ правильный и полный, включает все названные выше элементы | 5 |
| Правильно записаны 4 уравнения реакций | 4 |
| Правильно записаны 3 уравнения реакций | 3 |
| Правильно записаны 2 уравнения реакций | 2 |
| Правильно записано 1 уравнение реакции | 1 |
| Все элементы ответа записаны неверно
| 0
|
Инструкция по выполнению работы
На выполнение контрольной работы по химии отводится 45 минут.
Работа состоит из трех частей, включающих 13 заданий.
Часть первая (А) содержит 10 заданий. К каждому заданию этой части дается 4 варианта ответа, из которых только один правильный.
Часть вторая (В) содержит 2 задания:
В1 – закономерности изменения строения и свойств элементов в связи с положением в периодической системе химических элементов
В2 – на установление соответствия названия вещества и класса соединений.
Часть третья содержит одно самое сложное задание (С1), требующее полного свободного ответа.
Внимательно прочитайте каждое задание и предлагаемые варианты ответа. Отвечайте только после того, как вы поняли вопрос и проанализировали все варианты ответа.
Выполняйте задания в том порядке, в котором они даны. Если какое-то задание вызывает у вас затруднение, пропустите его и постарайтесь выполнить те, в ответах на которые вы уверены. К пропущенным заданиям сможете вернуться, если у вас останется время.
За выполнение различных по сложности заданий дается от одного до трех баллов.
Постарайтесь выполнить как можно больше заданий и набрать наибольшее число баллов.
Желаем успеха!
Вариант 1.
А 1. Атому серы в степени окисления +6 соответствует электронная схема:
1) 2 ē 8 ē 6 ē 3) 2 ē 8 ē 8 ē
2) 2 ē 8 ē 2 ē 4) 2 ē 8 ē
А 2. Элемент с наиболее ярко выраженными металлическими свойствами:
1) алюминий 3) магний
2) литий 4) калий
А 3. В молекуле Br2 химическая связь:
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
А 4. Степени окисления атомов марганца в соединениях MnO, MnO2, Mn2O7 последовательно записаны в ряду:
1) +7, +2, +4 3) +4, +2, +7
2) +2, +4, +7 4) +2, +7, +4
А 5. Только кислоты расположены в ряду:
1) NaCl, H2S, HCl
2) HNO3, HF, H2SO4
3) H2SO3, KBr, HNO3
4) HCl, SO2, NaNO3
А 6. Из перечисленных реакций одновременно окислительно-восстановительной и реакцией соединения является:
1) BaO + SO2 = BaSO3
2) Zn + 2HCl = ZnCl2 + H2
3) 2HI = H2 + I2
4) 4Al + 3O2 = 2Al2O3
А 7. Оксид серы (VI) реагирует с каждым из пары веществ, формулы которых:
1) H2O и MgO 3) SiO2 и Mg(OH)2
2) KNO3 и HCl 4) HCl и Fe
А 8. С разбавленной серной кислотой не взаимодействует:
1) железо 3) медь
2) оксид железа (II) 4) оксид меди (II)
А 9. К сильным электролитам относится каждое из двух оснований, формулы которых:
1) Ba (OH)2 и Fe (OH)2
2) Ca (OH)2 и Mg (OH)2
3) Ca (OH)2 и NaOH
4) NH4OH и KOH
А 10. Массовая доля (в %) хлора в хлориде магния составляет:
1) 25,3 3) 57,6
2) 74,7 4) 36,8
В 1. Способность атомов химических элементов отдавать электроны увеличивается в ряду:
1) Be, Mg, K, Na 3) K, Ca, Mg, Be
2) Rb, K, Na, Li 4) Li, Na, K, Rb
В2. Установите соответствие между названием вещества и классом неорганических соединений, к которому оно принадлежит:
Название вещества Класс соединений
1) гидрокарбонат натрия А) бескислородная кислота
2) серная кислота Б) щелочь
3) гидроксид алюминия В) кислотный оксид
4) оксид серы (VI) Г) амфотерный гидроксид
Д) кислородсодержащая кислота
Е) кислая соль
Ответ оформите в таблице:
| название вещества | 1 | 2 | 3 | 4 |
| класс соединений |
|
|
|
|
С 1. Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления:
Fe2O3 + CO → Fe + CO2
Коэффициент перед формулой окислителя равен:
3
2
4
1
Контрольно-измерительные материалы
для проведения промежуточной (годовой) аттестации
по предмету химия
для 9 класса
Инструкция по выполнению работы
На выполнение контрольной работы по химии отводится 45 минут.
Работа состоит из трех частей, включающих 13 заданий.
Часть первая (А) содержит 10 заданий. К каждому заданию этой части дается 4 варианта ответа, из которых только один правильный.
Часть вторая (В) содержит 2 задания:
В1 – закономерности изменения строения и свойств элементов в связи с положением в периодической системе химических элементов
В2 – на установление соответствия названия вещества и класса соединений.
Часть третья содержит одно самое сложное задание (С1), требующее полного свободного ответа.
Внимательно прочитайте каждое задание и предлагаемые варианты ответа. Отвечайте только после того, как вы поняли вопрос и проанализировали все варианты ответа.
Выполняйте задания в том порядке, в котором они даны. Если какое-то задание вызывает у вас затруднение, пропустите его и постарайтесь выполнить те, в ответах на которые вы уверены. К пропущенным заданиям сможете вернуться, если у вас останется время.
За выполнение различных по сложности заданий дается от одного до трех баллов.
Постарайтесь выполнить как можно больше заданий и набрать наибольшее число баллов.
Желаем успеха!
Вариант 2
А 1. Иону Ca2+ соответствует электронная схема:
1) 2 ē 8 ē 8 ē 3) 2 ē 8 ē 8 ē 2 ē
2) 2 ē 8 ē 7 ē 4) 2 ē 8 ē 5 ē
А 2. Элемент с наиболее ярко выраженными неметаллическими свойствами:
1) олово 3) германий
2) кремний 4) углерод
А 3. В молекуле H2S химическая связь:
1) ионная 3) ковалентная неполярная
2) ковалентная полярная 4) металлическая
А 4. Степень окисления +4 атом углерода имеет в каждом из соединений
ряда:
CH4, Al4C3, CS2 3 )CCl4, Na2CO3, CO2
Na2CO3, CO, CCl4 4 )CO, CaCO3, C2H6
А 5. Только кислотные оксиды расположены в ряду:
1) SO2, Ca(OH)2, Na2O
2) Li2O, NaOH, NO
3) N2O5, HCl, P2O5
4) P2O5, CO2, SO3
А6. Из перечисленных реакций одновременно окислительно-восстановительной и реакцией разложения является:
1) CaCO3 = CaO + CO2
2) 2KNO3 = 2KNO2 + O2
3) 2H2 + O2 = 2H2O
4) Cu(OH)2 = CuO + H2O
А 7. Оксид кальция реагирует с каждым веществом ряда:
1) HNO3, H2O, P2O5
2) SiO2, HCl, LiOH
3) NaOH, Fe2O3, H2SO4
4) Al2O3, MgO, CO2
А 8. С растворами фосфорной кислоты и хлорида натрия взаимодействует:
1) гидроксид калия 2) нитрат кальция
3) нитрат серебра 4) нитрат бария
А 9. В водном растворе одновременно не могут присутствовать ионы:
1) Na+ и CO32-
2) Ca2+ и CO32-
3) H+ и Cl-
4) Ca2+ и Cl-
А 10. Массовая доля (в %) водорода в сероводороде равна:
1) 11,7
2) 2,94
3) 5,88
4) 17,6
В 1. В атомах щелочных металлов одинаковое число:
1) электронных энергетических уровней
2) электронов на втором энергетическом уровне
3) валентных электронов
4) протонов и нейтронов
В2. Установите соответствие между названием вещества и классом неорганических соединений, к которому оно принадлежит:
Название вещества Класс соединений
1) оксид углерода (IV) А) кислородсодержащая кислота
2) гидросульфат натрия Б) кислая соль
3) оксид кальция В) несолеобразующий оксид
4) карбонат меди (II) Г) кислотный оксид
Д) средняя соль
Е) основной оксид
Ответ оформите в таблице:
| название вещества | 1 | 2 | 3 | 4 |
| класс соединений |
|
|
|
|
С1. Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления:
SiO2 + Al → Si + Al2O3
Коэффициент перед формулой восстановителя равен:
2
4
6
3
Критерии оценивания
В работе выделены три части, которые различаются по содержанию и степени сложности включаемых в них заданий.
Часть А включает 10 заданий с выбором ответа, содержание которых в целом охватывает основные вопросы неорганической химии, изучаемые в 8-9 классах. Их обозначение в работе А 1, А 2, А 3… А 10 ( уровень сложности базовый). Выполнение этих заданий позволяет оценить подготовку учащихся на базовом уровне.
Часть В включает 2 задания повышенной сложности с кратким свободным ответом. Их обозначение в работе В 1, В 2.
Часть С содержит 1 задания с развернутым свободным ответом (уровень сложности – высокий).
Распределение заданий работы по частям:
| № | Части работы | Число заданий | Максимальный балл | Тип заданий |
| 1. | А | 10 | 10 | Задания с выбором ответа |
| 2. | В | 2 | 4 | Задания с кратким ответом |
| 3. | С | 1 | 3 | Задания с развернутым ответом |
|
| Итого | 13 | 17 |
|
Оценка «5» - 15-17 баллов
Оценка «4» - 11-14 баллов
Оценка «3» - 6-10 баллов
Оценка «2» - менее 6 баллов
Ключи к заданиям
1 вариант
| А1 | А2 | А3 | А4 | А5 | А6 | А7 | А8 | А9 | А10 |
| 4 | 4 | 3 | 2 | 2 | 4 | 1 | 3 | 3 | 2 |
|
|
|
|
|
|
|
|
|
|
|
|
| В1 | В2 |
|
|
|
|
| С1 |
|
|
| 4 | едгв |
|
|
|
|
| 4 |
|
2 вариант
| А1 | А2 | А3 | А4 | А5 | А6 | А7 | А8 | А9 | А10 |
| 1 | 4 | 2 | 3 | 4 | 2 | 1 | 3 | 2 | 3 |
|
|
|
|
|
|
|
|
|
|
|
|
| В1 | В2 |
|
|
|
|
| С1 |
|
|
| 3 | гбед |
|
|
|
|
| 2 |
|
Контрольно-измерительные материалы
10 класс
Контрольная работа №1 по теме «Углеводороды»
Вариант 1.
Опишите способы получения и химические свойства предельных углеводородов.
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений: СН4 –-------С2Н2---------- С6Н6--------С6Н5 NО2
Назовите все органические вещества.
Какой объем воздуха, содержащего 21% кислорода, потребуется для полного сжигания 11,2 г. смеси изомерных бутенов? Напишите структурные формулы всех возможных изомеров бутена и назовите их по международной номенклатуре.
Вариант 2.
Охарактеризуйте химические свойства этиленовых углеводородов.
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений: СН4------СН3Вr------С2Н6-------СН2= СН2.
Назовите все органические вещества.
При взаимодействии 4,6 г. толуола с избытком брома в присутствии катализатора получили 5,3г. п-бромтолуола. Определите выход продукта реакции от теоретически возможного. Какой изомер бромтолуола может также получиться при этом?
Вариант 3.
Укажите: а) способы получения ацетилена; б) особенности реакций присоединения по тройной связи.
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений: С2Н5ОН------ СН2= СН2------С 2Н5СI.
Назовите все органические вещества.
Массовая доля углерода в предельном углеводороде составляет 83,33%. Составьте структурные формулы всех изомеров данного углеводорода и назовите их.
Вариант 4.
Запишите уравнения реакций, с помощью которых из н-гексана можно получить бензол. Охарактеризуйте химические свойства бензола.
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений: СН2= СН2--- СН2Вr- СН2Вr---- С2Н2--- СН3СОН.
Назовите все органические вещества.
При сжигании углеводорода, плотность паров которого по водороду равна 28, образовалось 8,96л. углекислого газа и 7,2г. воды. Определите молекулярную формулу углеводорода и составьте структурные формулы всех его изомеров, если известно, что он содержит двойную связь.
Контрольная работа №2
по химии 10 класс
«Спирты, фенолы, альдегиды, карбоновые кислоты, эфиры, жиры»
Вариант №1
Определите классы соединений, дайте названия веществ, формулы которых:
А. С2Н5СОН. В. С2Н5СООСН3.
Б. НСООН. Г. СН3ОН.
2. Закончите уравнения реакций, назовите исходные вещества и продукты реакции.
А. СН3ОН + НСI =
Б. СН3 СОН + Аg2О =
В. СН3 СООН + NaОН =
3. Напишите уравнения реакций, при помощи которых можно осуществить превращения по схеме:
СН4—С2Н2-- СН3 СОН-- СН3 СООН—(СН3 СОО)2Мg
4. Решите задачу: Рассчитайте массу кислоты, полученной кислотным гидролизом 50 г. этилового эфира уксусной кислоты.
Контрольная работа №2
по химии 10 класс
«Спирты, фенолы, альдегиды, карбоновые кислоты, эфиры, жиры»
Вариант №2
Определите классы соединений, дайте названия веществ, формулы которых:
А. С3Н7СОН. В. С2Н5СООС2Н5.
Б. СН3 СООН. Г. С2Н5ОН.
2. Закончите уравнения реакций, назовите исходные вещества и продукты реакции.
А. С2Н5ОН + НСI =
Б. СН3 СН2СОН + Аg2О =
В. Н СООН + NaОН =
3. Напишите уравнения реакций, при помощи которых можно осуществить превращения по схеме:
СН4—СН3СI-- СН3 ОН-- Н СОН— Н СООН --(Н СОО)2Са
4. Решите задачу: Рассчитайте массу уксусной кислоты, необходимой для нейтрализации 20г. гидроксида натрия.
Итоговая контрольная работа №3
по органической химии за 10 класс
1-вариант
1. Составьте формулы веществ по названию. К веществу диэтиловый эфир напишите 2 изомера и 2 гомолога. Назовите их.
а) 2,3-диметил-3-хлорпентан, д) этиловый эфир уксусной кислоты
б) хлорциклобутан, е) 4-аминовалериановая кислота
в) метилбензол (толуол), ж) пропиламин
г) диэтиловый эфир
2. Осуществите превращения и укажите условия их протекания.
C2H5OH → C2H5COH → CH3COOH→ CH2Cl-COOH → NH2-CH2-COOH→ NH2-CH2-COONa
Выведите молекулярную формулу углеводорода ,массовая доля водорода в котором равна 25%, а его относительная плотность по кислороду – 0,5.
4.В трех пронумерованных пробирках находятся находятся растворы глицерина ,уксусной кислоты, формалина. Составьте план распознавания веществ. Напишите уравнения реакций ,при помощи которых можно идентифицировать эти вещества.
Итоговая контрольная работа №3
по органической химии за 10 класс
2-вариант
Составьте формулы веществ по названию. К веществу бутен-1напишите 2 изомера и 2гомолога . Назовите их.
Осуществите превращения и укажите условия их протекания.
C2H5OH → C2H5COH → CH3COOH→ CH2Cl-COOH → NH2-CH2- COOH→ NH2-CH2-COONa
3.Выведите молекулярную формулу углеводорода ,массовая доля водорода в котором равна 25%, а его относительная плотность по кислороду – 0,5.
4.В трех пронумерованных пробирках находятся находятся растворы фенола ,этиленгликоля, ацетата натрия. Составьте план распознавания веществ. Напишите уравнения.
Контрольно-измерительные материалы
11 класс
Контрольная работа № 1 по теме «Строение вещества»
Вариант 1.
Часть А
1. Пара элементов, между которыми образуется ионная химическая связь:
а) углерод и сера б) водород и азот в) калий и кислород г) кремний и водород
2. Наименее полярной является связь:
а) C-H б) C-Cl в) C-F г) C-Br
3.Вещество, в молекуле которого нет «пи-связи»:
а) этилен б) бензол в) аммиак г) азот
4. Атом углерода имеет степень окисления -3 и валентность 4 в соединении с формулой:
а) CO2 б) C2H6 в) CH3Cl г) CaC2
5. Атомную кристаллическую решётку имеет:
а) сода б) вода в) алмаз г) парафин
6.Вещество, между атомами которого существует водородная связь:
а) этан б) фторид натрия в) этанол г) углекислый газ
7. Группа формул соединений, в которых имеется только sp3-гибридизация:
а) CH4, C2H4, C2H2 б) NH3, CH4, H2O в) H2O, C2H6, C6H6 г) C3H8, BCl3, BeCl2
8. Между атомами есть ковалентная связь, образованная по донорно-акцепторному механизму в молекуле:
а) CH3NO2 б) NH4NO2 в) C5H8 г) H2O
Часть Б
1. Определите вид связи и напишите электронные и графические формулы веществ: C2H2, Br2, K3N.
2. Напишите реакцию полимеризации винилхлорида. Определите структурное звено и молекулярную массу полимера, если степень полимеризации равна 350.
3. Напишите все изомеры для вещества с формулой С4Н6 и назовите их.
11 класс
Контрольная работа № 1 по теме «Строение вещества»
Вариант 2.
Часть А
1. Пара элементов, между которыми образуется ковалентная полярная химическая связь:
а) натрий и сера б) водород и азот в) калий и кислород г) кальций и кремний
2. Наиболее полярной является связь:
а) C-H б) C-Cl в) C-F г) C-Br
3.Вещество, в молекуле которого есть «пи-связь»:
а) этилен б)метан в) циклогексан г) кислород
4. Атом углерода имеет степень окисления -1 и валентность 2 в соединении с формулой:
а) CO2 б) C2H6 в) CH3Cl г) CaC2
5. Молекулярную кристаллическую решётку имеет:
а) сода б) вода в) алмаз г) парафин
6.Вещество, между атомами которого существует водородная связь:
а) этан б) фторид натрия в)белок г) угарный газ
7. Группа формул соединений, в которых имеется sp2-гибридизация:
а) C4H8, C2H4, C3H6 б) NH3, CH4, H2O в) H2O, C2H6, C6H6 г) C3H8, BCl3, BeCl2
8. Между атомами есть ковалентная связь, образованная по донорно-акцепторному механизму в молекуле:
а) CH3NO2 б) NH4NO2 в) C5H8 г) H2O
Часть Б1. Определите вид связи и напишите электронные и графические формулы веществ: C2H2, Br2, K3N.
2. Напишите реакцию полимеризации полиэтилена. Определите структурное звено и молекулярную массу полимера, если степень полимеризации равна 360.
3. Напишите все изомеры для вещества с формулой С5Н8 и назовите их.
Контрольная работа №2
по теме «Вещества и их свойства».
Вариант 1.
1. Осуществите превращения и укажите условия их протекания (где необходимо):
С→ СН4 → С2Н2 → СО2 → К2СО3 → СаСО3 → СаНСО3 → СаСО3
2. Напишите уравнения реакций взаимодействия воды со следующими веществами и укажите условия их протекания (где необходимо):
а) с натрием б) с оксидом натрия в) оксидом фосфора (V) г) с метиловым эфиром уксусной кислоты д) с ацетиленом.
3. Получите хлорид железа (III) тремя возможными способами.
4. Выведите формулу фосфорсодержащей кислоты, массовая доля фосфора в котором 37,8 %, кислорода – 58,5 %, водорода – 3,7 %.
5. Какое количество вещества и какой соли образуется при нейтрализации 1моль гидроксида натрия 490 г 40 % раствором серной кислоты?
Контрольная работа №2
по теме «Вещества и их свойства».
Вариант 2.
1. Осуществите превращения и укажите условия их протекания (где необходимо):
С→ СН4 → С2Н2 → СО2 → Na2СО3 → NаHСО3 → Nа2СО3 → СаСО3
2. Напишите уравнения реакций взаимодействия воды со следующими веществами и укажите условия их протекания (где необходимо):
а) с калием б) с оксидом кальция в) оксидом азота (V) г) с этиловым эфиром уксусной кислоты д) с этиленом.
3. Получите сульфат железа (III) тремя возможными способами.
4. Выведите формулу соли, массовая доля кальция в котором 40%, углерода – 12%, кислорода – 48 %.
5. Какое количество вещества и какой соли образуется при нейтрализации 1моль гидроксида калия 500 г 40 % раствором серной кислоты?

МИНИСТЕРСТВО ОБРАЗОВАНИЯ, НАУКИ И МОЛОДЕЖИ РЕСПУБЛИКИ КРЫМ
АДМИНИСТРАЦИЯ ЧЕРНОМОРСКОГО РАЙОНА РЕСПУБЛИКИ КРЫМ
ОТДЕЛ ОБРАЗОВАНИЯ, МОЛОДЕЖИ И СПОРТА
МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«МЕЖВОДНЕНСКАЯ СРЕДНЯЯ ШКОЛА »
МУНИЦИПАЛЬНОГО ОБРАЗОВАНИЯ ЧЕРНОМОРСКИЙ РАЙОН РЕСПУБЛИКИ КРЫМ

ул. Ленина, 1А, с.Межводное, Черноморский район, Южный ФО, Республика Крым, 296420
e-mail:supershkola73@yandex.ru, тел. 98-132
Код ОГРН 1149102182206 ИНН 9110088413 КПП 911001001
Утверждаю
Директор школы
_________ Е.А.Черкашина
Приказ № 452 от 31.08.2018г.
КОНТРОЛЬНО-ИЗМЕРИТЕЛЬНЫЕ МАТЕРИАЛЫ
ПО ХИМИИ
(ПРИЛОЖЕНИЯ К РАБОЧИМ ПРОГРАММАМ ПО ХИМИИ)
2018/2019 УЧЕБНЫЙ ГОД
Составила:
Евдокимова Н.В.,
учитель химии
высшей квалификационной категории
Рассмотрено
На заседании МО учителей
естественного и обществоведческого циклов
____________ Гаврилова Л.Н.
__________2018г. протокол № ____
49







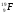 1) p+ – 9; n0 – 10; ē - 19 3) p+ – 9; n0 – 10; ē - 9
1) p+ – 9; n0 – 10; ē - 19 3) p+ – 9; n0 – 10; ē - 9 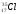
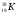 :
: 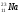
 Спецификация
Спецификация



















