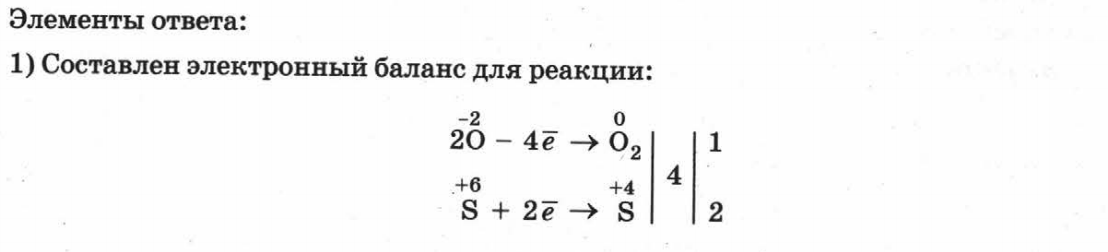МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«ЗОРКИНСКАЯ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА – ДЕТСКИЙ САД»
НИЖНЕГОРСКОГО РАЙОНА РЕСПУБЛИКИ КРЫМ
| РАССМОТРЕНО на заседании методического объединения учителей естественно- математического цикла Руководитель МО: ________ Суфан С.В. Протокол №_____от_______
|
|
|
ФОНД
ОЦЕНОЧНЫХ СРЕДСТВ
по химии
для 9 класса
Учитель-составитель: Турчин Дмитрий Викторович
с. Зоркино
2021 год
Паспорт
фонда оценочных средств
по химии в 9 классе
| № п/п | Контролируемые разделы (темы) дисциплины* | Наименование оценочного средства
|
| Многообразие химических реакций | Контрольная работа№1 |
| Неметаллы. Галогены. Кислород и сера. Азот и фосфор. | Контрольная работа№2 |
| Азот и фосфор. Углерод и кремний | Контрольная работа№3
|
| Металлы | Контрольная работа №4 |
Контрольная работа№1
Вариант №1
1. Задание

2. Задание

Контрольная работа№1
Вариант №2
Задание
 2. Задание
2. Задание

Контрольная работа№1
Вариант №3
Задание

Задание

Критерии оценивания
Контрольная работа №1
Вариант №1
Задание 1.

| Ответ | Кол.баллов |
| Правильный и полный ответ, содержит все элементы | 3 |
| Правильно написаны два элемента ответа | 2 |
| Правильно написан один элемент ответа | 1 |
| В ответе имеются две и более ошибки | 0 |
Задание 2.
Ответ: 
| Ответ | Кол.баллов |
| Правильный и полный ответ, содержит все элементы | 2 |
| Ответ включает один из названых элементов, в ответе имеется одна ошибка | 1 |
| В ответе имеются две и более ошибки | 0 |
Контрольная работа№1
Вариант №2
Задание 1
Ответ: 
| Ответ | Кол.баллов |
| Правильный и полный ответ, содержит все элементы | 2 |
| Ответ включает один из названых элементов, в ответе имеется одна ошибка | 1 |
| В ответе имеются две и более ошибки | 0 |
Задание 2

| Ответ | Кол.баллов |
| Правильный и полный ответ, содержит все элементы | 3 |
| Правильно написаны два элемента ответа | 2 |
| Правильно написан один элемент ответа | 1 |
| В ответе имеются две и более ошибки | 0 |
Контрольная работа№1
Вариант №3
Задание 1.
Ответы: 
Задание 2.
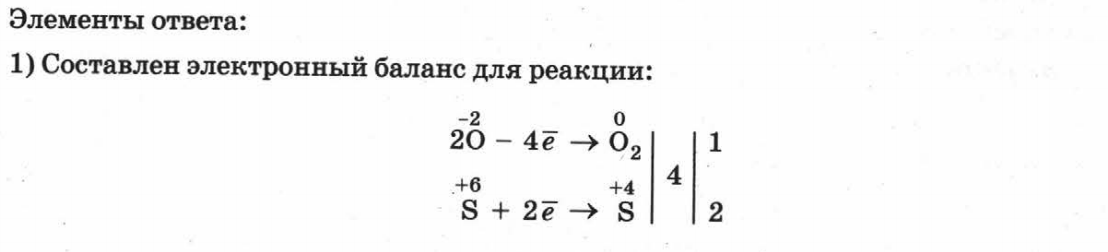

Контрольная работа№2
Вариант 1.
Дана схема превращений:
HСl → Х →HClO
______________________________________
______________________________________
При исследовании химического состава воды из местного родника в ней были
обнаружены следующие анионы: CO32–, SO42–, Br–. Наличие одного из перечисленных
ионов было доказано в результате добавления к воде раствора H2SO4.
1. Какое изменение наблюдается при проведении описанного опыта? (Концентрация
веществ достаточна для проведения анализа.)
Ответ:___________________________________________________________________
2. Запишите сокращённое ионное уравнение протекающей химической реакции.
Ответ:___________________________________________________________________
Дана схема окислительно-восстановительной реакции:
HNO3 + S → NO2 + H2SO4 + H2O
1. Составьте электронный баланс этой реакции.
Ответ:__________________________________________________________________
2. Укажите окислитель и восстановитель.
Ответ:__________________________________________________________________
3. Расставьте коэффициенты и запишите получившееся уравнение реакции.
Ответ:__________________________________________________________________
Превращение одних веществ в другие называется химической реакцией.
Укажите, в ходе какого из приведённых ниже процессов протекает химическая реакция.
1. Охлаждение продуктов в холодильнике.
2. Разогревание супа в микроволновой печи.
3. Сгорание природного газа при работе газовой плиты.
Напишите номер выбранного процесса: _________
Объясните сделанный Вами выбор:__________________________________________
Вариант 2.
При исследовании химического состава образовавшейся в чайнике накипи в ней были обнаружены следующие вещества: CaSO4, FeCO3, MgSO4. Для проведения качественного анализа накипи к ней добавили раствор HCl.
Какое изменение наблюдается при проведении описанного опыта? (Концентрация веществ достаточна для проведения анализа.)
Ответ:________________________________________________________________
Запишите сокращённое ионное уравнение протекающей химической реакции.
Ответ:________________________________________________________________
Превращение одних веществ в другие называется химической реакцией.
Укажите, какой из приведённых ниже процессов является химической реакцией.
Горение магниевой ленты.
Движение ленты в художественной гимнастике.
Перемещение ленты транспортёра на кассе универмага.
Напишите номер выбранного процесса:__________________________________
Объясните сделанный Вами выбор: _________________________________________________
Укажите один ЛЮБОЙ признак протекания этой химической реакции:_________
_______________________________________
Дана схема окислительно-восстановительной реакции:
H2SO4 + Na → H2S + Na2SO4 + H2O
Составьте электронный баланс этой реакции.
Ответ:________________________________________________________________
Укажите окислитель и восстановитель.
Ответ:________________________________________________________________
Расставьте коэффициенты и запишите получившееся уравнение реакции.
Ответ:________________________________________________________________
Вариант 3.
При исследовании минерализации бутилированной воды в ней были обнаружены следующие анионы: F–, S2–, NO3–. Наличие одного из перечисленных ионов было доказано в результате добавления к воде раствора AgNO3.
1. Какое изменение наблюдается при проведении описанного опыта? (Концентрация веществ достаточна для проведения анализа.)
Ответ:_____________________________________________________________
2. Запишите сокращённое ионное уравнение протекающей химической реакции.
Ответ:_____________________________________________________________
Дана схема превращений:
S → Х →SO3
______________________________________
______________________________________
Превращение одних веществ в другие называется химической реакцией.
Укажите, в ходе какого из приведённых ниже процессов протекает химическая реакция.
1. Образование налёта на бронзовых изделиях.
2. Вращение детской скакалки.
3. Рисование карандашом на бумаге.
Напишите номер выбранного процесса:_____________________________________
Объясните сделанный Вами выбор: ________________________________________
Дана схема окислительно-восстановительной реакции:
Cl2 + PH3 + H2O →HCl + H3PO4
Составьте электронный баланс этой реакции.
Ответ:______________________________________________________________ Укажите окислитель и восстановитель.
Ответ:______________________________________________________________ Расставьте коэффициенты и запишите получившееся уравнение реакции.
Ответ:_____________________________________________________________
Критерии оценивания
Задание 1-3
| Ответ | Кол.баллов |
| Правильный и полный ответ, содержит все элементы | 2 |
| Ответ включает один из названых элементов, в ответе имеется одна ошибка | 1 |
| В ответе имеются две и более ошибки | 0 |
Задание 4
| Ответ | Кол.баллов |
| Правильный и полный ответ, содержит все элементы | 3 |
| Правильно написаны два элемента ответа | 2 |
| Правильно написан один элемент ответа | 1 |
| В ответе имеются две и более ошибки | 0 |
Шкала оценки образовательных достижений (для всех заданий)
| Процент результативности (баллов) | Оценка уровня подготовки балл (отметка) вербальный аналог |
| 9 | «5»-отлично |
| 7 | «4»- хорошо |
| 5 | «3»- удовлетворительно |
| 3 | «2»- неудовлетворительно |
Контрольная работа№3
Вариант 1

В 1774 г. английский химик Дж. Пристли впервые получил при разложении соли газ с резким запахом, который в западноевропейских языках получил название «аммониак». В настоящее время этот газ получают в лаборатории нагреванием смеси кристаллических хлорида аммония и гидроксида кальция.
Этот газ в 1,7 раза легче воздуха, легко сжижается. Благодаря уникальным термодинамическим свойствам является доминирующим хладагентом в системах промышленного назначения.
Этот газ хорошо растворяется в воде. Раствор, образующийся при растворении газа в воде, изменяет окраску фенолфталеина на малиновую. Если налить этот раствор в химический стакан, а потом добавить в него концентрированный
1)Составьте уравнение реакции получения «аммониака» в лаборатории.
Ответ:______________________________________________________________________________
2) Составьте уравнение реакции горения «аммониака» в кислороде в присутствии катализатора.
Ответ:______________________________________________________________________________
Дана схема окислительно-восстановительной реакции:
NН3 + СuО → Сu + N2 + Н2O
1) Составьте электронный баланс для этой реакции:
Ответ: __________________________________________________________
2) Укажите окислитель и восстановитель.
Окислитель —____________________________________________________
Восстановитель —_________________________________________________
3) Расставьте коэффициенты в уравнении реакции, соответствующем приведённой схеме.
NН3 + СuО → Сu + N2 + Н2O
Вариант 2

При нагревании (под тягой) кристаллического вещества белого цвета с зеленоватым оттенком образовался порошок чёрного цвета и красно-бурый газ. Тлеющая лучинка, помещённая в сосуд с разлагающимся при нагревании исходным веществом, загорелась. При добавлении к полученному чёрному порошку раствора серной кислоты и последующем нагревании полученной смеси образовался голубой раствор, при добавлении к которому раствора щёлочи выпал синий осадок.
Составьте цепочку описанных превращений, указав в ней названия веществ.
Дана схема окислительно-восстановительной реакции:
Ва + НNО3(разб) → Ва(NО3)2 + NН4NО3 + Н2O
1) Составьте электронный баланс для этой реакции:
Ответ: __________________________________________________________
2) Укажите окислитель и восстановитель.
Окислитель —____________________________________________________
Восстановитель —_________________________________________________
3) Расставьте коэффициенты в уравнении реакции, соответствующем приведённой схеме.
Ва + НNО3(разб) → Ва(NО3)2 + NН4NО3 + Н2O
Критерии оценивания
Задание 1, 2
| Ответ | Кол.баллов |
| Правильный и полный ответ, содержит все элементы | 2 |
| Ответ включает один из названых элементов, в ответе имеется одна ошибка | 1 |
| В ответе имеются две и более ошибки | 0 |
Задание 3
| Ответ | Кол.баллов |
| Правильный и полный ответ, содержит все элементы | 3 |
| Правильно написаны два элемента ответа | 2 |
| Правильно написан один элемент ответа | 1 |
| В ответе имеются две и более ошибки | 0 |
Шкала оценки образовательных достижений (для всех заданий)
| Процент результативности (баллов) | Оценка уровня подготовки балл (отметка) вербальный аналог |
| 5 | «5»-отлично |
| 4 | «4»- хорошо |
| 3 | «3»- удовлетворительно |
| 2 | «2»- неудовлетворительно |
Контрольная работа №4
В а р и а н т I
1. Как классифицируют металлы: а) по плотности; б) по температуре плавления; в) по твёрдости?
2. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
(1) (2) (3) (4)
Li → Li2O → LiOH → LiNO3 → O2
Реакцию 4 рассмотрите как окислительно-восстановительную.
(задание на 2 балла)
3.

4. Имеется смесь кальция и оксида кальция массой 100 г. Определите массу кальция, содержащегося в ней, если при действии воды на 2 г такой смеси собрали 224 мл водорода (н. у.).
В а р и а н т II
1. Охарактеризуйте элементы-металлы IIА-группы периодической таблицы химических элементов Д. И. Менделеева по плану: а) строение атома; б) изменение металлических свойств; в) формулы оксидов и гидроксидов.
2. Напишите уравнение реакции получения железа восстановлением из его оксида Fe2O3 водородом и углеродом.
Укажите окислитель и восстановитель. (задание на 2 балла)
3.

4. В результате реакции 60%-го раствора азотной кислоты с серебром выделилось 4,48 л оксида азота (IV). Определите массу раствора азотной кислоты.
Запишите подробное решение задачи и ответ.
Критерии оценивания
Задание 1-3
| Ответ | Кол.баллов |
| Правильный и полный ответ, содержит все элементы | 2 |
| Ответ включает один из названых элементов, в ответе имеется одна ошибка | 1 |
| В ответе имеются две и более ошибки | 0 |
Задание 4
| Ответ | Кол.баллов |
| Правильный и полный ответ, содержит все элементы | 3 |
| Правильно написаны два элемента ответа | 2 |
| Правильно написан один элемент ответа | 1 |
| В ответе имеются две и более ошибки | 0 |
Шкала оценки образовательных достижений (для всех заданий)
| Процент результативности (баллов) | Оценка уровня подготовки балл (отметка) вербальный аналог |
| 9 | «5»-отлично |
| 7 | «4»- хорошо |
| 5 | «3»- удовлетворительно |
| 3 | «2»- неудовлетворительно |
Паспорт
фонда оценочных средств (практические работы)
по химии в 8 классе
| № п/п | Тема | Наименование оценочного средства
|
| Многообразие химических реакций | Практическая работа №1. Осуществление цепочки химических превращений |
| Многообразие химических реакций | Практическая работа № 2. Решение экспериментальных задач по теме «Свойства кислот, оснований и солей как электролитов». |
| Неметаллы. Галогены. | Практическая работа № 3. Получение соляной кислоты и изучение её свойств |
| Кислород и сера | Практическая работа 4. Решение экспериментальных задач по теме «Неметаллы. Галогены. Кислород и сера». |
| Углерод и кремний | Практическая работа №6. Получение оксида углерода (IV) и изучение его свойств. Распознавание карбонатов. |
| Металлы | Практическая работа № 7. Решение экспериментальных задач по теме «Металлы и их соединения». |
Практическая работа №1 Дата: "___" ________ ____ г.
Тема: Осуществление цепочки химических превращений
Цель: __________________________________________________________________
_______________________________________________________________________
Оборудование и реактивы: спиртовка, пробиркодержатель, спички, стеклянные палочки (2 шт.)* штатив для пробирок, пробирки (3 шт.), воронка, фильтровальная бумага, спиртовка, спички; соляная кислота (1 : 2), растворы сульфата меди (И) (0,5 моль/л) и гидроксида натрия или калия (0,5 моль/л).
Содержание и порядок проведения опыта 1. Выполните задания.
Составьте молекулярные уравнения реакций, соответствующих цепочке превращений:
CuSO4 → Cu(OH)2 → CuO → CuCl2.
1)__________________________________________________________________
2)__________________________________________________________________
3)__________________________________________________________________
Для превращения 1 составьте ионные уравнения реакции.
______________________________________________________________________
______________________________________________________________________
Дайте характеристику реакции 2 по всем изученным признакам классификации химических реакций.
______________________________________________________________________
______________________________________________________________________
3. Проведите реакции, соответствующие рассмотренной выше цепочке превращений, соблюдая правила техники безопасности.

4. Оформите отчет, заполнив таблицу
| Что делали | Наблюдения | Выводы |
|
| __________________________ | ________________________________________________________________________________ |
|
| _____________ _____________ | ________________________________________ ________________________________________ |
|
| _____________ _____________ | ________________________________________ ________________________________________ |
Практическая работа №2. Дата: "___" ________ ____ г.
Тема: Решение экспериментальных задач по теме «Свойства кислот, основании и солей как электролитов».
Цель: использовать полученные знания об кислотах, основаниях и
солях для проведения и объяснять опыты по изучению свойств
неорганических веществ. Научится определять неорганические вещества
Оборудование: штативы с пробирками, пипетки.
Реактивы: запишите самостоятельно (____________________________________)
Задание: выполните работу согласно заданию предложенному учителем; отчет о работе оформите в виде таблице.
Теоретические вопросы (для всех)
1. Если щелочь попала на тело, то эти участи кожи необходимо промыть холодной водой, а потом 2%-м раствором уксусной кислоты. Затем вновь промыть холодной водой. Как объяснить такую последовательность действий?_________________________________________________
Запишите соответствующие уравнения реакций, используя для примера любую щелочь._________________________________________________________________
2. Приведите химическое название солей:
пищевая сода NаНСО3___________________________________
кальцинированная сода Na2CO3____________________________________
мел, мрамор, известняк СаСО3_____________________________________
поташ К2СО3_______________________________________
калийная селитра КNO3__________________________________
ляпис AgNO3_____________________________
Какие индикаторы используются для определения характера среды
Ход работы
Задача: Определение вещества в пробирках. известно что это __________________
_______________________________________________________________________
Определение веществ
Чтобы определить _______________________, необходимо в пробы исследуемых растворов прилить_____________________________
Чтобы определить _______________________, необходимо в пробы исследуемых растворов прилить_____________________________
Чтобы определить _______________________, необходимо в пробы исследуемых растворов прилить_____________________________
|
| Пробирка №1 | Пробирка №2 | Пробирка №3
|
| Индикатор №1 |
|
|
|
| Индикатор №2 |
|
|
|
Ответ: Пробирка №1___________________
Пробирка №2___________________________
Пробирка №3_________________________
Вывод:
Подведение итогов работы. В ходе практической работы мы научились _________
_______________________________________________________________________
_______________________________________________________________________
Практическая работа № 3. Дата: "___" ________ ____ г.
Тема: Получение соляной кислоты и изучение её свойств
Цель: _________________________________________________________________
______________________________________________________________________
Оборудование: штатив с пробирками.
Реактивы: лаборант готовит в пронумерованных пробирках в соответствии с вариантом растворы:
___________________________________________________.
Задания: 1. Повторите по учебнику теоретический материал о способах получения и свойствах кислорода, серы.
|
| С правилами техники
безопасности ознакомлен (а) и обязуюсь их выполнять |
____________________ подпись |
2. Предварительно ознакомьтесь с содержанием экспериментальных задач.
| Реактив
Иссл. в-во | Реактив
_________ | Реактив
_________ | Реактив
_________ | Пробирка
№- |
Уравнения химических реакций. Запишите уравнения реакций для тех случаев, когда они происходят.
| Пробирка №1 __________________________________________________________________________________________________________________________________________ |
| Пробирка №2 __________________________________________________________________________________________________________________________________________ |
| Пробирка №3 __________________________________________________________________________________________________________________________________________ |
Ответ: Пробирка №1 -- вещество__________________
Пробирка №2 -- вещество________________
Пробирка №3 -- вещество________________
Практическая работа № 4.
Тема: Решение экспериментальных задач по теме «Неметаллы. Галогены. Кислород и сера».
Практическая работа. №3. Дата: "___" ________ ____ г.
Решение экспериментальных задач по теме «Кислород и сера».
Цель: закрепить и повторить на практике умение распознавать и получать в лабораторных условиях основные соединения кислорода и серы, проводить опыты согласно заданным схемам.
Оборудование: штатив с пробирками.
Реактивы: лаборант готовит в пронумерованных пробирках в соответствии с вариантом растворы:
___________________________________________________.
Задания: 1. Повторите по учебнику теоретический материал о способах получения и свойствах соединения кислорода, серы.

2. Предварительно ознакомьтесь с содержанием
экспериментальных задач.

Уравнения химических реакций. Запишите уравнения реакций для тех случаев, когда они происходят.
| Пробирка №1
|
| Пробирка №2
|
| Пробирка №3
|
Ответ: Пробирка №1 -- вещество__________________
Пробирка №2 -- вещество________________
Пробирка №3 -- вещество________________
Практическая работа № 5.
Тема: Получение аммиака и изучение его свойств
Практическая работа № 6. Дата: "___" ________ ____ г.
Тема: Получение оксида углерода (IV) и изучение его свойств. Распознавание карбонатов.
Цель: ________________________________________________________________
______________________________________________________________________
Оборудование и реактивы: лабораторный штатив с муфтой и лапкой, штатив для пробирок, пробирка и пробка с газоотводной трубкой, пробирка, мел и мрамор, соляная (или любая сильная) кислота, известковая вода (или растворы аммиака и хлорида кальция).
Опыт №1. Действие кислотой на мрамор получите газ.
| Собираем прибор по рисунку 
| Описание _______________________ _______________________ ________________________ Реакции _________________________ __________________________ __________________________ __________________________ __________________________ __________________________ __________________________ |
Опыт №2. Пропустите выделяющийся газ в пробирки:
| а) с водой, подкрашенной раствором лакмуса;
| Что наблюдаете? Напишите уравнение реакции.___________________________ ___________________________________ ___________________________________ ___________________________________
|
| б) с известковой водой;
| Что наблюдаете? Напишите уравнение реакции.___________________________ ___________________________________ ___________________________________ ___________________________________
|
| в) с раствором хлорида кальция.
| Что наблюдаете? Напишите уравнение реакции.___________________________ ___________________________________ ___________________________________ ___________________________________
|
Опыт №3. Испытайте раствор карбоната натрия раствором хлорида бария. Что наблюдаете?
| Что наблюдаете?_________ ____________________ ____________________ ____________________ ____________________
| Напишите уравнение реакции. (ПОЛНОЕ И СОКРАЩЕННОЕ)._________ __________________________ __________________________ __________________________ ____________________________________________________ |
Вывод: (о свойствах оксида углерода (IV), из чего его можно получить)____________________________________________________________________________________________________________________________________
(о карбонатах и качественной реакции на карбонат-ион)_____________________________________________________________________________________________________________________________________________
Критерии оценивания практических работ по химии
|
Критерии оценивания
| % выполнения задания | Отметка |
| Не приступал к решению задач. | 0% | «1» |
| Не достигнут необходимый уровень знаний. Не решена типовая, много раз отработанная задача.
1. Оказался совершенно не подготовленным к выполнению этой работы: обнаружил плохое знание теоретического материала и отсутствие необходимых практических навыков и умений.
2. Полученные результаты не позволяют обучающемуся сделать правильных выводов и полностью расходятся с поставленной целью.
3. Руководство и помощь со стороны учителя или хорошо подготовленных учащихся неэффективны из-за плохой подготовки обучающегося. | 1-49% | «2» |
| Частично успешное решение (с незначительной, не влияющей на результат ошибкой или с посторонней помощью в какой-то момент решения).
1. Обучающийся работу выполняет и оформляет с помощью учителя или хорошо подготовленных и уже выполнивших на «отлично» данную работу ребят.
2. На выполнение работы затрачивает времени больше отведенного на уроке или получает возможность доделать работу дома.
3. Показывает знания теоретического материала, но испытывал затруднения при самостоятельной работе с источниками информации и географическими инструментами. | 50-69% | «3» |
| Решение без ошибок или с небольшими недочетами, полностью самостоятельно.
1. Практическая или самостоятельная работа выполнена обучающимся в полном объеме и самостоятельно.
2. Допускает отклонение от необходимой последовательности выполнения, не влияющее на правильность конечного результата (перестановка пунктов типового плана при характеристике географического объекта и т.д.).
3. Использует указанные учителем источники знаний и показывает умение работать с ними самостоятельно.
4. Показывает знание основного теоретического материала и овладение умениями, необходимыми для самостоятельного выполнения работы.
5. Допускает неточности и небрежность в оформлении результатов работы. | 70-89% | «4» |
| Полностью успешное решение нестандартной задачи, где потребовалось либо применить новые знаний по изучаемой в данный момент теме, либо уже усвоенные знания и умения, но в новой, непривычной ситуации (без ошибок и полностью самостоятельно, или с небольшими недочетами.) 1. Работа выполнена обучающимся полностью самостоятельно, в полном объеме и с соблюдением необходимой последовательности изложения материала и результатов деятельности.
2. Работа оформлена аккуратно, в оптимальной для фиксации результатов форме. Форма фиксации материалов может быть предложена учителем или выбрана самим обучающимся. | 90-100% | «5» |









 2. Задание
2. Задание