

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока


Курс лекций по общей и неорганической химии
Курс лекций разработан для студентов 1 курса технических специальностей.
Просмотр содержимого документа
«Курс лекций по общей и неорганической химии»
ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ
Изучив лекции 1 и 2, студенты должны:
знать: понятия атом, молекула, химический элемент, простое вещество, сложное вещество, валентность; законы химии постоянства состава вещества, сохранения массы веществ, закон Авогадро и следствия из него;
уметь: определять количественный и качественный состав вещества, составлять формулы веществ по валентности, определять валентность элементов по формуле, производить расчеты по химическим формулам и уравнениям.
Лекция 1
ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
Химия относится к естественным наукам, она имеет огромное значение в жизни общества. Без достижений химии были бы невозможны такие завоевания человечества, как освоение космического пространства и использование атомной энергии в мирных целях.
Предметом изучения химии является вещество. Изучение веществ, их свойств, прогнозирование использования вещества в промышленности, сельском хозяйстве, медицине и получение этих веществ – основная задача химии.
Химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения.
Веществ очень много. Известно около 15 миллионов веществ. Все вещества характеризуются определенными свойствами: агрегатным состоянием (твердое, жидкое, газообразное), в котором находится вещество при данных условиях, цветом, блеском, запахом, растворимостью и другими свойствами.
Вещества – это системы, состоящие из определенных частиц: атомов, молекул, ионов.
Вещества под действием внешних условий изменяются (вода превращается в лед при охлаждении, в пар при нагревании; железо на воздухе превращается в ржавчину). Все изменения, которые происходят в окружающем нас мире, называются явлениями, которые могут быть физическими и химическими. Явления, при которых не происходит образование новых веществ, называются физическими явлениями (превращение воды в лед, пар). Явления, при которых происходит образование новых веществ, называются химическими явлениями или химическими реакциями (ржавление железа, горение древесины, разложение воды под действием электрического тока).
Первое учение о строении вещества – это атомно-молекулярное учение, которое развивалось в течение многих столетий на основе количественных представлений физики и химии. Особое значение в развитии этого учения имеют работы русского ученого М. В. Ломоносова. На первом Международном съезде химиков в 1860 году в городе Карлсруэ были приняты определения понятий атома и молекулы и сформулированы основные положения атомно-молекулярного учения.
Молекулой называется мельчайшая частица вещества, обладающая определенной массой и всеми химическими свойствами этого вещества. Атом – это химически неделимая частица вещества.
Сущность учения заключается в следующем:
1. Все вещества состоят из молекул, атомов или ионов. Молекула является наименьшей частицей, которая сохраняет свойства данного химического соединения.
2. Молекулы находятся в постоянном движении. С повышением температуры скорость движения молекул увеличивается.
3. Молекулы одного вещества одинаковы между собой. Молекулы различных веществ отличаются друг от друга массой, размерами, составом, строением и химическими свойствами.
4. Молекулы могут состоять из атомов одного элемента, образуя простые вещества (гомоатомные или гомоядерные) и из атомов разных элементов, образуя сложные вещества (гетероатомные или гетероядерные).
5. При физических явлениях молекулы сохраняются, при химических – разрушаются. Атомы, в отличие от молекул, при химических реакциях сохраняются.
6. При химических реакциях образуются новые вещества из тех же самых атомов, из которых состояли первоначальные вещества.
Вещества, которые в твердом и газообразном состоянии состоят из молекул, относятся к веществам молекулярного строения (вода, кислород, водород, кислоты, сахар). Вещества, состоящие из атомов или ионов, относятся к веществам немолекулярного строения (соли, основания, алмаз, кремнезем).
Массы атомов и молекул очень малы. Например, масса одного из наиболее тяжелых металлов – урана – составляет 39,54 на 10-23 г, а самого легкого атома – водорода – 1,67 на 10-24 г. При химических расчетах пользоваться такими малыми числами очень трудно, поэтому при определении массы атомов и молекул пользуются относительными массами. За единицу атомной массы в физике и химии с 1961 года принята атомная единица массы (а.е.м.), которая равна 1/12 массы атома изотопа углерода (12С) и обозначается mа. ЕЕ следует отличать от безразмерной величины относительной атомной массы Ar. Например, относительная атомная масса элемента серы Ar(S)=32, а масса атома серы mа(S)=32·1 а.е.м. = 32 а.е.м., т.е. равна произведению относительной атомной массы элемента на 1 атомную единицу массы.
Отношение массы молекулы к 1/12 массы атома углерода называется относительной молекулярной массой вещества Mr. Она равна сумме относительных атомных масс каждого элемента.
Например, Mr(Н2О) =2· Ar(Н) + Ar(О)=2·1 +1·16 = 18
Соответственно находят и массу молекулы:
mм(Н2О) = 2 · 1 а.е.м. + 1· 16 а.е.м. = 18 а.е.м.
Для практического решения вопросов о количественном участии веществ в химических реакциях используют молярную массу вещества М.
Молярная масса (М) это отношение его массы к количеству вещества:
М = m∕v,
где (m) - масса вещества, г; (v) – количество вещества, моль. Следовательно, молярная масса имеет размерность грамм на моль (г/моль)
Числовое значение молярной массы совпадает с числовым значением относительной молекулярной массы вещества.
В природе вещества встречаются преимущественно в виде смесей. Однородные (гомогенные) смеси – это такие смеси, в любой точке объема которых состав одинаковый, т. е. системы, не имеющие границы раздела фаз (растворы сахара, соли в воде, воздух). Неоднородные (гетерогенные) смеси – это такие смеси, состав которых в разных точках объема неодинаков (глина в воде, гранит, мел в воде). Однородные смеси, в зависимости от размера частиц, образуют растворы: а) истинные – размеры частиц растворенного вещества мельче размеров частиц растворителя (растворы солей, кислот, щелочей), б) коллоидные – размеры частиц растворенного вещества и растворителя примерно одинаковы (клей, клейстер, кровь).
Для химических лабораторий и промышленности часто требуются чистые вещества, обладающие постоянными физическими свойствами. Существуют различные способы разделения смесей: отстаивание, фильтрование, действие магнитом, выпаривание, упаривание (кристаллизация) – частичное испарение воды, дистилляция(перегонка), хроматография – основан на различном поглощении разделяемых веществ поверхностью другого вещества (специальные приборы – хроматографы, основные части которого хроматографическая колонка и детектор).
В химии очень важным является понятие химический элемент.
Химический элемент – это определенный вид атомов.
Простые вещества – это вещества, состоящие из атомов одного химического элемента (кислород, водород, медь, железо). Сложные вещества – это вещества, состоящие из атомов разных химических элементов (вода, серная кислота, сульфид железа, поваренная соль, сахар). Состав простых и сложных веществ выражается химическими формулами.
Химическая формула – это условная запись состава вещества посредством химических знаков и, если нужно, индексов.
При составлении формулы простого вещества необходимо знать знак химического элемента и его агрегатное состояние. Газы – двухатомные молекулы (кроме инертных газов, они одноатомны): Н2 – водород, О2 – кислород, S – сера, Fe – железо.
Для простых веществ – неметаллов характерно явление аллотропии. Аллотропия – это способность атомов одного элемента образовывать разные простые вещества. Например, элемент кислород (О) может образовать два вещества – кислород (О2) и озон (О3); элемент сера (S) может образовать два вещества – кристаллическая сера (S8) и пластическая сера (Sn).
При составлении формулы сложного вещества необходимо знать знаки химических элементов, входящих в состав вещества и их валентности: Н2О – вода (оксид водорода), Fe S - сульфид железа.
Валентность – это свойство атома химического элемента присоединять или замещать определенное число атомов другого химического элемента.
Валентность кислорода всегда равна 2, а водорода – 1, т.к. водород не может присоединить к себе более одного атома другого химического элемента, кислород может присоединить к себе два атома водорода. Азот в молекуле аммиака трехвалентен, он может присоединить к себе три атома водорода. Численное значение валентности принято обозначать римскими цифрами, которые ставятся над знаками химических элементов. Некоторые элементы в разных соединениях проявляют различную валентность. По формуле вещества можно определить валентность каждого элемента, если формула состоит из двух химических элементов. При определении валентности элемента по формуле вещества, состоящего из атомов двух элементов, следует учитывать, что число единиц валентности всех атомов одного элемента должно быть равно числу единиц валентности всех атомов другого элемента.
Вопросы и задания
1. Что называется веществом, атомом, молекулой, аллотропией, валентностью?
2. К какому явлению относится: распил дерева, разбитие стекла, почернение серебра, растворение сахара в воде, горение древесины?
3. Составьте формулы высших оксидов следующих элементов: Na, Ca, Al, Si, S, Br.
4. Составьте формулы гидридов следующих элементов: Si, P, S, Cl, As, Te.
5. Составьте формулы следующих соединений: Al и S; Ca и Cl; K и Se; Na и P; Mg и N.
6. Определите валентность элементов в следующих соединениях: K3N; AlCl3; FeN; Fe2O3;
7. Рассчитайте относительную молекулярную массу серной кислоты.
Лекция 2
ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
Состав любого химического соединения можно выразить химической формулой. Зная формулу вещества, можно определить качественный и количественный состав вещества. Качественный состав показывает, какие химические элементы образуют вещество. Например, серная кислота (H2SO4) образована атомами водорода, серы и кислорода. Количественный состав вещества показывает, что данное вещество образовано из двух атомов водорода, одного атома серы и четырех атомов кислорода. Независимо от способов получения, количественный состав его будет постоянным.
Изучая состав различных веществ, французский ученый Ж. Пруст пришел к выводу, что массовые соотношения между элементами в сложных веществах всегда постоянны независимо от способов его получения. Это значит, что атомы химических элементов вступают в соединения друг с другом только в определенных количественных соотношениях.
Например, поваренная соль (NaCl) может быть получена разными способами, но она всегда состоит из натрия и хлора, при этом массовое соотношение этих элементов будет всегда постоянное: (23 : 35,5). На основании экспериментов был сформулирован закон постоянства состава (Ж. Пруст, 1799):
Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Зная формулу вещества, атомные массы элементов, можно проводить различные вычисления по химическим формулам.
Пример 1. Вычислите массовую долю ω (%) элементов в углекислом газе (СО2).
Решение. Mr (СО2) = 44. Тогда
ω (С) = 12 : 44 · 100% = 27,29 %
ω (О) = 16 · 2 : 44 · 100 % = 72,71%
Пример 2. Выведите формулу вещества, содержащего 75% углерода и 25% водорода.
Решение. Обозначим число атомов углерода в соединении через (х), а число атомов водорода через (у). Так как масса атома углерода равна 12 а.е.м., а атома водорода – 1 а.е.м., масса всех атомов углерода, содержащихся в молекуле, равна (12х), а атомов водорода - (у). Отношение этих масс выражает состав всего вещества. Этот же состав выражается соотношением (75:25).
Приравнивая оба соотношения, получаем пропорцию:
12х : у =75:25;
х : у = 75 ∕12 : 25∕12= 6,25 : 25
Чтобы выразить отношение (х : у) целыми числами , делим оба члена отношений на меньшее из них:
х : у = 6,25∕6,25 : 25∕6,25 = 1 : 4.
Таким образом, х = 1, у = 4. В молекуле на каждый атом углерода приходится четыре атома водорода. Получаем формулу (СН4) – метан.
Основываясь на количественном методе изучения химических реакций,
М.В. Ломоносов в 1748 г., открыл закон сохранения веса веществ. Каждое вещество имеет массу, поэтому закон называют сохранения массы веществ.
Масса веществ, вступивших в реакцию, равна массе веществ, образующихся в результате реакции.
При химических реакциях изменяются вещества, т.е. одни молекулы превращаются в другие, но число атомов и их общая масса не изменяются. Правильно составленное уравнение реакции имеет большое практическое значение. По уравнению реакции можно рассчитать, сколько нужно взять исходного вещества для получения строго определенного количества необходимого продукта, или узнать, сколько получится нового продукта из данного количества вещества.
Пример 3. Сколько граммов сульфата алюминия получится при взаимодействии оксида алюминия с 49 г серной кислоты?
Решение. Записываем уравнение реакции:
Al2O3 + H2SO4 → Al2(SO4)3 + H2O
Уравниваем уравнение реакции, т.е. проставим коэффициенты, согласно закону сохранения масс:
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
Рассчитаем молярные массы серной кислоты и сульфата алюминия:
М(H2SO4) = 2·1 + 1·32 + 4·16 = 98 г/моль
М(Al2(SO4)3) = 2·27 +3· (1·32 + 4·16) = 342 г/моль
Выясним количество вещества серной кислоты, вступившего в реакцию, по формуле:
М = m∕v, v = m / М
v (H2SO4) = m(H2SO4) / М(H2SO4) = 49 г: 98 г/моль = 0,5 моль
По уравнению реакции видно, что 3 моль серной кислоты образует 1 моль сульфата алюминия, следовательно, количество вещества сульфата алюминия, полученного в результате реакции, можно рассчитать:
v (Al2(SO4)3) = 0,5 моль : 3 = 0,17 моль, отсюда следует,
m (Al2(SO4)3) = М (Al2(SO4)3) · v (Al2(SO4)3) = 342 г/моль · 0,17 моль = 58 г
m (Al2(SO4)3) = 58 г.
Для расчета объема газов используют закон Авогадро и следствия из него.
В равных объемах газов при одних и тех же условиях содержится одинаковое число молекул.
1 моль любого газа при нормальных условиях занимает объем, равный
22.4 л/моль, при этих же условиях содержит 6,02 · 1023молекул.
Нормальные условия (н.у.) – это tо = 273оК, Р = 101,325 кПа.
Если газы занимают одинаковый объем, то любой газ количеством вещества 1 моль (при н.у.) содержит одинаковое число молекул, следовательно,
В 22.4 л любого газа (при н.у.) содержится 6,02 ·1023молекул –
- это математическое выражение закона Авогадро.
Молярный объем газа – это отношение его объема к количеству вещества:
Vm = V/ v
Пример 4. Определите количество вещества сернистого газа, занимающего объем 5,6 л при нормальных условиях.
Решение. Используя молярный объем (Vm), постоянный для всех газообразных веществ, взятых при нормальных условиях, находим:
v = V/ Vm , v = 5,6 л : 22,4 л/моль = 0,25 моль
Пример 5. Вычислите объем углекислого газа, который занимает 22 г газа.
Решение. Vm = V/ v, V = Vm · v, v = m / М,
М (СО2) = 1· 12 + 2 · 16 = 44, следовательно,
V (СО2) = Vm · (m(СО2) / М(СО2)) = 22,4 л/моль ·(22 г : 44) = 11,2 л
V (СО2) = 11.2 литра.
Следствие из закона Авогадро: объемные отношения газов выражаются их коэффициентами.
Пример 6. Определите объем водорода, необходимый для взаимодействия с 50 литрами азота.
Решение. Запишем уравнение реакции:
N2 + H2 → NH3, уравняем уравнение реакции, т.е. проставим коэффициенты, согласно закону сохранения масс:
N2 + 3H2 = 2NH3, по уравнению реакции видим, что 1 моль азота взаимодействует с 3 моль водорода, следовательно, объем водорода, вступивший в реакцию с 50 литрами азота будет в 3 раза больше:
V(H2) = 50 л · 3 = 150 л.
Пример 7. Определите объем кислорода, который необходим для окисления 54 г алюминия.
Решение. Запишем уравнение реакции:
Al + O2 →Al2O3 , уравняем уравнение реакции, т.е. проставим коэффициенты, согласно закону сохранения масс:
4 Al + 3O2 = 2Al2O3 , рассчитаем молярную массу алюминия:
М(Al) = 27 г/моль, Vm(О2) = 22,4 л/моль. Выясним, количество вещества алюминия, вступившего в реакцию:
v (Al) = m(Al) / М(Al)=54 г : 27 г/моль = 2 моль
По уравнению реакции видно, что 4 моль алюминия вступает в реакцию с 3 моль кислорода, следовательно, v(О2) = 2· 3 :4 = 1,5 (моль), отсюда следует,
V(О2) = Vm · v (О2) = 22,4 л/моль · 1,5 моль = 33,6 л
V(О2) = 33,6 литра
Вопросы и задания
1. Что называют молярной массой вещества? В каких единицах она выражается?
2. Что называют молярным объемом? В каких единицах он выражается?
3. Сформулируйте законы: постоянства состава вещества, сохранения массы вещества, закон Авогадро?
4. Сколько молей составляют: а) азот массой 14 г; б) кислород массой 48 г; в) железо массой 112г ?
5. Вычислите массовую долю элементов (%) в следующих веществах: а) карбонат натрия; б) оксид фосфора (V).
6. Найдите массу гидроксида натрия, которая необходима для реакции с 16г сульфата меди (II).
7. Какой объем кислорода необходим для сжигания 4 г серы до оксида серы (IV)?
8. Определите объем хлора, необходимый для взаимодействия с 30 литрами водорода.
Лекция 3
ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА Д.И.МЕНДЕЛЕЕВА В СВЕТЕ УЧЕНИЯ О СТРОЕНИИ АТОМА
Изучив лекции 3 и 4, студенты должны:
знать: формулировки периодического закона, структуру периодической системы Д.И.Менделеева, строение атома;
уметь: определять элемент по электронной формуле; давать характеристику элементу и его соединениям по порядковому номеру элемента; записывать электронную формулу данного элемента и сравнивать с окружающими его элементами в периоде и группе.
ПЕРИОДИЧЕСКИЙ ЗАКОН Д.И.МЕНДЕЛЕЕВА.
СТРУКТУРА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА
В истории каждого научного открытия можно различить два этапа: первый – установление частных закономерностей и второй – сам факт открытия и его признание.
Ни один закон или теория не могут появиться на пустом месте. У Д.И.Менделеева было много предшественников, предлагавших свои таблицы и графики элементов.
В начале ХIХ в. основатель атомистики Дж. Дальтон ввел важнейшую характеристику элементов – атомный вес (позднее было введено понятие «атомная масса»). С введением этого понятия химия получила в свое распоряжение важнейшее средство для изучения количественного состава сложных тел. Впервые это понятие применил Деберейнер (1829г.). Он установил, так называемый, «закон триад», т.е. троек сходных элементов, где помимо химического состава имеет место и закономерность в отношении массы атома: атомная масса среднего в триаде элемента приблизительно равна среднему арифметическому из величин двух крайних.
Например, атомная масса (Li) в триаде (Li – Na – K) равна 7, а (К) – 39, следовательно, по Деберейнеру атомная масса (Na) равна (7+39)/2 = 23. Позднее М.Петтенкофер (1850г.) и Ж.Б.Дюма (1857г.) объединили большее число известных элементов в триады. Французский ученый Э.Д.де Шанкуртуа (1862г.) выступил с системой элементов, представленной в виде графика (винтовая линия Шанкуртуа). Он разместил все известные элементы в порядке увеличения массы атома по винтовой линии, описанной вокруг цилиндра. Сходные элементы располагались друг под другом. Данная классификация оказалась пространственной и давала почву для фантазирования. Дж.А.Ньюлэндс (1863г.) определил, что если сходные элементы расположить друг под другом, то каждый восьмой элемент в ряду располагается под первым. Свойства элементов повторяются, подобно октавам в музыке – эта особенность была названа «законом октавы». Принцип последовательного распределения элементов без каких-либо пропусков исключал возможность открытия новых элементов. Многие элементы попали не на соответствующие им места.
Немецкий химик Л.Мейер (1864г.) составил таблицу химических элементов по признаку валентности элементов по водороду. В его таблице 44 элемента (из 62известных в то время) расставлены в шести столбцах, не выражая периодичности изменения свойств элементов. Через четыре года он составил еще одну таблицу, мало отличающуюся от первой. Она была опубликована в 1868г. после смерти автора.
Все предложенные классификации были искусственны и не отражали законов развития природы.
Обобщив все сведения об известных в то время элементах, изучив труды предшественников, Д.И.Менделеев в 1869 г. открыл периодический закон химических элементов: «Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов».
За основу периодической системы он берет не только атомную массу, но и химические свойства элементов. Иначе не объяснить, почему калий расположен в периодической системе после аргона, никель после кобальта, йод после теллура; хотя атомная масса элементов, названных первыми, меньше и как бы противоречит основной формулировке закона.
Рассмотрев свойства одного ряда химических элементов в порядке увеличения их атомной массы, можно сделать следующие выводы:
а) периодически ослабляются металлические свойства и усиливаются неметаллические;
б) периодически увеличивается валентность по кислороду;
в) начиная с четвертой группы, периодически уменьшается валентность по водороду.
Внутри периода происходит отрицание одних свойств (металлических) другими, прямо противоположными (неметаллическими). Каждый период завершается благородным элементом, который также является отрицанием предыдущего.
Новый период начинается с элемента, как бы повторяющего свойства предшествующего, но это повторение происходит на иной, более высоко основе. В периодической системе видно, как количественные изменения (атомная масса) приводят к качественным изменениям (химические свойства) и, дойдя до определенного предела, незначительное изменение количества приводит к резкому изменению качества – скачку, например, от фтора к неону, от неона к натрию.
Открытия конца ХIХ начала ХХ века показали сложность строения атома. Было выяснено, что основной характеристикой элемента является не атомная масса элемента, а заряд ядра его атома. Формулировка периодического закона была уточнена: «Свойства химических элементов находятся в периодической зависимости от заряда их атомных ядер».
Периодический закон нашел отражение в периодической системе.
Периодическая система – это: а) графическое отображение периодического закона; б) естественная классификация химических элементов.
Структура периодической системы:
1. Периоды – это горизонтальные ряды химических элементов, расположенных в порядке увеличения их порядковых номеров, начинающиеся щелочными металлами и заканчивающиеся инертными газами.
В периодической системе всего семь периодов, седьмой период пока незавершен. Первый, второй и третий периоды – малые (во втором периоде всего два элемента, во втором и третьем - по восемь элементов). Четвертый, пятый, шестой и седьмой – большие. Они содержат от 18 до 32 элементов. 14 элементов из седьмого периода имеют сходные свойства с лантаном, они вынесены в отдельный ряд под названием лантаноидов. В отдельный ряд вынесены и элементы, сходные с актинием – актиноиды. Это позволило периодическую систему сделать более компактной и более удобной для использования. В периодах металлические свойства усиливаются справа налево, а неметаллические - слева направо.
2. Группы – это вертикальные группировки сходных между собой химических элементов.
В периодической системе всего восемь групп. Каждая группа делится на главную подгруппу и побочную.
Главная подгруппа объединяет элементы больших и малых периодов. Побочная подгруппа объединяет элементы только больших периодов. В группах металлические свойства увеличиваются сверху вниз, а неметаллические – снизу вверх.
Чем выше и правее расположен элемент в периодической системе, тем он более неметалличный (инертные газы не учитываем, так как они проявляют особые свойства). Чем правее и ниже расположен элемент в периодической системе, тем он более металличный.
С открытием периодического закона появилась возможность предсказывать и описывать новые элементы и их соединения. На основе этого закона Д.И.Менделеевым были исправлены томные массы многих элементов, заполнены все «пустые клетки»до 92 элемента, а также открыты трансурановые элементы. Периодический закон имеет огромное философское значение – подтверждает общие законы развития природы.
Вопросы и задания
1. Как изменяются свойства элементов с увеличением порядкового номера в периоде и в группах?
2. Определите элемент, если известно: а) элемент четвертого периода, высший оксид (Х2О7), с водородом образует газообразное соединение (НХ);
б) элемент пятого периода, высший оксид (ХО2), с водородом газообразных соединений не образует.
Составьте формулы оксидов, гидроксидов, гидридов этих элементов, определите их характер.
3. Определите элементы, составьте формулы их оксидов и гидроксидов, определите характер элементов и их соединений, если порядковый номер элементов: 4, 33, 37, 75.
4. Составьте формулы гидроксидов: кальция и бария, натрия и калия, серы и теллура, мышьяка и фосфора. Определите более сильные гидроксиды в каждой паре. Ответ обоснуйте.
Лекция 4
СТРОЕНИЕ АТОМА
Слово «атом» происходит от греческого «atomos» - неделимый (при химических реакциях атомы не разрушаются).
Большинство ученых признали реальное существование атомов, но представляли его как мельчайшую частицу вещества, твердый непроницаемый шарик, неделимый, ни при каких условиях. Лишь отдельные передовые ученые предполагали, что атом имеет сложное строение и при определенных условиях может быть делим.
В конце ХIХ века были сделаны открытия, показавшие сложное строение атомов и возможность превращения при известных условиях одних атомов в другие. На основе этих открытий начало быстро развиваться учение о строении атома.
В 1911 году английский физик Э.Резерфорд высказал гипотезу о планетарном строении атома. Согласно этой гипотезе, атом представляет собой систему из очень малого по размеру ядра (10-12 – 10-13 см), вокруг которого по круговым орбитам движется такое число электронов, что они своим отрицательным зарядом нейтрализуют положительный заряд ядра.
По законам электродинамики электрон, двигаясь вокруг ядра, должен излучать энергию и двигаться не по окружности, по спиралевидной кривой и в конце концов упасть на ядро.
В 1913 году датский ученый Н.Бор на основе квантовой теории излучения М.Планка развил квантовую теорию строения атома. Он теоретически обосновал модель самого простого из всех атомов – атома водорода. По его теории, электрон может двигаться вокруг ядра атома не по любым орбитам, только по вполне определенным, дозволенным.
При движении электронов по этим дозволенным орбитам атом не излучает энергию, излучение и поглощение энергии происходит при переходе электрона с одной орбиты на другую. При этом энергия излучения меняется порциями, или квантами, каждому из которых соответствует определенная частота.
Атом: протон (р+)
нейтрон (n0)
электрон (е- )
Протоны и нейтроны образуют ядро, а электроны движутся вокруг ядра. Масса атома определяется числом протонов и нейтронов. Оба вида частиц, объединяемых под общим названием нуклоны, обладают почти одинаковой массой, равной 1. Так как масса электронов в атоме очень мала, поэтому по разности между атомной массой и массой протонов определяется число нейтронов. Атом всегда электроотрицателен, следовательно, число протонов равно числу электронов.
Таким образом, массовое число определяет общее число протонов и нейтронов, а порядковый номер – число протонов в ядре и электронов в атоме. Однако, в природе атомы одного и того же элемента имеют различные атомные массы. Например, атомы водорода имеют массу 1, 2.3:
Ядра этих атомов содержат одинаковое число протонов, но разное число нейтронов: ядро протия состоит из 1 протона, дейтерия – из 1 протона и 1 нейтрона, ядро трития – из 1 протона и 2 нейтронов.
Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разные массовые числа, называются изотопами.
В периодической системе Д.И.Менделеева указывается средняя атомная масса элемента по величине массовых чисел всех изотопов, которые взяты в процентном соотношении их распространенности в природе. Например, атомная масса хлора равна 35,5 у.е., так как природный хлор состоит на 75,4% из изотопа с массовым числом 35 и 24,6% изотопов с массовым числом 37.
Атомы различных изотопов одного и того же химического элемента наряду с разными ядерными свойствами имеют одинаковое строение электронной оболочки, поэтому химические и физические свойства изотопов почти одинаковые.
Основные положения в строении атома и электронных оболочек
1. Физический смысл порядкового номера – показывает заряд ядра атома, следовательно, число протонов, а значит, и электронов.
2. Физический смысл номера периода – показывает число энергетических уровней (электронных слоев).
Электроны в атомах обладают неодинаковой энергией, поэтому они располагаются на различных расстояниях от ядра, на различных орбитах, образуя энергетические уровни или электронные слои.
Для характеристики орбиты Бор ввел квантовое число, впоследствии получившего название главного (n). Периодов в периодической системе семь, поэтому n = 1, 2, 3, 4, 5, 6, 7.
Максимальное число электронов на энергетическом ровне определяют по формуле (N = 2 n2), если n = 1, то N = 2
n = 2, то N = 8
n = 3, то N = 18
n = 4, то N = 32, больше 32 электронов на энергетическом уровне быть не может.
3. Физический смысл номера группы – показывает число электронов на внешнем электронном уровне у элементов главных подгрупп.
4. Электрон может находиться в любой точке пространства вокруг ядра. Поэтому квантовая механика вводит понятие электронного облака. Заряд электрона как бы размазывается, расплывается по всему объему этого облака. Электронное облако может иметь разную геометрическую форму, им присвоены буквенные обозначения. Орбитали первого типа имеют сферическую форму и обозначаются (s – орбитали). Орбитали второго типа (р – орбитали) являются вытянутыми. Область нахождения электрона – то по одну сторону, то по другую от ядра. Эти смежные облака образуют вместе нечто вроде гантели. Для удобства такую гантель изображают в виде двух шаров или же восьмерки. Орбитали третьего типа (d – орбитали) имеют более сложную форму – они представляют собой как бы скрещенные гантели, а орбитали четвертого типа (f – орбитали) образуют еще более сложные облака.
Таким образом, форма электронного облака не может быть произвольной, она определяется вторым орбитальным квантовым числом (l), которое называют побочным. Состояние электрона при различных значениях l называют энергетическими подуровнями электрона в атоме и обозначают буквами (s, p, d, f).
Максимальное число электронов, размещающихся на каждом подуровне, равно:
s – 2 электрона (s2 );
p – 6 электронов (p6);
d – 10 электронов (d10);
f – 14 электронов (f14).
Распределение электронов в атомах по энергетическим уровням и подуровням изображают в виде так называемых электронных формул (электронных конфигураций). Например, электронная формула (конфигурация) атома натрия, занимающего 11 – е место в периодической системе, выразится так:
11Na 1s2 2s2 2p6 3s1.
Структуру электронных оболочек атомов часто изображают графически при помощи энергетических ячеек (электронных структур). Понятие об энергетической ячейке соответствует понятию об энергетическом состоянии электрона, характеризуемом квантовыми числами (n, l, m). Ячейка обозначается квадратиком, а электрон внутри ячейки – стрелкой. Каждая ячейка может вместить одну электронную пару, максимальное число ячеек для s – подуровня составляет 1, для р – подуровня – 3, для d – подуровня – 5, для f – подуровня – 7. Электроны могут вращаться в противоположных направлениях, поэтому в одной ячейке стрелки направляют в противоположные стороны.
План характеристики химического элемента и его соединений по положению элемента в периодической системе
I. Место элемента в периодической системе:
№ периода, большой или малый;
№ группы, главная или побочная подгруппа;
порядковый № элемента;
относительная атомная масса элемента (Ar).
II. Строение атома и электронных оболочек:
строение атома: число протонов, электронов, нейтронов;
строение электронных оболочек по уровням и подуровням (структура электронной оболочки):
а) валентные электроны, их графическое и схематичное строение;
б) валентность элемента в соединениях.
III. Соединения элементов и их характер:
формула высшего оксида, его характер (для переходных элементов формула оксида в характерной валентности);
формула гидроксида, его характер;
формула средней соли для гидроксида;
формула летучего водородного соединения.
IV. Сравнение элемента по характеру с соседями:
по группе (подгруппе);
по периоду.
Вопросы и задания
1. В каких группах и подгруппах периодической системы находятся s -, p – и d -элементы?
2. Определите характер s -, p – и d – элементов.
3. Образует ли элемент газообразное соединение с водородом, если он имеет формулу высшего оксида (Х2О7), а внешний квантовый уровень содержит (3s2 3p5) электроны?
4. Дайте характеристику элементов: №11, №14, №25 по плану.
5. Определите элементы по их электронным формулам: а) 3s2 3p6; б) 4s2 4p3; в) 3d64s2. Предложите формулы их оксидов и гидроксидов. Определите характер.
Лекция 5
ХИМИЧЕСКАЯ СВЯЗЬ. СТРОЕНИЕ ВЕЩЕСТВА
Изучив лекцию 5, студенты должны:
знать: типы химической связи (ковалентная полярная и неполярная, ионная, водородная, металлическая); типы кристаллических решеток;
уметь: определять характер химической связи в различных соединениях и степень окисления элементов в соединениях; составлять схемы электронного строения соединений с ионной и ковалентной связями; составлять структурные формулы молекулярных соединений; определять тип кристаллической решетки в различных соединениях.
ТИПЫ ХИМИЧЕСКОЙ СВЯЗИ
С развитием учения о строении атома появились различные теории, объясняющие причины образования химических соединений.
Одна из них объясняет образование химической связи между атомами за счет валентных электронов – электронов, расположенных на внешних орбитах и поэтому связанных с ядром наименее прочно. Поведение атомов в химических процессах зависит от того, насколько прочно их электроны удерживаются на своих орбитах. Большое значение имеют длина связи, т.е расстояние между связанными атомами и энергия электрона в атоме (энергия ионизации) энергия, которую необходимо затратить для отрыва электрона от атома.
Каждый элемент периодической системы стремится к завершению внешнего энергетического уровня, образуя при этом химические связи. Атомы инертных газов содержат на внешнем энергетическом уровне восемь электронов, поэтому не стремятся принимать или отдавать электрон, следовательно, устойчивы и соединения не образуют. Атомы с небольшим числом электронов на внешней орбите (один, два, три) будут стремиться отдать их, т.к. на предпоследнем энергетическом уровне содержится восемь электронов. Атомы элементов, у которых на внешней орбите число электронов близко к восьми, будут стремиться принять недостающие электроны. В молекуле атом, как отдавший, так и принявший электроны, имеет устойчивую восьмиэлектронную (октет) или двухэлектронную (дуплет) оболочку. Химическая связь имеет электрическую природу, но осуществляется она по-разному, поэтому различают несколько типов химической связи.
Ионная связь – это химическая связь между ионами. Элементы 1 и 2 группы образуют соединения с элементами 5 – 8 групп. При этом металлы теряют свои валентные электроны, а неметаллы присоединяют их. Металлы и неметаллы приобретают завершенный внешний электронный уровень, превращаясь при этом в заряженные частицы (ионы).
Ионы – это заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов.
Положительно заряженные ионы называются катионы, отрицательно заряженные ионы – анионы.
Ионных соединений сравнительно немного. Большинство органических и многие неорганические соединения не имеют в своем составе ионов.
Ковалентная связь – это связь между атомами неметаллов. При образовании ковалентной связи происходит перекрывание электронных орбиталей (облаков), которое сопровождается выделением энергии. Молекулярное состояние элементов неметаллов более устойчивое, чем атомное.
Химическая связь, осуществляемая общей электронной парой, называется атомной или ковалентной.
Механизм образования ковалентной связи может быть разным:
1) образование общих электронных пар.
Атомы, между которыми образуются ковалентные связи, могут обладать одинаковой или разной (ЭО) электроотрицательностью (способностью оттягивать к себе общие электронные пары), поэтому различают: неполярную и полярную связи.
А) Неполярная ковалентная связь образована одинаковыми атомами неметаллов (с одинаковой ЭО) и общая электронная пара в равной степени принадлежит обоим атомам (Н2, О2,N2 и т.д.):
Б) Полярная ковалентная связь образована разными атомами неметаллов (с разной ЭЭО) и общая электронная пара смещена к более ЭО элементу (Н2О, NН3, СО2, СН4 и т.д.):
2) донорно – акцепторный (донор – элемент, который предоставляет пару электронов на образование связи, акцептор – принимает пару электронов в свободную электронную орбиталь).
Примером такого взаимодействия является образование иона аммония
Металлическая связь – связь, характерная для металлов, т.к. их атомы легко теряют электроны.
При достаточном сближении атомов металла происходит их взаимодействие, при этом электроны утрачивают связи со своими атомами и становятся общими для всего комплекса (проявляется в твердом и жидком состоянии металла).
В металлах имеются положительно заряженные ионы, атомы и перемещающиеся между ними общие «полусвободные» электроны, которые легко подвижны, непрочно связаны с атомом и становятся одновременно общими для всех атомов. Поэтому металлы характеризуются высокой электрической проводимостью и теплопроводностью, сравнительно легко излучают электроны при нагревании и облучении их светом.
Химическая связь, основанная на обобществлении валентных электронов, принадлежащих всем атомам в кристалле, получила название металлической связи.
Металлическая связь довольно прочная, особенно у тяжелых металлов, чем объясняются их высокие температуры плавления и кипения.
Водородная связь – это своеобразная химическая связь, которая представляет особый вид межмолекулярного взаимодействия. Она образуется между молекулами, в состав которых входит атом водорода, связанный с сильноэлектроотрицательным элементом - фтором, кислородом, азотом, реже хлором, серой.
Эту связь можно рассматривать как некоторую дополнительную связь, которую проявляет атом водорода, уже связанный в молекуле ковалентной связью с другим атомом. Обычно водородную связь обозначают точками и этим указывают, что она намного слабее ковалентной связи (примерно в 15 – 20 раз). Но она ответственна за ассоциацию молекул. Например, образование димеров карбоновых кислот (в жидком состоянии они наиболее устойчивы).
Для характеристики состояния атома в молекуле вместо понятия «электроположительность» и «электроотрицательность» атома, «ковалентность» введено понятие степень окисления.
При определении этого понятия условно принимают, что в соединении валентные электроны перешли к более электроотрицательным атомам (атомам элементов, расположенных выше и правее в периодической системе), поэтому соединения состоят из положительно и отрицательно заряженных ионов.
Степень окисления – это условный заряд атома в молекуле, вычисленный согласно предположению о том, что молекула состоит только из ионов.
Степень окисления обозначают арабскими цифрами со знаком плюс (+) или минус (-) перед цифрой. Алгебраическая сумма степеней окисления атомов в молекуле всегда равна нулю.
Например, Н2SО4 степень окисления атома водорода равна (+1), серы (+6), кислорода (-2).
Все вещества могут иметь упорядоченное расположение частиц (атомов, молекул, ионов), т.е. образовывать кристаллическую решетку или находиться в аморфном состоянии, т.е. частицы располагаются неупорядоченно. Аморфные вещества (стекло, смола) не имеют определенной температуры плавления. При нагревании они постепенно размягчаются, начинают растекаться и переходят в жидкое состояние. Многие аморфные соединения текучи, т.е. при длительном действии сравнительно небольших сил постепенно изменяют свою форму.
Вещества кристаллического строения могут образовать различные типы решеток: ионные, молекулярные или атомные. Вещества с ионной кристаллической решеткой образованы из ионов, между узлами которых ионная связь. К таким соединениям относятся основные оксиды, большинство солей, основания. Все вещества твердые, не летучие (некоторые имеют невысокую летучесть, например, ацетаты), имеют сравнительно высокие температуры плавления, в расплавленном или растворенном состоянии являются электролитами.
Вещества с молекулярной решеткой непрочные, имеют небольшую твердость, легкоплавкие, летучие, часто имеют запах, обычно не проводят электрический ток. К веществам такого строения относятся неметаллы и их соединения (кроме углерода и кремния). Большинство органических соединений имеют молекулярное строение. Самые твердые, прочные, тугоплавкие вещества имеют атомную решетку. Эти вещества обычно нерастворимы в воде и многих органических растворителях, нелетучие, не имеют запах, не проводят электрический ток. К таким соединениям относятся графит, алмаз, кремнезем. Вещества с молекулярной и атомной решетками образованы ковалентными связями.
В металлах существуют свои типы кристаллических решеток, которые будут рассмотрены при изучении металлов.
По характерным свойствам веществ можно определить тип кристаллической решетки соединений и, наоборот, по типу кристаллической решетки предположить свойства веществ.
План характеристики химических соединений
Определение вида связи по формуле.
Схема образования химической связи в соединении, электронная и
структурная формулы.
Определение типа решетки в соединении.
Предполагаемые физические свойства вещества.
Вопросы и задания
Определите степени окисления элементов и виды связей в следующих соединениях: Na2S, MgO, Cun , CS2, NO2, Cl2, H2O, NaF, N2, CuS, Fen, (H2O)n.
Дайте характеристику химическим соединениям по плану: H2S, N2, MgF2.
Между атомами каких элементов образуется ионная связь? Какой тип кристаллической решетки они образуют?
Какая связь называется ковалентной? Назовите виды ковалентной связи по разным признакам. Приведите примеры.
5. Предположите типы кристаллических решеток в следующих веществах: речной песок, сахарный песок, уксусная кислота, поваренная соль, аммиак, алмаз, мел, парафиновые свечи, лед.
Лекция 6
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Изучив лекцию 6, студенты должны:
знать: понятия электролиты и неэлектролиты, электролитическая диссоциация;
уметь: писать уравнения реакций электролитической диссоциации, определять сильные и слабые электролиты.
ВЕЩЕСТВА
 ЭЛЕКТРОЛИТЫ НЕЭЛЕКТРОЛИТЫ Вещества, растворы или расплавы которых проводят электрический ток, называются электролитами (соли, кислоты, щелочи). Передача электрического тока осуществляется в них за счет движения «+» и «-» ионов. Вещества, растворы которых не проводят электрический ток, называются неэлектролитами (газы, большинство органических веществ: спирты, эфиры, углеводороды)
ЭЛЕКТРОЛИТЫ НЕЭЛЕКТРОЛИТЫ Вещества, растворы или расплавы которых проводят электрический ток, называются электролитами (соли, кислоты, щелочи). Передача электрического тока осуществляется в них за счет движения «+» и «-» ионов. Вещества, растворы которых не проводят электрический ток, называются неэлектролитами (газы, большинство органических веществ: спирты, эфиры, углеводороды) Вспомним строение молекулы воды. В молекуле воды между атомами «О» и «Н» ковалентная полярная связь. Электронные пары, связывающие атомы смещены к «О», где образуется частично «-» заряд, а у «Н» частично «+»заряд. Связи каждого атома «Н» с «О» в воде образуют между собой угол 104,50, благодаря чему молекула воды имеет угловую форму. Полярную молекулу воды изображают в виде диполя
O
H H

-



+
104,50
Рассмотрим механизм диссоциации на примере раствора соли NаCl. При растворении соли диполи воды ориентируются противоположно заряженными концами вокруг «+» и «-» ионов электролита. Между ионами электролита и диполя воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, и происходит переход ионов из кристалла в раствор. Последовательность процесса диссоциации веществ с ионной связью (солей и щелочей), будет такой:
а) ориентация молекул – диполей воды около ионов кристалла
б) гидратация (взаимодействие) молекул воды с ионами поверхностного слоя кристалла
в) диссоциация (распад) кристалла электролита на гидратированные ионы.
Упрощенно происходящие процессы можно отразить с помощью уравнения:
NаСl = Nа+ + Сl-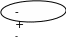


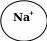




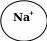


+




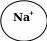






Аналогично диссоциируют и электролиты, в молекулах которых ковалентная полярная связь (например, НСl) только в этом случае под влиянием диполей воды происходит превращение ковалентной полярной связи в ионную и последовательность процессов будет такая:
а) ориентация молекул воды вокруг полюсов молекулы электролита
б) гидратация (взаимодействие) молекул воды с молекулами электролита
в) ионизация молекул электролита (превращение ковалентной полярной связи в ионную).
г) диссоциация (распад) молекул электролита на гидратированные ионы.
Уравнение диссоциации соляной кислоты с учетом механизма выглядит так:
HCl + H2O = H3O+ + Cl-
Ион, окруженный гидратной оболочкой (молекулами воды) называется гидратированным. Наличие гидратной оболочки препятствует переходу ионов в кристаллическую решетку. Образование гидратированных ионов сопровождается выделением энергии, которая расходуется на разрыв связей между ионами в кристалле.
Таким образом, при растворении солей, щелочей и кислот эти вещества распадаются на ионы.
Процесс распада электролита на ионы при растворении его в воде или расплавлении называется электролитической диссоциацией.
Часто при написании уравнений реакции кислот пишут условное уравнение, т.е. не учитывают молекулы воды:
Н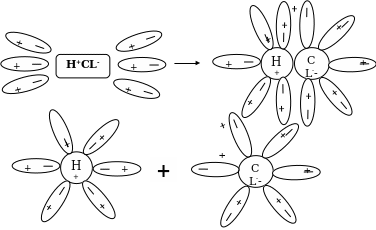 Сl = H ++ Cl-
Сl = H ++ Cl-
Теория, объясняющая особое поведение электролитов в расплавленном или растворенном состоянии распадом на ионы называется теорией электролитической диссоциации.
Ее автор шведский ученый Сванте Аррениус 1887 год.
В растворах электролитов наряду с ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации, которая обозначается греческой буквой α («альфа»).
Степень диссоциации – это отношение числа частиц, распавшихся на ионы (Nд), к общему числу растворенных частиц (NP):
α=Nд/NP
Степень диссоциации электролита определяется опытным путем и выражается в долях или процентах. Если α=0, то диссоциация отсутствует, а если α=1, или 100%, то электролит полностью распадается на ионы. Различные электролиты имеют различную степень диссоциации, то есть степень диссоциации зависит от природы электролита. Она также зависит и от концентрации: с разбавлением раствора степень диссоциации увеличивается.
По степени электролитической диссоциации электролиты разделяют на сильные и слабые.
Сильные электролиты – такие электролиты, которые при растворении в воде практически полностью диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к единице.
К сильным электролитам относятся:
1) все растворимые соли;
2) сильные кислоты, например: H2SO4, HCl, HNO3;
3) все щелочи, например: NaOH, KOH.
Слабые электролиты – это такие электролиты, которые при растворении в воде почти не диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к нулю.
К слабым электролитам относятся:
слабые кислоты – H2S, H2CO3, HNO2;
водный раствор аммиака NH3*H2O;
вода.
Вопросы и задания
1. Какие вещества относят к электролитам? Что называют электролитической диссоциацией?
2. Напишите уравнения реакций электролитической диссоциации в водных растворах следующих электролитов: HClO4; HBr; H2SeO4; NaOH; Ca(OH)2; (NH4)2SO4; Mg(NO3)2; Fe2(SO4)3
3. Напишите уравнения постепенной (ступенчатой) диссоциации следующих электролитов: Ba(OH)2; NaHCO3; MgOHNO3; KH2PO4
Лекция 7
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ.
ВИДЫ ОВР
Изучив лекцию 7, студенты должны:
знать: понятия окислитель, восстановитель, процессы окисления и восстановления, окислительно- восстановительные реакции, типы окислительно-восстановительных реакций, значение ОВР;
уметь: писать уравнения окислительно-восстановительных реакций, определять окислители и восстановители, процессы окисления и восстановления.
Мир вокруг нас велик и многообразен. Жизнь окружает нас повсюду. О ней свидетельствуют жужжание насекомых, щебетанье птиц, шуршание мелких зверьков. Она существует как в ледяных полярных зонах, так и в раскаленных пустынях. Под нашими ногами трудится несметное количество микроорганизмов, делая почву плодородной и пригодной для роста растений, которые, в свою очередь, необходимы другим формам жизни. Земля насыщена в таком изобилии, что это потрясает наше воображение. Одним словом, жизнь это самая большая ценность нашей планеты и ее самая уникальная отличительная особенность. Окружающий нас мир – это гигантская химическая лаборатория, в которой ежесекундно протекают тысячи реакций, в основном – окислительно-восстановительные, и пока они существуют, эти реакции, пока есть условия для их протекания, возможно и все окружающее нас великолепие, возможна сама жизнь.
Степень окисления – это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные и ковалентно - полярные) состоят только из ионов.
ОВР это реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ.
Существует несколько способов составления уравнений окислительно-восстановительных реакций: метод полуреакций, метод электронного баланса. Разберем метод электронного баланса, который основан на определении общего числа перемещающихся электронов.
Например, N+2O-2 + O20 N+4O2-2
(определим степени окисления всех элементов, определяем число потерянных и полученных электронов и составляем электронный баланс, т.е. равенство)
восстановитель N+2 - 2е N+4 │4 │2 (р. окисления)
окислитель O20 + 4е 2O-2 │2 │1 (р. восстановления)
2N+2O-2 + O20 2 N+4O2-2
Процесс превращения азота +2 в азот +4 – это процесс отдачи (потери) электронов, т.е окисление. Процесс превращения кислорода «О» в кислород -2 – это процесс получения электронов, т.е. восстановления. Вещество «NO» – восстановитель, а «О2 »– окислитель.
На проявление окислительно-восстановительных свойств влияет такой фактор, как устойчивость молекулы или иона. Чем прочнее частица, тем в меньшей степени она проявляет окислительно-восстановительные свойства. Например, электроотрицательность азота достаточно высока, но в его молекуле тройная связь (N ≡ N), молекула очень устойчива, азот химически пассивен. Или HCLO более сильный окислитель, чем HCLO4, так как хлорноватистая кислота менее устойчивое в растворах соединение, чем хлорная.
Для веществ, имеющих атомы элементов в промежуточной степени окисления, возможно проявление как окислительных, так и восстановительных свойств.
Классификация окислительно-восстановительных реакций.
1. Межмолекулярные ОВР – это реакции, в которых окислитель и восстановитель находятся в разных веществах.
2. Внутримолекулярные ОВР – это реакции, в которых окислитель и восстановитель находятся в одном веществе.
В отдельную группу можно выделить реакции диспропорционирования и компропорционирования
К реакциям диспропорционирования относятся внутримолекулярные ОВР, протекание которых сопровождается одновременным повышением и понижением степени окисления атомов одного и того же элемента (по сравнению с первоначальной степенью окисления).
К реакциям компрпорционирования относятся межмолекулярные ОВР, в которых окислителем и восстановителем является атом одного и того же химического элемента, но в разных степенях окисления.
На окислительно-восстановительные процессы влияет среда раствора.
Взаимодействие перманганата калия с сульфитом калия. В кислой среде образуется раствор бесцветный. В щелочной среде – раствор зеленого цвета.
В кислой среде: Mn+7 → Mn+2
В щелочной среде: Mn+7 → Mn+4
Значение ОВР
Всем известны семь чудес света. Окислительно-восстановительные реакции лежат в основе «семи чудес живой и неживой природы»
Фотосинтез, дыхание, гниение, брожение, коррозия, электролиз, горение – окислительно-восстановительные реакции.
Первый крик ребенка, порождает первый вдох, начало новой жизни. Дыхание характерно для большинства живых организмов, оно просто неотделимо от жизни.
Благодаря процессам гниения, осуществляются круговороты веществ в природе. Гнилостные бактерии, переводя органическое вещество в неорганическое, как бы, начинают круговорот жизни.
Брожение может осуществляться и под действием дрожжей, о значении которых знает каждый, достаточно остановиться на хлебопечении.
О вредном действии коррозии знают все, но нельзя и недооценивать ее значение. С глубокой древности известен способ превращения железа в сталь, через ржавление. Черкесы на Кавказе закапывали полосовое железо в землю, а, откопав его через 10-15 лет, выковывали из него свои сабли, которые могли перерубить даже ружейный ствол, щит врага. После выкапывания ржавое железо вместе с органическими веществами нагревали в горнах, ковали, а затем охлаждали водой – закаливали.
Золочение предметов известно с давних пор, так как позолоченные изделия очень красивы. Прежде, когда электролиз и гальванотехника не были изобретены, изделия из металлов золотили так: на них наносили тестообразную амальгаму золота (сплав его с ртутью); затем накаливали докрасна; при этом ртуть испарялась, а золото оставалось. Но пары ртути очень ядовиты, так, например, при золочении куполов Исаакиевского собора в Петербурге от отравления ртутью погибло 60 рабочих.
Очень трудно было нашим предкам, тем, кто отвечал за сохранность и поддержание огня всего племени, и тем, кто только, только научился его добывать. С огнем связано очень много: это и тепло родного очага, успокаивающее пламя свечи, приготовление пищи, песни у костра, но с огнем шутить нельзя, необходимо осторожно и бережно обращаться с ним, потому что его сила не только созидающая, но и разрушающая, способная погубить все живое.
Вопросы и задания
1. Расставьте коэффициенты методом электронного баланса, определите окислитель и восстановитель в следующих схемах
1 уровень:
Zn + H2SO4 (конц) ZnSO4 + H2O + S
2 уровень
KMnO4 + HCl Cl2 + KCl + MnCl2 + ?
2. Определите степени окисления элементов в следующих соединениях:
AL; CL2; HBr; KMnO4; H2 SO4; O2; H2; K2MnO4; NaNO3; HNO2.
Лекция 8
ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ
Изучив лекцию 8, студенты должны:
знать: общую характеристику металлов по положению в периодической системе химических элементов Д.И.Менделеева, строение и свойства металлов;
уметь: писать уравнения химических реакций, характерных для металлов, рассматривать их с точки зрения окислительно-восстановительных реакций.
Место положения в периодической системе
Металлы расположены в 1,2,3 группах (кроме «Н» и «В»), в побочных подгруппах всех групп. К металлам можно отнести и нижние элементы главных подгрупп всех групп (кроме 7 и 8 группы).
Строение атома металлов
Атомы металлов характеризуются малым количеством электронов на последнем энергетическом уровне (1, 2, 3) и большим радиусом атома, поэтому при химических реакциях металлы электроны отдают и, следовательно, являются восстановителями.
Строение простого вещества
В свободном состоянии Mtn.
Связь – металлическая, образована валентной зоной (атомами и ионами
металлов) и электронным газом (совокупностью электронов, свободно перемещающихся в объеме кристалла).
(Задание: сравнить с ионной и ковалентной связями).
Тип кристаллической решетки – металлическая. Кристаллические решетки металлов могут быть различных типов. Однако, для большинства металлов характерны три типа решеток: объемно-центрированная кубическая (Li, Na, K, V, Cr, ά-Fe, Pb, W и др.), гранецентрированная кубическая (Al, Ca, β-Fe, Ni, Cu, Ag, Au и др.), гексагональная (Be, Mg, Cd, Ti, Co, Zn и др.).
Железо при разных температурах имеет разный тип кристаллической решетки (до 911о и от 1392о С до плавления 1539о - ά-Fe, от 911о и до 1392о С - β-Fe).
4. Физические свойства металлов
Общие свойства:
а) теплопроводность, электропроводность (Ag, Cu – самые электропро-
водные, затем - Au, Al, Fe). Свойства объясняются наличием свободных электронов, которые приобретают направленное движение даже в незначительной разности потенциалов. В меньшей степени эти свойства проявляются у Bi и Hg.
б) металлический блеск (обычно серый). Ag – самый большой блеск (свойство используют при производстве зеркал).
в) пластичность (самый пластичный – Au – можно растянуть в невидимую, невооруженным глазом, проволоку; затем Ag, Cu, Sn, Pb, Zn, Fe; хрупкие - Mn,Bi ).
г) непрозрачность.
Особые свойства (частные):
а) металлы обладают разной плотностью, она тем меньше, чем меньше атомная масса металла и чем больше радиус его атома.
Самый легкий – Li (плотность- 0,53 г/см3 ).
Самый тяжелый – Os (плотность – 22,6 г/см3 ).
Металлы с плотностью 5 г/см3 – легкие, остальные тяжелые.
б) металлы имеют разную твердость. Самый твердый металл – Cr (режет стекло); самые мягкие – щелочные металлы - K, Rb, Cs (они режутся ножом).
в) металлы имеют разную температуру плавления. Металлы, температура плавления которых больше 1000о ,тугоплавкие, температура которых меньше – легкоплавкие. Hg при н.у. - жидкий металл (t=-38,9о ), Cs и Ga плавятся при t=29о и 28,9о . Самый тугоплавкий металл – W, его tоплавл=3390о .
Все эти свойства находят применение в народном хозяйстве. Основа современной техники – машины и механизмы – изготавливаются в основном из металлических материалов –металлов, сплавов металлов друг с другом и с некоторыми неметаллами, прежде всего с углеродом.
5. Химические свойства
Металлы – восстановители, т.е. легко отдают электроны
(взаимодействуют с окислителями: простыми веществами, кислотами, солями менее активных металлов и другими соединениями).
А). Взаимодействие с растворами кислот (все металлы ЭХРН Мt, стоящие до водорода):
Mg + HCl →
Запомнить: особые кислоты - серная конц., азотная конц. и разб. – при химической реакции с металлами водород не выделяют.
Б). Взаимодействие с растворами солей менее активных металлов:
Zn + CuSO4 →
Cu + ZnSO4 →
В). Взаимодействие с водой: (активные металлы, стоящие до Al в ЭХРН Mt → щелочь + Н2 при н.у.; металлы средней активности, стоящие от Al до Н → оксид металла + Н2 при tо ; не активные металлы, стоящие после Н в ЭХРН Mt → в реакцию не вступают).
Na + H2O →
Zn + H2O →
Cu + H2O →
Г). Взаимодействие с неметаллами:
Са + О2 →
Al + S →
Fe + Cl2 →
Переходные элементы проявляют двойственные свойства, т.е. вступают в реакции с кислотами и щелочами, при этом образуются соли и выделяется Н2.
6. ПОЛУЧЕНИЕ МЕТАЛЛОВ.
Металлы встречаются в природе в основном в виде руд, но некоторые
металлы в свободном состоянии (вспомнить какие).
Металлургия: пирометаллургия, гидрометаллургия, электрометаллургия.
Металлотермия: алюмотермия, магнийтермия, водородотермия (разные восстановители).
ВЫВОД: металлы имеют разнообразные свойства, что обусловлено их строением, поэтому находят широкое применение в народном хозяйстве.
Вопросы и задания
1. В каком виде используют металлы в народном хозяйстве?
2. Какие сплавы знаете? Где они находят применение?
3. Закончите уравнения реакций, о которых идет речь в лекции
Лекция 9
ОБЩАЯ ХАРАКТЕРИСТИКА НЕМЕТАЛЛОВ
Изучив лекцию 8, студенты должны:
знать: общую характеристику неметаллов по положению в периодической системе химических элементов Д.И.Менделеева, строение и свойства неметаллов;
уметь: писать уравнения химических реакций, характерных для неметаллов, рассматривать их с точки зрения окислительно-восстановительных реакций.
Характеристика элементов – неметаллов
А). ПОЛОЖЕНИЕ НЕМЕТАЛЛОВ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ
Неметаллы расположены в правом верхнем углу П.С. (треугольник от Ве до Аt). Неметаллов примерно в 4 раза меньше, чем металлов. Чем правее и выше расположен элемент в П.С., тем он неметалличнее.
Б). СТРОЕНИЕ АТОМОВ – НЕМЕТАЛЛОВ
На внешнем электронном уровне содержат от 4 до 8 электронов. Радиус атомов - неметаллов меньше радиуса атомов – металлов.
(Исключения: Н – 1s1 , В – 2s22p1 , Не – 2s2 ).
В). ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНАЯ СПОСОБНОСТЬ.
Неметаллы принимают электроны, являются окислителями.
Неметаллы могут отдавать электроны, тогда восстановители.
(Исключение: F – всегда окислитель, т.к. самый электроотрицательный элемент, поэтому электроны только принимает).
Окислительная способность неметаллов по периоду вправо –возрастает, по группе вниз – убывает.
Восстановительная способность неметаллов по периоду вправо – убывает, по группе вниз – возрастает.
2. Характеристика неметалла – вещества
неМt n – общая формула неметаллов. (Исключение: инертные газы – всегда одноатомны).
Какие виды связей существуют в неметаллах?
Какие типы кристаллических решеток могут быть в веществах – неметаллах?
Предскажите физические свойства веществ, имеющих разные кристаллические решетки?
Что называют аллотропией? Назовите аллотропные видоизменения кислорода, углерода, фосфора.
Химические свойства неметаллов
неМt – окислители: а) с металлами;
б) неметаллами менее электроотрицательными;
в) с солями менее активных неметаллов;
г) сложными веществами – восстановителями.
неМt – восстановители: а) с оксидами металлов;
б) с кислотами – окислителями.
Соединения неметаллов.
А) ЛЕТУЧИЕ ВОДОРОДНЫЕ СОЕДИНЕНИЯ
RH4 RH3 RH2 RH
характер: безразл. основан. амфотерн. кислоты
кислоты
Приведите примеры водородных соединений 2 –го и 3 – го периодов.
Как изменяется прочность и сила водородных соединений по периоду и группе?
Б) КИСЛОРОДНЫЕ СОЕДИНЕНИЯ
неМt → кислотный оксид → кислота
Приведите примеры кислородных соединений: серы, азота, хлора.
Как изменяются сила и прочность кислородных соединений по периоду и группе?
ВЫВОД: 1. Общие свойства неметаллов объясняются сходством в строении (много электронов на внешнем электронном уровне, малый радиус атома).
2. Свойства неметаллов и их соединений изменяются по периоду и группе, т.к. изменяются радиус атома и число электронов на внешнем электронном уровне.
Вопросы и задания
1.Особенности строения неметаллов. Окислительно-восстановительная способность неметаллов.
2. Приведите примеры реакций, в которые вступают неметаллы. Рассмотрите их с точки зрения окислительно-восстановительных процессов.
3. Особенности водородных соединений неметаллов.
4. Особенности кислородных соединений неметаллов.
26












