Углеводороды – это большая группа органических соединений, которая имеет важное значение в органической химии.
Основные классы углеводородов: предельные, непредельные, ароматические
ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
АЛКАНЫ
Цель: изучить строение и свойства предельных углеводородов. Дать понятие циклоалканам
Предельные углеводороды – это углеводороды с общей формулой CnH2n+2 , в молекулах которых содержатся только простые (ординарные) связи.
Алканы могут быть с открытой С – цепью и с замкнутой С – цепью.
Предельные углеводороды (парафины, алканы)

«не присоединяющие» (греч.)
содержат только простые (ординарные) связи.


открытая С – цепь – Алканы ; замкнутая С – цепь – Циклоалканы
Два отдельных
гомологических ряда.
(характеристика гомологов каждого ряда – сравнительная таблица)
Подумайте: 1) Какой тип гибридизации будет у циклоалканов?
2) Характеристика sp3-гибридизации (вал. угол, длина связи, форма молекулы.)
Свойства алканов
а) Физические – в любом гомологическом ряду с увеличением числа атомов углерода в цепи (т. е. с увеличением относительной молекулярной массы) возрастают температуры плавления, кипения, плотность вещества. Это подтверждает закон природы: перехода количественных изменений в качественные. Поэтому алканы могут существовать в трех различных агрегатных состояниях: газы (от метана до пентана), жидкости (бензин с характерным запахом), вазелин – смесь жидких и твердых углеводородов, парафин – смесь твердых углеводородов, имеет аморфное состояние.
Все газообразные и жидкие алканы образуют взрывоопасные смеси с воздухом, поэтому с ними нужно обращаться очень осторожно.
Метан называют болотным газом. Почему? (Образуется при гниении растительных и животных остатков). Наш город имеет непосредственное отношение к изучаемой теме, т. к. алканы входят в состав нефти, природного и попутного газа.
б). Химические
Для алканов самая характерная реакция – реакция замещения, она имеет цепной характер и свободно – радикальный механизм. Реакция не заканчивается до тех пор, пока существуют радикалы – реакционно активные частицы. После того, как все радикалы образуют соединения, реакция заканчивается.
Соединения образуются разные – это и хлорпроизводные и гомологи алканов и неорганические вещества.
Химические свойства, характерные для веществ, связаны с их применением в народном хозяйстве.
| Химические свойства | Применение |
| 1. Горение: СН4 + 2О2 → СО2↑ +2Н 2О +880 кДЖ/моль 2. Реакции разложения: а) полное: СН4 → С + 2Н2↑ (to≥1000о)
б) неполное: 2СН4 → С2Н2 + 3Н2↑ (to=1500o)
3. Изомеризация СН3-СН2-СН2-СН3 → СН3-СН-СН3 │ СН3 (cat – AlCl3) 4. Реакции замещения: СН4→СН3Cl→CH2Cl2→CHCl3→CCl4 CH4 + Cl2→CH3Cl + HCl и т.д. (реакция идет на свету) | 1.Топливо в быту и в промышленности
2. С – для получения типографской краски, резины. Н2 – восстановитель. C2H2 – ацетилен – сварка и резка металлов, получение уксусной кислоты, этилового спирта, эфира, бензола и т.д. 3. Изомеры улучшают качество бензина, увеличивают его детонационную стойкость.
4. Все галогенопроизводные - растворители. Фторпроизводные (фреоны) – хладоагенты бытовых и промышленных холодильников и кондиционеров. |
Получение
В промышленности:
Выделяют из природных углеводородов: природного и попутного газов, нефти.
В лаборатории:
1) Нагревание ацетата натрия с гидроксидом натрия:
СН3СООNa + NaOH = CH4 + Na2CO3
2) Углеводороды с большим числом атомов углерода в молекуле получают реакцией Вюрца из галогенопроизводных:
2СН3I + 2Na → CH3 __ CH3 + 2NaI
этан
Вопросы и задания
1. Почему предельные углеводороды не вступают в реакции присоединения?
2. Почему сжигают попутный газ при добыче нефти?
3. Напишите гомологи изомеры для гексана, гептана, циклопентана.
ВЫВОД: строение вещества определяет его реакционную способность, а свойства обусловливают области применения вещества.
НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
АЛКЕНЫ. ГОМОЛОГИЧЕСКИЙ РЯД, ИЗОМЕРИЯ, НОМЕНКЛАТУРА. СВОЙСТВА, ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ ЭТИЛЕНА
Цель: изучить строение, свойства и применение непредельных углеводородов, содержащих двойную связь.
Непредельные углеводороды – это УВ, содержащие кратные (двойные или тройные) связи.
Алкены (Этиленовые углеводороды) – это УВ с общей формулой СnH2n, в молекулах которых содержится одна двойная связь.
1. Строение на примере этилена (этена). В молекуле 1 – двойная связь, образована: 1 – сигма связь – центральное перекрытие SP2 – гибридных электронных облаков, очень прочная связь;
1 – пи связь – боковое перекрытие негибридизованных Р – электронных облаков, непрочная связь.
2. Гомологический ряд, номенклатура – суффикс –ен в названиях всехУВ.
3. Изомерия: а)структурная (по положению углеродного скелета, по положению кратной связи, межклассовая);
б)геометрическая, стереоизомерия, пространственная, (цис-, транс-изомерия).
4. Физические свойства
Этилен (С2Н4) – бесцветный газ, почти без запаха, немного легче воздуха, плохо растворим в воде.
С3 – С4 – газы, С5 – С18 – жидкости, С19 и выше – твердые вещества. С увеличением количества атомов углерода в составе алкена увеличивается температура кипения и плавления. В свободном состоянии алкены в природе практически не встречаются
5. Химические свойства и применение
| Химические свойства | Применение
|
| 1. Реакции окисления А) полное (горение) С2Н4 + О2 →
Б) неполное окисление раствором перманганата калия (р. Вагнера) Н2С = СН2 + [О] + Н2О →
В) частичное окисление (tо 150о-350о) Н2С = СН2 + О2 → оксид этилена | С воздухом этилен и его гомологи образуют взрывчатые смеси. Реакция практического применения не имеет.
Для получения антифризов (этиленгликоль), синтетических волокон (лавсан), взрывчатых веществ.
Для получения уксусного альдегида, СМС, лаков, пластмасс, синтетических каучуков и т.д. |
| 2. Реакции присоединения А) галогенирование – присоединение галогенов (Cl2, Br2 …) Н2С = СН2 + Br2→ Б) гидрирование – присоединение водорода Н2С = СН2 + Н2→ В) гидратация – присоединение воды Н2С = СН2 + НОН→ Г) гидрогалогенирование – присоединение галогеноводородов (НCl, НBr …) Н2С = СН2 + НBr→ |
Получение растворителей (хлорпроизводные), обеззараживание зернохранилищ.
Получение синтетических спиртов, а из спиртов получение синтетических каучуков
Местная анестезия (медицина – замораживание – хлорэтан) |
| Если атомов углерода больше двух, то присоединение воды и галогеноводородов происходит по правилу Марковникова |
| 3. Реакции полимеризации (соединение одинаковых или разных молекул в более крупные, образование полимеров) n Н2С = СН2 → (- Н2С – СН2 -)n полиэтилен |
Получение полимеров: полиэтилена, полипропилена, поливинилхлорида, тефлона и т. д. |
|
| Этилен ускоряет созревание плодов: томатов, яблок, дынь, арбузов и т.д., поэтому этиленом обрабатывают хранилища, если хотят ускорить процесс созревания |
| Алкены – химически активные вещества, т.к. содержат кратную связь (очень подвижная пи – связь), поэтому они имеют широкое применение. Свойства обеспечиваются строением и обуславливают применение. |
6. Получение
А) Дегидратация спиртов
Б) Дегалогенирование дигалогеналканов
В) Дегидрогалогенирование галогеналканов
Г) Дегидрирование алканов
Вопросы и задания
1. Написать все уравнения реакций, характерных для алкенов, дать названия полученным веществам
2. Почему алкены вступают в реакции присоеднения?
3. Какая реакция носит название реакция Вагнера? Почему эту реакцию считают качественной для непредельных углеводородов?
4. Запишите формулы гомологов и изомеров пентена и гексена.
АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ (АЛКИНЫ).
АЦЕТИЛЕН – ПРЕДСТАВИТЕЛЬ УГЛЕВОДОРОДОВ С ТРОЙНОЙ СВЯЗЬЮ В МОЛЕКУЛЕ. ОСОБЕННОСТИ СВОЙСТВ АЦЕТИЛЕНА И ПРИМЕНЕНИЕ ЕГО В ОРГАНИЧЕСКОМ СИНТЕЗЕ
Цель: расширить знания учащихся о непредельных углеводородах – познакомить с ацетиленом и его гомологами; рассмотреть электронное и пространственное строение, дать понятие sp – гибридизации; изучить физические и химические свойства алкинов, связать с применением; выяснить способы получения алкинов.
Углеводороды с общей формулой СnH2n-2, в молекулах которых содержится одна тройная связь, относятся к ряду алкинов.
Первый представитель ряда – ацетилен, поэтому этот ряд еще называют «ацетиленовые».
Молекулярная формула: С2Н2, структурная: Н-С ≡ С-Н, сокращенная
НС ≡ СН.
СТРОЕНИЕ:– sp – гибридизация, вал. угол 180о, длина связи – 0,120нм, форма молекулы – линейная. Между атомами углерода тройная связь: одна – σ – связь и две – п – связи.
ГОМОЛОГИЧЕСКИЙ РЯД
1) --------
2) С2Н2 – (ацетилен), этин
3) С3Н4 – (метилацетилен) пропин
4) С4Н6 – бутин
5) С5Н8 – пентин и т. д.
ИЗОМЕРИЯ
1). Изомерия кратной связи. Нумерация углеродов начинается с той стороны, где ближе тройная связь. Например, С4Н6
1 2 3 4 1 2 3 4
НС ≡ С – СН2 –СН3 1 – бутин, Н3С – С ≡ С – СН3 2 – бутин
2). Изомерия углеродного скелета. (для бутина такого изомера нет, почему?)
С5Н8
1 2 3 4 5 1 2 3 4
НС ≡ С - СН2 – СН2 – СН3 1-пентин, НС ≡ С – СН – СН3
│
СН3
3 – метил, 1 – бутин
3). Изомерия гомологических рядов. ( изомеры из класса алкинов и алкадиенов).
1 2 3 4 5 1 2 3 4 5
НС ≡ С - СН2 – СН2 – СН3 Н2С = СН - СН2 – СН = СН2
1 – пентин 1,4 – пентадиен
Геометрической изомерии у алкинов нет, т.к. при углеродах с тройной связью только один радикал.
ФИЗИЧЕСКИЕ СВОЙСТВА
Ацетилен – газ, легче воздуха (доказать), мало растворим в воде, в чистом виде почти без запаха. С увеличением количества атомов углерода в молекуле, увеличивается плотность вещества, температура кипения и плавления. (это закономерность – перехода количественных изменений в качественные).
ХИМИЧЕСКИЕ СВОЙСТВА И ПРИМЕНЕНИЕ АЛКИНОВ.
| Уравнения химических реакций | Применение |
| 1. Реакции окисления. а) полное (горение): 2С2Н2+5О2 →4СО2↑+2Н2О+Q (пламя коптящее, почему?) Смеси ацетилена с воздухом взрывоопасны. Ацетилен взрыв. и от удара, поэтому хранят и трансп. в баллонах
б) окисление раствором марганцовки (получается щавелевая кис- лота, раствор марганцовки обесцвечивается.) | Для сварки и резки ме- таллов (to=3150о). Почему пламя не коп- Тит при сжигании ацетилена при сварке металлов? (избыток кислорода)
для получения двухоосновных кислот |
| 2.Реакции присоединения. а)галогенов (обесцвечивает бромную воду; (р-ция идет в две 2 стадии) НС≡СН+Br2→CHBr=CHBr 1,2-дибромэтен CHBr=CHBr+Br2→CHBr2-CHBr2 1,1,2,2-тетрабромэтан б)водорода – гидрирование (кат. – Ni,Pt,Pd) НС≡СН+Н2→Н2С=СН2 этен Н2С=СН2+Н2→Н3С-СН3 этан в) воды – гидратация (кат. сульфат ртути II) НС≡СН+Н2О→[Н2С=СНОН]→Н3С - СНО уксусный альд.(р.Кучерова) |
Хлорпроизводные - рас- творители
Получение этиленовых и и предельных углеводородов
Для получ. уксусн. альд. затем уксусной кислоты |
| г) галогеноводородов: НС≡СН + НСl→Н2С=СНСl (винилхлорид) | Для получения поливинилхло- рида |
| 3. Р. полимеризации а)Тримеризация ацетилена 3НС≡СН→С6Н6 (бензол) – условие р-ции:t=400-500o,cat- -активированный уголь. б) Димеризация ацетилена 2НС≡СН→НС≡С-СН=СН2 (винилацетилен) – условие р.- cat-CuCl2 в NH3 и в Н2О | Бензол используют для получения, растворителей, красителей, кау- чуков, пластмасс.
Винилацетилен использ. для получения хлоропрена, затем получают каучук. |
ПОЛУЧЕНИЕ
В лаборатории: взаимодействие карбида кальция с водой
CaC2 + 2HOH → НС≡СН + Ca(OH)2
В промышленности: карбид кальция получают с большими затратами электроэнергии, поэтому
1) используют метан, выделенный из природного газа
2СН4 → НС≡СН +3Н2 (to=1500oC)
2) Разработаны способы выделения ацетилена из продуктов пиролиза нефти.
Вопросы и задания
1. Написать структурные формулы веществ: 3 – метил,1 –пентин;
3,3 – диметил,1 – гептин
2. Почему алкины легко вступают в реакции присоединения и полимеризации?
3. Напишите формулы гомологов и изомеров для пентина и гексина.
4. Запишите уравнение реакции горения пропилена и рассчитайте содержание углерода в соединении
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
Цель:I познакомиться с ароматическими углеводородами на примере бензола и его гомологов.
Арены – это углеводороды с общей формулой СnH2n-6, в молекулах которых содержится хотя бы одно бензольное кольцо.
Существуют несколько основных видов аренов:
1. Моноциклические арены
2. Арены, содержащие два или несколько изолированных цикла
3. Арены с сопряженными циклами (сопряженные или конденсированные)
Бензол был выделен М. Фарадеем в 1825 г. Майкл Фарадей - английский физик и химик, член Лондонского королевского общества, открыл бензол, изучил его физические и некоторые химические свойства.
Строение бензола было описано Ф.А. Кекуле в 1865 г.
Ф.А. Кекуле - немецкий химик-органик. Предложил структурную формулу молекулы бензола. С целью проверки гипотезы о равноценности всех шести атомов водорода в молекуле бензола получил его галоген-, нитро-, амино-, и карбоксипроизводные. Открыл перегруппировку диазоамино- в азоаминобензол, синтезировал трифенилметан и антрахинол.
Строение бензола:
Сигма связи образованы атомами углерода – второе валентное состояние, тип гибридизации - sp2, валентный угол – 120о, длина связи – 0,140нм.
Особенность бензольного кольца (ядра) – образовано шестью негибридизованными р- электронными облаками, очень прочное, принадлежит всем атомам углерода.
Изомерия и номенклатура аренов.
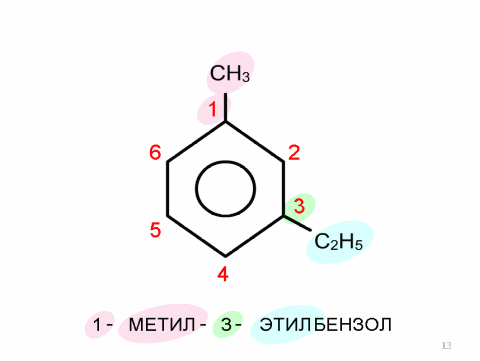
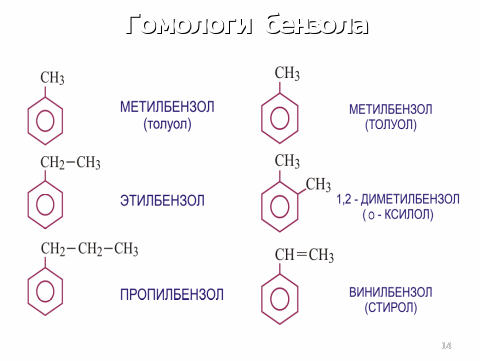
Физические свойства аренов
В обычных условиях низшие арены – бесцветные жидкости с характерным запахом. Они не растворимы в воде, но хорошо растворяются в неполярных растворителях: эфире, четыреххлористом углероде, лигроине. Помимо этого бензол и его гомологи могут сами выступать в роли растворителей. Температуры плавления аренов зависят от степени симметричности молекулы. Чем выше симметрия, тем выше температура плавления.
Химические свойства аренов
Для разрыва ароматической системы аренов необходимо затратить большую энергию, поэтому арены вступают в реакции присоединения только в жестких условиях: при значительном повышении температуры или в присутствии очень активных реагентов.
В связи с этим, наиболее характерными для них будут:
А) реакции замещения атомов водорода, протекающие с сохранением ароматической системы.
Механизм реакций – электрофильное замещение SE, характер ионный.
1. Реакция галогенирования (cat – Fe, tо )
С6Н6 + Br2 → С6Н5Br + HBr
бромбензол
2. Реакция нитрования (cat – H2SO4 конц., tо )
С6Н6 + HONO2→ С6Н5 NO2 + H2O
нитробензол
3. Реакция алкилирования (cat –AlCl3, tо)
С6Н6 + СH3Cl→ С6Н5 –CH3 + HCl
метилбензол
(толуол)
Эту реакцию называют реакцией Фриделя – Крафтса, которую они осуществили в 1877году (француэ Шарль Фридель и американский химик Джеймс Мейсон Крафтс)
Атомы углерода и водорода в бензоле перестают быть неразличимы после того, как в кольце появился первый заместитель. Свойства гомологов бензола (и первого из них толуола) – яркий пример взаимного влияния атомов в молекуле органического вещества. Гомологи бензола более химически активнее, чем бензол.
Б) Реакции присоединения – протекают гораздо сложнее
1. Гидрирование бензола (cat –Ni? tо)
С6Н6 + 3Н2 → С6Н12
Циклогексан
2. Реакция галогенирования (протекает на свету)
С6Н6 + 3Br2 → С6Н6Br6
гексабромциклогексан
Реакции окисления
Полное окисление (горение)
С6Н6 + 15О2 → 12СО2 + 6H2О
Вопросы и задания
1. Особенности физических свойств Аренов
2. Какие реакции характерны для Аренов?
3.Какие реакции идут легче, почему?
4. Назовите первого гомолога бензола.
5. В чем отличие химических свойств толуола от бензола?
6. Задача.
Какой объем водорода присоединится к 156 г бензола при его гидрировании?
7. Напишите формулы аренов по названиям:
1,3-диметилбензол, 1,2-диметилбензол, 1,4-диметилбензол, бутилбензол, 1-метил,2-этил,3-пропилбензол, 1-бром,2-этилбензол.

























