Лабораторная работа № 2
Общие свойства металлов.
Свойства гидроксидов железа, хрома и меди.
Цели: научиться проводить химические реакции, характеризующие свойства металлов и их гидроксидов; закрепить умения изображать реакции в молекулярном и ионном виде.
Краткая теория
Химические свойства металлов обуславливаются главным образом наличием в их атомах электронов, слабо связанных с ядром. Общим химическим свойством является способность металлов только отдавать электроны, превращаясь в положительно заряженные ионы по схеме:
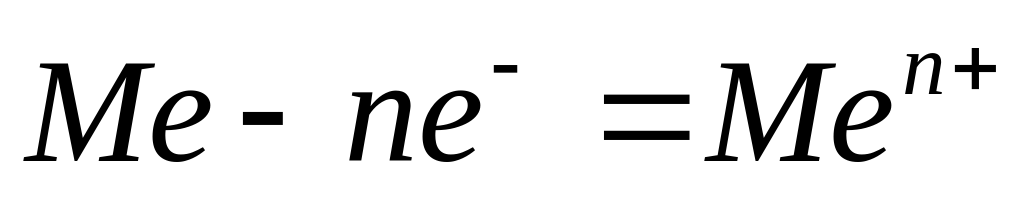 ,
,
где Ме – химический символ металла,
n – число электронов.
По степени легкости отдачи электронов в растворах металлы можно расположить в ряд напряжений металлов:
Li, Cs, K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H2, Cu, Ag, Hg, Au

усиление восстановительной способности
Например, реакция замещения между солью и металлом
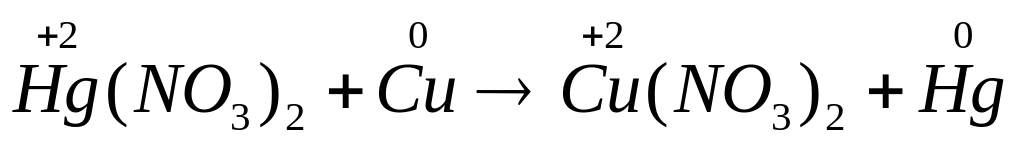
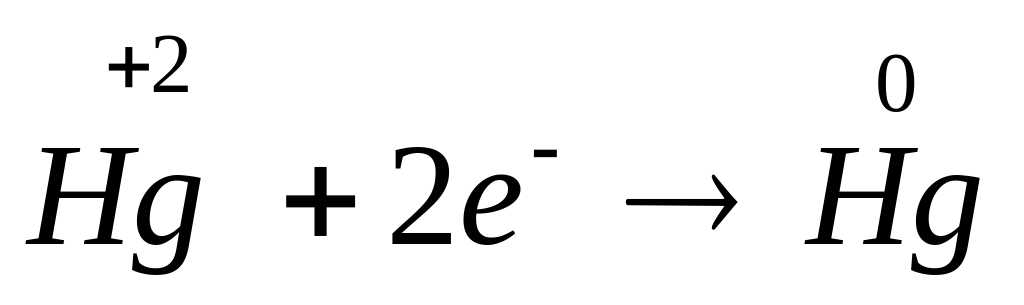



2
1 восстановление, окислитель
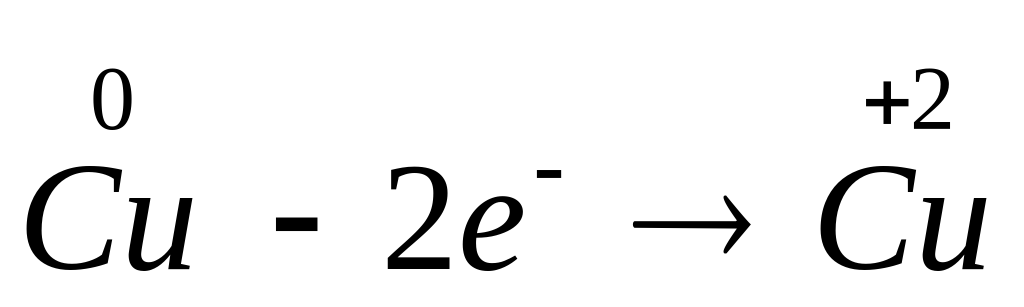 1 окисление, восстановитель
1 окисление, восстановитель
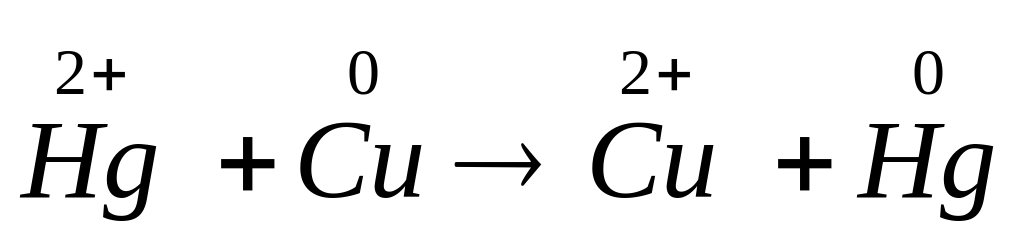
Вывод: данная реакция возможна, так как восстановительные способности меди выше, чем ртути.
Гидроксиды металлов можно получить при действии щелочей на растворимые в воде соли металлов.
Гидроксиды железа, хрома и меди нерастворимы в воде, но растворимы в кислотах. Гидроксид хрома (III) растворим и в щелочах, то есть проявляет амфотерные свойства.
Пример. Получите гидроксид цинка, докажите его амфотерный характер. Запишите уравнения реакций в молекулярном и кратком ионном виде.
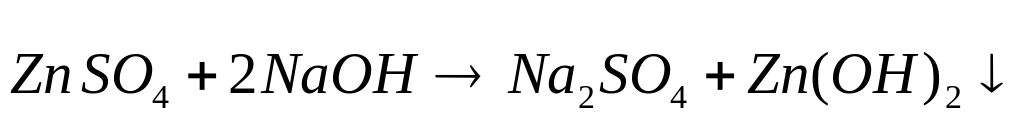
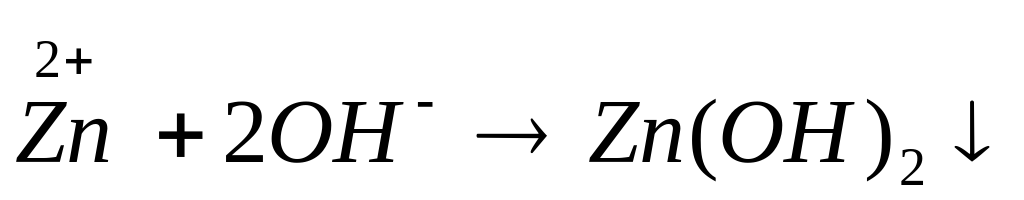
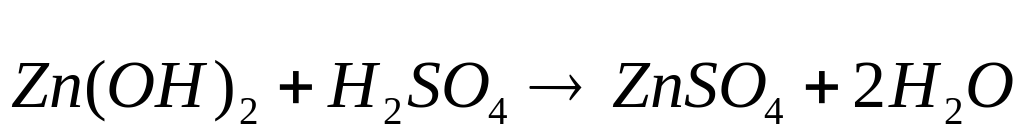
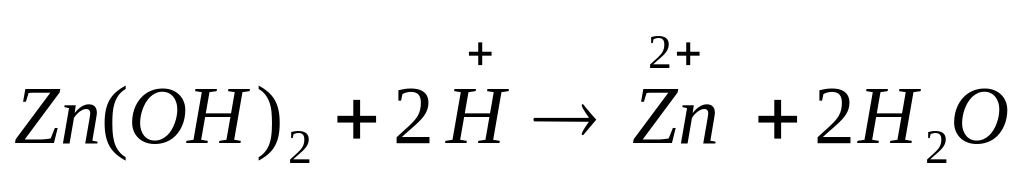
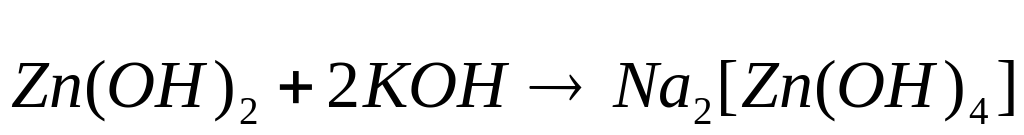
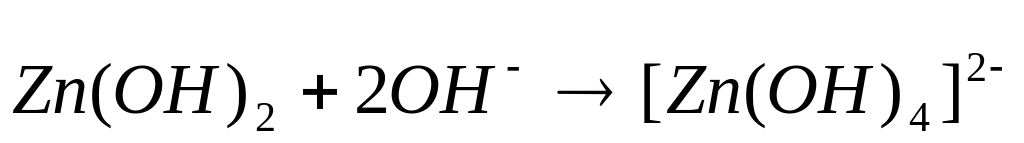
Вывод: гидроксид цинка является амфотерным соединением, так как вступает в реакцию с кислотой и щелочью.
Ход работы
Реактивы: хлорид цинка, хлорид меди (II), цинк металлический, медь металлическая, серная кислота, соляная кислота, гидроксид калия, хлорид железа (III),сульфат железа (II), сульфат меди (II), сульфат хрома (III).
Задания
Выполнить опыты.
Заполнить таблицу.
Выполнить свой вариант самостоятельной работы.
Опыт 1. Проведите возможные реакции замещения между металлами и солями.
Опыт 2. Получите гидроксид железа (II) и гидроксид железа (III), гидроксид меди (II) и докажите их основной характер.
Опыт 3. Получите гидроксид хрома (III) и опытным путем докажите его амфотерность.
Задания для самостоятельной работы
На основании каких свойств составлен электрохимический ряд напряжений металлов?
Как изменяются восстановительные способности металлов в ряду напряжений?
Какие из перечисленных реакций возможны и почему?
а) Mg + ZnSO4 б) Ag + CuCl2
в) Fe + Al(NO3)3 г) Pb + AgNO3
Какими химическими свойствами обладают амфотерные гидроксиды?
Анодным или катодным покрытием является никель для цинка, серебра? В чем сущность электрохимической коррозии?
Осуществить превращения, дать названия веществам, возможные реакции изобразить в ионном виде.
Li Li2O LiOH Cu(OH)2 CuCl2 Cu;
Ca Ca(OH)2 Fe(OH)2 FeSO4 Fe;
CaO
Al Al(OH)3 AlCl3 Al(OH)3 Al(NO3)3 Al;
Fe FeCl3 Fe(OH)3 FeCl3 Fe(CNS)3;
Fe3O4
Na Na2O2 Na2O NaOH Na2CO3 CaCO3;
Cu CuCl2 Cu(OH)2 CuSO4 Cu;
CuO
Cr CrCl3 Cr(OH)3 K3[Cr(OH)6];
Cr2O3 Cr2(SO4)3
K KOH Zn(OH)2 ZnSO4 Zn;
K2O4
CaO Ca(OH)2 CaCO3 Ca(HCO3)2 CaCO3;
CaCO3
Fe FeCl2 FeCl3 Fe(OH)3 Fe2O3 Fe;
Ba BaCl2 Ba Ba(OH)2 BaSO4 Ba(OH)2;
Na2O2 Na2O NaOH NaCl NaNO3;
Na2CO3
CaCO3 CaCl2 Ca(NO3)2 Ca3(PO4)2 Ca(OH)2 CaSO4;
Al Al2O3 AlCl3 Al(OH)3 Al2O3 KAlO2;
Cr Cr2O3 Cr Cr2(SO4)3 Cr(OH)3 CrCl3;
Cu CuO CuSO4 Cu(OH)2 Cu(NO3)2 Cu.



























