Лекционный учебный материал
Учебная дисциплина ОУД .10 Химия
Преподаватель
Специальность
Группы
Тема: Кислородсодержащие органические соединения.
Цель: изучить гомологический ряд предельных одноатомных спиртов, альдегидов ,карбоновых кислот строение, физические и химические свойства, способы их получения, применение, биологическое влияние на организм; расширить понятия о генетических связях между классами органических веществ и показать усложнение их состава и строения при переходе от углеводородов к кислородосодержащим.
Содержание
-
Спирты. Строение предельных одноатомных спиртов. Гомологический ряд спиртов, изомерия. Рациональная и систематическая номенклатура. Основные способы получения спиртов. Химические свойства спиртов.
-
Многоатомные спирты, их строение. Особенности свойств многоатомных спиртов. Качественная реакция на многоатомные спирты. Применение этиленгликоля и глицерина.
-
Альдегиды. Их функциональная группа. Общая формула, гомологический ряд и структурная изомерия, номенклатура. Получение и свойства альдегидов
-
Карбоновые кислоты
-
Углеводы.
Спирты.
Классификация спиртов.
Спирты - органические соединения, в состав молекул которых входит одна или несколько гидроксильных групп, соединенных с углеводородным радикалом.
По числу гидроксильных групп в молекуле спирты делятся на одноатомные, двухатомные трехатомные и т. д.
| Одноатомные спирты: | Двухатомный спирт: | Трехатомный спирт: |
| CH3—OH метанол (метиловый спирт) | CH3CH2—OH этанол (этиловый спирт) | HO—CH2—CH2—OH этандиол-1,2 (этиленгликоль) |  пропантриол-1,2,3 (глицерин) |
Общая формула одноатомных спиртов - R—OH.
По типу углеводородного радикала спирты делятся на предельные, непредельные и ароматические.
| Предельный спирт: | Непредельный спирт: | Ароматический спирт: |
| CH3CH2CH2—OH
пропанол-1 (пропиловый спирт) | CH2=CH—CH2—OH
пропенол-2,1 (аллиловый спирт) | C6H5—CH2—OH
фенилметанол (бензиловый спирт) |
Предельные одноатомные спирты.
Общая формула предельных одноатомных спиртов - CnН2n+1—OH.
Органические вещества, содержащие в молекуле гидроксильные группы, непосредственно связанные с атомами углерода бензольного кольца называются фенолами. Например, C6H5—OH - гидроксобензол (фенол). По типу атома углерода, с которым связана гидроксильная группа, различают первичные (R—CH2—OH), вторичные (R—CHOH—R') и третичные (RR'R''C—OH) спирты.
| Первичный спирт: | Вторичный спирт: | Третичный спирт: |
| CH3CH2CH2CH2—OH
бутанол-1 (бутиловый сприт) | 
бутанол-2 (втор-бутиловый спирт) | 
2-метилпропанол-2 (трет-бутиловый спирт) |
Номенклатура и изомерия.
Название спирта образуется прибавлением суффикса -ол к названию соответствующего углеводорода или на основе углеводородного радикала.
Для спиртов характерна структурная изомерия (изомерия углеродного скелета, изомерия положения заместителя или гидроксильной группы), а также межклассовая изомерия (предельные одноатомные спирты изомерны простым эфирам - соединениям с общей формулой R—O—R')
Изомеры и гомологи
| гомологи | CH3OH метанол |
|
| CH3CH2OH этанол |
| CH3OCH3 диметиловый эфир |
|
| CH3CH2CH2OH пропанол-1 |  пропанол-2 |
| CH3OCH2CH3 метилэтиловый эфир |
|
| CH3(CH2)3OH бутанол-1 |  бутанол-2 |  2-метил-пропанол-2 |  2-метил-пропанол-1 | CH3OCH2CH2CH3 метилпропиловый эфир | CH3CH2OCH2CH3 диэтиловый эфир |
|
| и з о м е р ы |
Алгоритм составления названий одноатомных спиртов
-
Найдите главную углеродную цепь - это самая длинная цепь атомов углерода, с одним из которых связана функциональная группа.
-
Пронумеруйте атомы углерода в главной цепи, начиная с того конца, к которому ближе функциональная группа.
-
Назовите соединение по алгоритму для углеводородов.
-
В конце названия допишите суффикс -ол и укажите номер атома углерода, с которым связана функциональная группа.
Физические свойства спиртов во многом определяются наличием между молекулами этих веществ водородных связей:

С этим же связана и хорошая растворимость в воде низших спиртов.
Простейшие спирты - жидкости с характерными запахами. С увеличением числа атомов углерода температура кипения возрастает, а растворимость в воде падает. Температура кипения у первичных спиртов больше, чем у вторичных спиртов, а у вторичных - больше, чем у третичных. Метанол крайне ядовит.
Химические свойства спиртов
-
Горение:
C2H5OH + 3O2  2CO2 +3H2O
2CO2 +3H2O
-
Реакции с щелочными и щелочноземельными металлами ("кислотные" свойства):
2Na + 2R—O—H  2RONa + H2
2RONa + H2
из-за влияния радикала кислотные свойства спиртов убывают в ряду
метанол  первичные спирты
первичные спирты  вторичные спирты
вторичные спирты  третичные спирты
третичные спирты
С твердыми щелочами и с их растворами спирты не реагируют.
-
Реакции с галогеноводородами:
C2H5OH + HBr  C2H5Br + H2O
C2H5Br + H2O
-
Внутримолекулярная дегидратация (t 140oС, образуются алкены):
C2H5OH  C2H4 + H2O
C2H4 + H2O
-
Межмолекулярная дегидратация (t oС, образуются простые эфиры):
2C2H5OH  C2H5OC2H5 + H2O
C2H5OC2H5 + H2O
-
Окисление (мягкое, до альдегидов):
CH3CH2OH + CuO  CH3—CHO + Cu + H2O
CH3—CHO + Cu + H2O
Это качественная реакция на спирты: цвет осадка изменяется с черного на розовый, ощущается своеобразный "фруктовый" запах альдегида.
Получение спиртов
-
Щелочной гидролиз галогеналканов (лабораторный способ):
C2H5Cl + NaOH  C2H5OH + NaCl.
C2H5OH + NaCl.
-
Гидратация алкенов: C2H4 + H2O  C2H5OH.
C2H5OH.
-
Брожение глюкозы : C6H12O6  2C2H5OH + 2CO2
2C2H5OH + 2CO2 .
.
-
Синтез метанола: CO + 2H2  CH3OH
CH3OH
Применение. Из одноатомных спиртов наиболее широко применяется этиловый спирт. Синтетический этиловый спирт применяется в различных отраслях промышленности: для получения синтетического каучука, уксусной кислоты, пороха, лекарств.
Метиловый спирт применяется главным образом в производстве формальдегида, эфиров.
Многоатомные спирты
Многоатомные спирты – это органические соединения, в молекулах которых содержатся две или более гидроксильных групп, соединенных с углеводородным радикалом.
Группы -ОН в многоатомных спиртах размещаются у разных атомов углерода:

Соединения с двумя группами -ОН при соседних атомах углерода называют гликолями (или диолами).
Получение
-
Гликоли получают окислением алкенов в водной среде. Например, при действии перманганата калия или кислорода воздуха в присутствии серебряного катализатора алкены превращаются в двухатомные спирты:

-
Другой способ получения многоатомных спиртов – гидролиз галогенпроизводных углеводородов:

-
На производстве глицерин получают по схеме:

Физические свойства
Этиленгликоль и глицерин – бесцветные вязкие жидкости со сладким вкусом (от греч.  – сладкий). Растворимость в воде – неограниченная. Температуры кипения этиленгликоля – 197,2 °С, глицерина – 290 °С. Этиленгликоль – яд.
– сладкий). Растворимость в воде – неограниченная. Температуры кипения этиленгликоля – 197,2 °С, глицерина – 290 °С. Этиленгликоль – яд.
Химические свойства
Качественная реакция многоатомных спиртов, позволяющая отличить соединения этого класса, – взаимодействие со свежеприготовленным гидроксидом меди(II). В щелочной среде при достаточной концентрации глицерина голубой осадок Cu(OH)2 растворяется с образованием раствора ярко-синего цвета – гликолята меди(II):

Применение многоатомных спиртов
Альдегиды
Альдегиды - органические вещества, молекулы которых содержат карбонильную группу — —, связанную с атомом водорода и углеводородным радикалом.
—, связанную с атомом водорода и углеводородным радикалом.
Общая формула альдегидов  или R—CHO. Функциональная группа альдегидов (—CHO) называется альдегидной группой. Альдегиды называются карбонильными соединениями, их общая формула - CnH2nO.
или R—CHO. Функциональная группа альдегидов (—CHO) называется альдегидной группой. Альдегиды называются карбонильными соединениями, их общая формула - CnH2nO.
Изомеры и гомологи
| гомологи | HCHO метаналь (формальдегид, муравьиный альдегид) |
|
| CH3CHO этаналь (ацетальдегид, уксусный альдегид) |
|
| CH3CH2CHO пропаналь (пропионовый альдегид) |
| CH3—CO—CH3 пропанон (ацетон) |
| CH3CH2CH2CHO бутаналь (масляный альдегид) |  2-метилпропаналь | CH3—CO—CH2CH3 бутанон (метилэтилкетон) |
|
| и з о м е р ы |
В молекулах альдегидов, в отличие от спиртов нет атомов водорода со значительным положительным частичным зарядом, поэтому между молекулами альдегидов нет водородных связей.
Алгоритм составления названий альдегидов
-
Найдите главную углеродную цепь - это самая длинная цепь атомов углерода, включающая атом углерода альдегидной группы.
-
Пронумеруйте атомы углерода в главной цепи, начиная с атома углерода альдегидной группы.
-
Назовите соединение по алгоритму для углеводородов.
-
В конце названия допишите суффикс -аль.
Физические свойства: формальдегид - газ с удушливым запахом, растворим в воде (с молекулами воды водородные связи образуются, 40 %-ный водный раствор называется формалином с увеличением температуры растворимость уменьшается); ацетальдегид - бесцветная легкокипящая жидкость с фруктовым запахом, растворим в воде; ацетон - бесцветная жидкость с резким запахом, растворим в воде.
В ряду алканы  альдегиды (кетоны)
альдегиды (кетоны)  спирты растворимость в воде и температура кипения увеличивается.
спирты растворимость в воде и температура кипения увеличивается.
Химические свойства
Химические свойства альдегидов и кетонов в значительной степени обусловлены наличием в их молекулах сильно полярной карбонильной группы (связь  поляризована в сторону атома кислорода). Чем больше частичный заряд (
поляризована в сторону атома кислорода). Чем больше частичный заряд ( +) на атоме углерода этой группы, тем выше активность соединения.
+) на атоме углерода этой группы, тем выше активность соединения.
-
Горение:
2CH3CHO + 5O2  4CO2 + 4H2O
4CO2 + 4H2O
2CH3COCH3 + 9O2  6CO2 + 6H2O
6CO2 + 6H2O
-
Гидрирование (восстановление водородом):
HCHO + H2  CH3OH
CH3OH
CH3—CO—CH3 + H2  CH3—CH(OH)—CH3
CH3—CH(OH)—CH3
-
Окисление:
CH3CHO + Ag2O  2Ag
2Ag + CH3COOH
+ CH3COOH
(реакция "серебряного зеркала" - качественная реакция)
HCHO + 2Cu(OH)2  2H2O + Cu2O
2H2O + Cu2O + HCOOH
+ HCOOH
(образуется красный осадок - качественная реакция)
-
Реакции полимеризации и поликонденсации:

Получение альдегидов
-
Окисление спиртов.
CH3OH + CuO  HCHO + Cu + H2O
HCHO + Cu + H2O
-
Дегидрирование спиртов.
CH3CH2OH  CH3CHO + H2
CH3CHO + H2
-
Окисление метана: CH4 + O2  HCHO + H2O (При 500oС в присутствии оксидов азота)
HCHO + H2O (При 500oС в присутствии оксидов азота)
-
Гидратация ацетилена (реакция Кучерова; лабораторный способ):
C2H2 + H2O  CH3CHO
CH3CHO
-
Окисление этилена: 2C2H4 + O2  2CH3CHO
2CH3CHO
Применение альдегидов и кетонов

В таблице представлены основные направления органических синтезов на основе формальдегида: получение полимерных материалов (карбамидные и фенолформальдегидные смолы); образование продуктов конденсации формальдегида (триоксан, параформ); синтез взрывчатых веществ (гексоген), лекарственных препаратов (уротропин), первичных спиртов.
Большое количество формальдегида используется в органическом синтезе для производства лекарственных веществ, красителей.
Широко применяется 40%-ный водный раствор формальдегида — формалин. Его использование связано со способностью свертывать белок. Так, например, в кожевенном производстве в результате дубильного действия формалина кожа твердеет и не подвергается гниению. На том же свойстве основано применение формалина для хранения биологических препаратов. Формалин используется для дезинфекции и протравливания семян.
Карбоновые кислоты. Сложные эфиры. Жиры
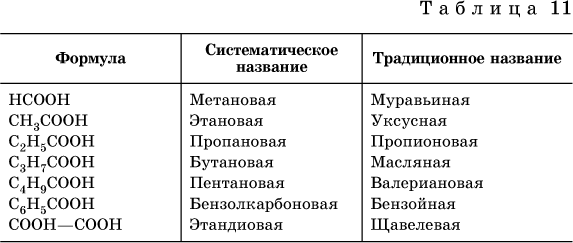
Карбоновые кислоты – это производные углеводородов, содержащие функциональную группу СООН (карбоксил).
Формулы и названия некоторых распространенных карбоновых кислот приведены в таблице ниже
Традиционные названия кислот
НСООН(муравьиная),
СН3СООН (уксусная),
С6Н5СООН (бензойная)
(СООН)2(щавелевая)
рекомендуется использовать вместо их систематических названий.
Формулы и названия кислотных остатков приведены в табл. 12.
Для составления названий солей этих карбоновых кислот (а также их сложных эфиров, см. ниже) обычно используются традиционные названия, например:


Низшие карбоновые кислоты – бесцветные жидкости с резким запахом. При увеличении молярной массы температура кипения возрастает.
Карбоновые кислоты обнаружены в природе:

Простейшие карбоновые кислоты растворимы в воде, обратимо диссоциируют в водном растворе с образованием катионов водорода:
 и проявляют общие свойства кислот:
и проявляют общие свойства кислот:

Важное практическое значение имеет взаимодействие карбоновых кислот со спиртами (подробнее см. ниже):

Отметим, что кислота НСООН вступает в реакцию «серебряного зеркала» как альдегиды:

и разлагается под действием водоотнимающих реактивов:

Получение:
• окисление альдегидов:

• окисление углеводородов:
а)
б)
Кроме того, муравьиную кислоту получают по схеме:

а уксусную кислоту – по реакции:

Применяют муравьиную кислоту как протраву при крашении шерсти, консервант фруктовых соков, отбеливатель, дезинфекционный препарат. Уксусную кислоту используют как сырье в промышленном синтезе красителей, медикаментов, ацетатного волокна, негорючей кинопленки, органического стекла. Натриевые и калиевые соли высших карбоновых кислот – основные компоненты мыла.
Сложные эфиры – продукты обменного взаимодействия карбоновых кислот со спиртами. Это взаимодействие называется реакцией этерификации:

Механизм реакции этерификации был установлен при использовании спирта, меченного изотопом 18O; этот кислород после реакции оказался в составе эфира (а не воды):

Следовательно, в отличие от реакции нейтрализации неорганической кислоты щелочью (Н+ + ОН- = Н2O), в реакции этерификации карбоновая кислота всегда отдает группу ОН, спирт – атом Н (образуется вода). Реакция этерификации обратима; она лучше протекает в кислотной среде, обратная реакция (гидролиз, омыление) – в щелочной среде.
Формулы и названия распространенных сложных эфиров приведены в табл. 13.
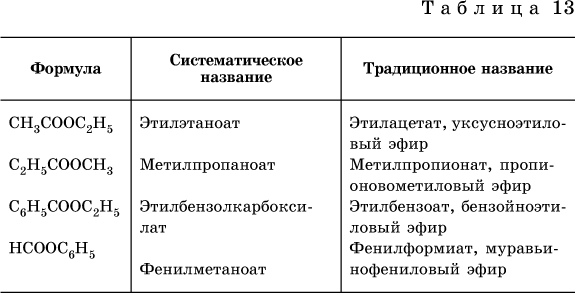
Среди сложных эфиров есть бесцветные низкокипящие горючие жидкости с фруктовым запахом, например:

Используются сложные эфиры как растворители для лаков, красок и нитратов целлюлозы, носители фруктовых ароматов в пищевой промышленности.
Сложные эфиры трехатомного спирта – глицерина и высших карбоновых кислот (в общем виде RCOOH), например с формулами и названиями:

носят названия жиров. Примером жира будет смешанный сложный эфир глицерина и этих кислот:

Чем выше содержание остатков олеиновой кислоты (или других ненасыщенных кислот), тем ниже температура плавления жира. Жидкие при комнатной температуре жиры называются маслами. Путем гидрогенизации, т. е. присоединения водорода по двойной связи, масла превращают в твердые жиры (например, растительное масло – в маргарин). Реакция этерификации (образования жира) обратима:

Прямая реакция лучше идет в кислотной среде, обратная реакция – гидролиз, или омыление, жира – в щелочной среде; при пищеварении жир омыляется (расщепляется) с помощью ферментов.
Углеводы
Углеводы (сахара) – важнейшие природные соединения, состоящие из углерода, водорода и кислорода. Углеводы подразделяются на моносахариды, дисахариды и полисахариды. Моносахариды не подвергаются гидролизу, а остальные углеводы при кипячении в присутствии кислот расщепляются до моносахаридов.
Моносахариды (и все другие углеводы) относятся к полифункциональным соединениям. В молекуле моносахарида имеются функциональные группы разных типов: группы ОН (спиртовая функция) и группы СО (альдегидная или кетонная функция). Поэтому различают альдозы (альдегидоспирты, спиртоальдегиды) и кетозы (кетоноспирты, спиртокетоны).
Важнейший представитель альдоз — глюкоза:

а представитель кетоз — фруктоза:

Глюкоза (виноградный сахар) и фруктоза (фруктовый сахар) являются структурными изомерами, их молекулярная формула С6Н12O6.
Глюкозу можно отличить от фруктозы так же, как любой альдегид от кетона, – по реакции «серебряного зеркала» в аммиачном растворе Ag2O:

Этерификация глюкозы и фруктозы (например, уксусной кислотой) приводит к образованию сложных эфиров по всем пяти группам ОН (заменяются на ОСОСН3).
Однако не все реакции, характерные для альдегидов, протекают с глюкозой; например, не идет реакция присоединения с участием гидросульфита натрия. Причина в том, что молекула глюкозы может существовать в трех изомерных формах, из которых две формы–циклические. В растворе все три формы находятся в состоянии равновесия, причем открытая (альдегидная) форма, приведенная выше, содержится в наименьшем количестве:

Циклические формы глюкозы не содержат альдегидной группы. Они отличаются друг от друга только пространственным расположением атома Н и группы ОН у атома углерода C1 (рядом с кислородом в цикле):

Дисахариды образуются из двух молекул моносахаридов путем межмолекулярной дегидратации. Так, сахароза (обычный сахар) C12Н22О11 является продуктом соединения остатков глюкозы и фруктозы за счет отщепления воды:

При гидролизе в кислотной среде сахароза вновь переходит в моносахариды:

Получившаяся смесь — инвертный сахар – содержится в мёде. При 200 °C сахароза, теряя воду, превращается в бурую массу (карамель).
Полисахариды – крахмал и целлюлоза (клетчатка) – продукты поликонденсации (межмолекулярной дегидратации) соответственно ?– и ?-форм глюкозы, их общая формула (С6Н10О5)n. Степень полимеризации крахмала составляет 1000–6000, а целлюлозы 10 000—14 000. Целлюлоза – наиболее распространенное в природе органическое вещество (в древесине массовая доля целлюлозы доходит до 75 %). Крахмал (легче) и целлюлоза (труднее) подвергаются гидролизу (условия: H2SO4 или НCl, 100 °C); конечный продукт – глюкоза.
Большое практическое значение имеют сложные эфиры целлюлозы с уксусной кислотой:

Их используют в производстве искусственного ацетатного волокна и кинофотопленок.
























































