Лекция
Тема 1.1. Химическая организация клетки.
Тема 1.1.3. Органические вещества. Белки. Ферменты.
Знания, умения и навыки, которыми должны обладать обучающиеся:
З1. - основные положения биологических теорий и закономерностей: клеточной теории строение и функционирование биологических объектов;
З2. - строение и функционирование биологических объектов;
З3 - вклад выдающихся (в том числе отечественных) учёных в развитие биологической науки;
У1. - объяснять роль биологии в формировании научного мировоззрения; вклад биологических теорий в формирование современной естественно-научной картины мира; единство живой и неживой природы, родство живых организмов;
У2. - сравнивать биологические объекты: химический состав тел живой и неживой природы, зародышей человека и других животных, природные экосистемы и агроэкосистемы своей местности;
У3. - находить информацию о биологических объектах в различных источниках (учебниках, справочниках, научно-популярных изданиях, компьютерных базах, ресурсах сети Интернет) и критически её оценивать.
СОДЕРЖАНИЕ ЗАНЯТИЯ:
Изучение нового материала
Вопросы (план):
Белки, особенности строения молекул белка.
Пространственная организация белковых молекул.
Свойства и функции белков.
Ферменты.
Белки, особенности строения молекул белка.
Белки, или протеины (от греч. protos – первичный, первостепенный; термин введен в 1838 г.), занимают первое место среди всех органических веществ клетки по количеству и по своему значению в ее жизнедеятельности. На их долю приходится от 10 до 20 % сырой массы клетки. Они присутствуют во всех типах клеток и тканей. В организме человека обнаружено более 5 млн. типов белковых молекул, отличающихся по своему строению друг от друга и от белковых молекул других организмов.
Белковая молекула состоит из углерода (50–59 %), кислорода (21–24 %), водорода (6,5–7,3 %), азота (15–18 %), серы (до 2,5 %). Кроме того, в её состав могут входить железо, фосфор, магний, цинк, медь и некоторые другие элементы.
В 1871 году русский химик Н. Н. Любавин (1845–1918) установил, что белки состоят из аминокислот, т.е. именно аминокислоты являются мономерами сложных белковых молекул. Т.о., белки – это высокомолекулярные азотсодержащие вещества, состоящие из α-аминокислот L-ряда, связанных между собой пептидными связями (рис.3).
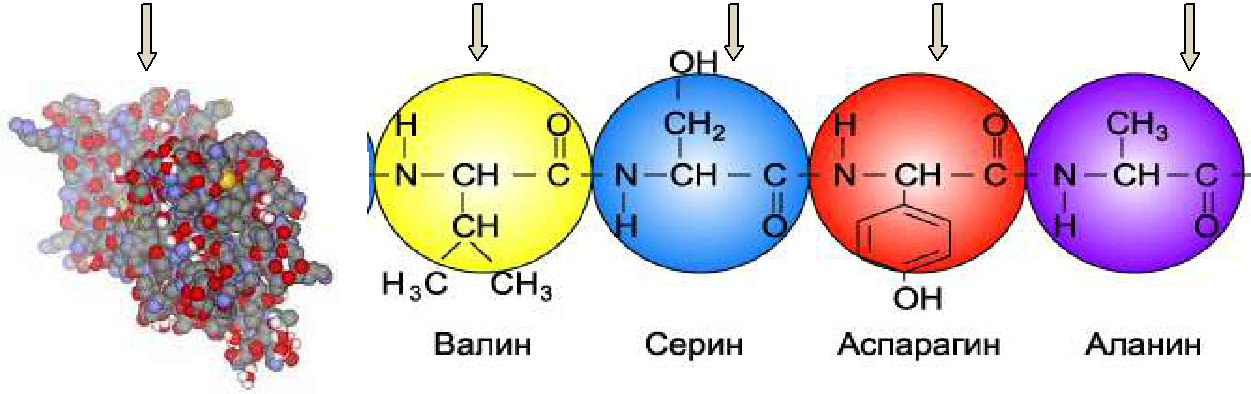
Рис 3.
В зависимости от аминокислотного состава, белки бывают: полноценными – содержат весь набор аминокислот; неполноценными – какие-то аминокислоты в их составе отсутствуют. Если белки состоят только из аминокислот, их называют простыми или протеинами. Если белки содержат помимо аминокислот еще и неаминокислотный компонент (простетическую группу), их называют сложными или протеидами. Простетическая группа может быть представлена металлами (металлопротеиды), углеводами (гликопротеиды или гликопротеины), липидами (липопротеиды), нуклеиновыми кислотами (нуклеопротеиды).
Известно более 170 аминокислот, но только 20 из них входят в состав белков. Их называют протеиногенными. Растения синтезируют все аминокислоты из более простых веществ. Животные синтезируют не все аминокислоты. Некоторые из них должны поступать с пищей, это так называемые незаменимые аминокислоты. То есть, для человека по биологическому значению аминокислоты подразделяются на:
заменимые аминокислоты – синтезируются в организме человека в достаточном количестве (глицин, аланин, серин, цистеин, тирозин, аспарагиновая кислота, глутаминовая кислота, аспарагин, глутамин);
полузаменимые аминокислоты – образуются в организме, но в недостаточном количестве, поэтому их недостаток должен восполняться белковой пищей (тирозин, аргинин, гистидин);
незаменимые аминокислоты – в организме человека не синтезируются, поэтому они должны поступать с пищей (валин, лейцин, изолейцин, треонин, лизин, метионин, фенилаланин, триптофан).
Аминокислотный состав белков определяется не доступностью или незаменимостью той или иной аминокислоты, а назначением белка, его биологической функцией. В настоящее время определен аминокислотный состав многих сотен белков.
Строение аминокислоты. Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (–NH2) с основными свойствами, другая – карбоксильной группой (–COOH) с кислотными свойствами. Часть молекулы, называемая радикалом (R–), у разных аминокислот имеет различное строение.
Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований.
В водных растворах аминокислоты существуют в разных ионных формах. Каждая аминокислота имеет свое название, особое строение и свойства.
В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы.
Пептидная связь. Наличие в одной молекуле аминокислоты основной и кислотной групп обусловливает их высокую реакционную способность. Через эти группы происходит соединение аминокислот при образовании белка, т.е. при взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой в ходе реакции выделяется молекула воды, а освободившиеся электроны образуют ковалентную азот-углеродную связь, которая получила название пептидной – образуется пептид.
Образование пептидной связи может повторяться многократно, так как на одном конце пептида всегда находится свободная аминогруппа (его называют N-концом), а на другом – свободная карбоксильная группа (его называют С-концом). К этим свободным группам могут присоединяться другие аминокислоты, удлиняя «цепь».
В зависимости от количества аминокислот, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т. д.
Образование пептидной связи, повторяющееся многократно, приводит к образованию полипептидов. Полипептидные цепи белков бывают очень длинными и включают самые различные комбинации аминокислот.
В состав белка может входить не одна, а две полипептидные цепи и более. Так, в молекуле инсулина – две цепи, а иммуноглобулины состоят из четырех цепей.
Пространственная организация белковых молекул
Выполнение белками определенных специфических функций зависит от их конформации – пространственной конфигурации молекулы белка.
Клетке энергетически невыгодно держать белки в развернутой форме – в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию.
Выделяют 4 уровня пространственной организации белков.
Первичная структура белка – линейная цепь аминокислот, расположенных в определенной последовательности и соединенных между собой пептидными связями (рис 4).

Рис. 4
Каждый индивидуальный белок имеет уникальную первичную структуру. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию – транспорт кислорода; в таких случаях у человека развивается заболевание – серповидноклеточная анемия.
Вторичная структура – упорядоченно уложенная полипептидная цепь в α-спираль (α-структура – имеет вид растянутой пружины) или β-складчатый слой (β-структура – имеет вид листа, сложенного в гармошку) (рис. 5).

Рис.5
Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО– и NН– группы принимают участие в образовании водородных связей.
Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и прочность.
На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).
Третичная структура – многократно свернутая полипептидная цепь в виде α-спирали или β-складчатого слоя в трехмерное образование – глобулу (имеет вид клубка). Формируется в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислот. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.
Четвертичная структура – сложный комплекс нескольких (двух, трех и более) молекул белка, обладающих третичной структурной организацией. Характерна для всех белков. Такой комплекс также не рассматривается как белок, состоящий из нескольких субъединиц. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи.
Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Его молекула состоит из четырех связанных между собой молекул. Другим примером может служить гормон поджелудочной железы – инсулин, включающий две субъединицы. В состав четвертичной структуры некоторых белков включаются помимо белковых субъединиц и разнообразные небелковые компоненты. Тот же гемоглобин содержит сложное гетероциклическое соединение, в состав которого входит железо. Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функции. Например, причиной «коровьего бешенства» (губкообразной энцефалопатии) является аномальная конформация прионов – поверхностных белков нервных клеток.
Свойства и функции белков
Свойства белков. Белки, как и другие неорганические и органические соединения, обладают рядом физико-химических свойств, вытекающих из их структурной организации. Это во многом обусловливает функциональную активность каждой молекулы.
Амфотерность. Белки сочетают в себе основные и кислотные свойства, определяемые радикалами аминокислот: чем больше кислых аминокислот в белке, тем ярче выражены его кислотные свойства и наоборот.
Буферность. Способность отдавать и присоединять Н+ определяют буферные свойства белков. В кислой среде белки проявляют слабощелочные свойства и нейтрализуют кислоты. В щелочной среде они реагируют как слабые кислоты. Один из самых мощных буферов – гемоглобин в эритроцитах, поддерживающий рН крови на постоянном уровне.
Растворимость в воде. Есть белки растворимые (глобулярные белки, например, фибриноген) и нерастворимые, выполняющие механические функции (фибриллярные белки: фиброин, кератин, коллаген). Белки – преимущественно водорастворимые молекулы и, следовательно, могут проявлять свою функциональную активность только в водных растворах.
Химическая активность. Есть белки в химическом отношении активные (ферменты) и химически неактивные.
Термолабильность. Белки термолабильны, т.е. проявляют свою активность в узких температурных рамках.
Устойчивость. Белки делят на устойчивые к воздействию различных условий внешней среды и крайне неустойчивые. Внешние факторы (действие повышенной температуры, ультрафиолетовое излучение, тяжелые металлы и их соли, изменение рН, радиация, обезвоживание и др.) могут вызывать разрушение структурной организации белков.
Утрата белковой молекулой своей структурной организации называется денатурацией. Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные. Поэтому вначале разрушается самая слабая структура – четвертичная, затем третичная, вторичная и при более жестких условиях – первичная. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций.
Если изменение условий среды не приводит к разрушению первичной структуры молекулы, то при восстановлении нормальных условий среды полностью воссоздается структура белка и его функциональная активность. Например, такому процессу подвергаются рецепторные белки мембраны.
Процесс восстановления структуры белка после денатурации называется ренатурацией. Это свойство белков полностью восстанавливать утраченную структуру широко используется в медицинской и пищевой промышленности для приготовления некоторых медицинских препаратов, например, антибиотиков, вакцин, сывороток, ферментов; для получения пищевых концентратов, сохраняющих длительное время в высушенном виде свои питательные свойства.
Биологические свойства белков – это функции белков в организме.
Функции белков
Структурная (строительная): белки входят в состав биологических мембран, мембранных и немембранных органелл клетки, обладают способностью образовывать волокна. Например основу кожи, хрящей и сухожилий составляет фибриллярный белок коллаген, связок – эластин. Химический состав волос, ногтей (когтей) и перьев млекопитающих и птиц определяется в основном кератином. Шелковые нити и паутина построены из белка фиброина.
Двигательная или сократительная: на молекулярном уровне белки обеспечивают движение хромосом и сперматозоидов, на других уровнях – движение простейших, двигательные реакции у растений и клеток, сокращение скелетных мышц у многоклеточных животных (тубулин микротрубочек, мышечные белки актин и миозин). В механическом процессе сокращения затрачивается химическая энергия.
Энергетическая: белки не запасаются, как источник энергии, но в экстремальных условиях могут распадаться с высвобождением энергии. Теряя аминогруппы (дезаминируясь), белки становятся источником энергии в то время, когда в клетках наступает истощение углеводных и липидных ресурсов.
Каталитическая: все биохимические реакции в клетке катализируются белками особой группы – ферментами (энзимами). Каждая реакция обеспечивается собственным ферментом, вследствие чего ускоряется, как минимум, в 1 млн. раз. Например, липаза расщепляет жиры, амилаза – крахмал. Ферменты локализуются в митохондриях, цитоплазме, лизосомах и на мембранах клеток и органелл.
Гормональная: среди гормонов есть вещества белковой природы, регулирующие обмен веществ внутри клеток и интегрирующие обмен в различных клетках организма в целом. Например, инсулин – гормон, вырабатываемый поджелудочной железой, регулирует в организме метаболизм глюкозы, паратиреоидный гормон – регулирует транспорт ионов кальция и фосфатов.
Регуляторная: существует огромная группа белков-регуляторов, контролирующих все процессы в клетке и организме. Белки-ингибиторы ферментов составляют многочисленную группу эндогенных ингибиторов. Они осуществляют регуляцию активности ферментов.
Транспортная: существуют специальные белки-переносчики, которые, связываясь со специфическими веществами (гормонами, аминокислотами, липидами, моносахаридами, кислородом и др.), обеспечивают их транспорт между тканями и через мембраны клетки.
Запасная пищевая: некоторые белки используются зародышами (в начальный период их развития) в качестве пищевых. Пищевыми белками являются альбумин (главный белок яиц птиц) и казеин (главный молочный белок).
Защитная: иммунные антитела (иммуноглобулины) по своей химической природе также белки. Они вырабатываются лимфоцитами и, взаимодействуя с антигенами, дезактивируют чужеродные соединения, вирусы, бактерии и т.д. Фибриноген и тромбин участвуют в свертывании крови, предохраняя организм от её потери.
Сигнальная: мембранные белки воспринимают внешние воздействия и передают о них сигнал внутрь клеток.
Токсическая: многие токсины бактерий (дифтерийный токсин), растений (рицин) и животных (яд змей) являются веществами белковой природы.
Таким образом, оценивая роль белков в жизнедеятельности клеток, тканей и всего организма в целом, следует также отметить, что они обладают видовой специфичностью, а это ведет к одному основополагающему заключению, сводящемуся к признанию положения «организмы делаются белками».
Ферменты
Ферменты, или энзимы, – особый класс белков, являющихся биологическими катализаторами. Благодаря ферментам биохимические реакции протекают с огромной скоростью. Скорость ферментативных реакций в десятки тысяч раз (а иногда и в миллионы) выше скорости реакций, идущих с участием неорганических катализаторов. Вещество, на которое оказывает свое действие фермент, называют субстратом.
Ферменты – глобулярные белки, по особенностям строения ферменты можно разделить на две группы: простые и сложные.
Простые ферменты являются простыми белками, т.е. состоят только из аминокислот.
Сложные ферменты являются сложными белками, т.е. в их состав помимо белковой части входит группа небелковой природы – кофактор.
У некоторых ферментов в качестве кофакторов выступают витамины.
В молекуле фермента выделяют особую часть, называемую активным центром. Активный центр – небольшой участок фермента (от трех до двенадцати аминокислотных остатков), где и происходит связывание субстрата или субстратов с образованием фермент - субстратного комплекса. По завершении реакции фермент-субстратный комплекс распадается на фермент и продукт (продукты) реакции.
Некоторые ферменты имеют (кроме активного) аллостерические центры – участки, к которым присоединяются регуляторы скорости работы фермента (аллостерические ферменты).
Для реакций ферментативного катализа характерны:
1. высокая эффективность;
2. строгая избирательность и направленность действия;
3. субстратная специфичность;
4. тонкая и точная регуляция.
Субстратную и реакционную специфичность реакций ферментативного катализа объясняют гипотезы Э. Фишера (1890 г.) и Д. Кошланда (1959 г.). Э. Фишер (гипотеза «ключ- замок») предположил, что пространственные конфигурации активного центра фермента и субстрата должны точно соответствовать друг другу. Субстрат сравнивается с «ключом», фермент – с «замком».
Д. Кошланд (гипотеза «рука-перчатка») предположил, что пространственное соответствие структуры субстрата и активного центра фермента создается лишь в момент их взаимодействия друг с другом. Эту гипотезу еще называют гипотезой индуцированного соответствия. Скорость ферментативных реакций зависит от: температуры, концентрации фермента, концентрации субстрата, рН. Следует подчеркнуть, что поскольку ферменты являются белками, то их активность наиболее высока при физиологически нормальных условиях.
Большинство ферментов может работать только при температуре от 0 до 40 °С. В этих пределах скорость реакции повышается примерно в 2 раза при повышении температуры на каждые 10 °С. При температуре выше 40 °С белок подвергается денатурации и активность фермента падает. При температуре, близкой к точке замерзания, ферменты инактивируются, т.е. частично или полностью теряют свою активность.
При увеличении количества субстрата скорость ферментативной реакции растет до тех пор, пока количество молекул субстрата не станет равным количеству молекул фермента. При дальнейшем увеличении количества субстрата скорость увеличиваться не будет, так как происходит насыщение активных центров фермента. Увеличение концентрации фермента приводит к усилению каталитической активности, так как в единицу времени преобразованиям подвергается большее количество молекул субстрата.
Для каждого фермента существует оптимальное значение рН, при котором он проявляет максимальную активность (пепсин – 2,0; амилаза слюны – 6,8; липаза поджелудочной железы – 9,0). При более высоких или низких значениях рН активность фермента снижается. При резких сдвигах рН фермент денатурирует. Скорость работы аллостерических ферментов регулируется веществами, присоединяющимися к аллостерическим центрам. Если эти вещества ускоряют реакцию, они называются активаторами, если тормозят – ингибиторами.
Вопросы для закрепления изученного материала:
Сформулируйте основные положения клеточной теории. Перечислите основные этапы истории развития биологии клетки.
Какие аминокислоты называются незаменимыми и сколько их?
Чем представлена первичная структура белков?
Чем представлена вторичная структура белка?
Сколько энергии выделяется при расщеплении 1 г белков, углеводов, липидов?
Охарактеризуйте структуру и функции белков в клетке и организме.
Информационное обеспечение обучения:
Общая биология: Учебн. для 10–11 кл. общеобразоват. учреждений / Д.К. Беляев, П.М. Бородин, Н.Н. Воронцов и др.; Под ред. Д.К. Беляева, Г.М. Дымшица. – М.: Просвещение, 2020. – 303 с.: ил.
Сухорукова, Л. Н. Биология. 10-11 классы. Базовый уровень. Учебник / Л.Н. Сухорукова, Т.В. Иванова. - М.: Просвещение, 2020. - 128 c.
Константинов, В. М. Общая биология: учебник для студентов образовательных учреждений среднего профессионального образования / В. М. Константинов, А. Г. Резанов, Е. О. Фадеева. – М.: Издательский центр «Академия», 2007. – 256 с.
Дополнительная, интернет - ресурсы
1. www. sbio. info
2. www. window. edu. ru
3. www.5ballov. ru/test
4. www. vspu. ac. ru/deold/bio/bio. htm
5. www. biology. ru