|
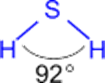
| - Mr (H2S)= _____ г/моль - _________________ газ со сладковатым вкусом, - с запахом _________________, - _______________, - _________________ в воде, (в 1V H2O растворяется 3V H2S при н.у.); - __________________ кислота, - t°кип. = -60°С.
| При вдыхании этого газа в ___________________________________ быстро наступает паралич дыхательных нервов - смертельная опасность сероводорода. При вдыхании этого газа в
__________________________________ головокружение, головная боль, тошнота. При вдыхании этого газа в __________________________________ используют в медицине. | -
Содержится в попутных газах нефтяных месторождений; -
В вулканических газах; -
В минеральных источниках; -
Образуется при разложении белковых веществ. | 1. Образуется в качестве побочного продукта при переработке: - нефти, - природного газа, - каменного угля. 2. H2 + S → ______↑ (при t) 3. FeS +2HCl → ______+ ______↑ 4. FeS +H2SO4 _____↑ +______
|
| 1) Диссоциация: ____________________________
2) Взаимодействует с основаниями: а)________________________________________
б)_____________________________________________
3) H2S взаимодействует с гологенами (с раствором бромной воды): _______________________________________ (Бром растворен в воде – это бромная вода) 4) Сероводород окисляется: при недостатке O2 при избытке O2 | -
В химическом синтезе: получение серной кислоты и сульфидов -
В медицине: для лечения заболеваний кожи, опорно-двигательного аппарата, сердечно-сосудистой системы. -
В аналитической химии для осаждения металлов. |
| С ульфиды — природные сернистые соединения металлов и некоторых неметаллов. ульфиды — природные сернистые соединения металлов и некоторых неметаллов. В химическом отношении рассматриваются как соли сероводородной кислоты H2S. | - Из сульфидов получают медь, серебро, цинк, свинец, молибден, висмут, кобальт, никель, а также ртуть, кадмий, рений и другие редкие элементы извлекаются из таких руд. - Некоторые сульфиды используются в производстве красок и в химической промышленности для производства серной кислоты. - Сульфиды CaS, SrS, ZnS, CdS обладают оптическим свойством – эти вещества __________________________.
|






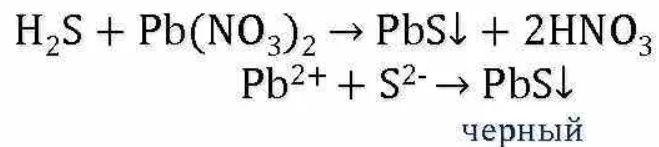
 ульфиды — природные сернистые соединения металлов и некоторых неметаллов.
ульфиды — природные сернистые соединения металлов и некоторых неметаллов. 

















