МБОУ «Чинарская СОШ№1»

Тема: Кремний и его соединения.
| Цели урока: 1. Повторить и закрепить материал, пройденный на предыдущем уроке. 2. Сформировать знания о кремнии, его соединениях, их свойствах, биологическом значении, получении, применении. 3. Познакомить учащихся со способами получения и применения кремния. |
Средства обучения: периодическая система химических элементов Д. И. Менделеева, схемы, коллекции, «Природные силикаты», «Стекло и изделия из стекла», дополнительная литература, лабораторное оборудование, презентация к уроку, химические реактивы: раствор соляной кислоты, раствор карбоната натрия, раствор силикатного клея; штативы с пробирками; образцы природных соединений кремния ( гранит, горный хрусталь, кварц и др.), образцы изделий из стекла, фаянса, фарфора, керамики.
Ход урока:
1.Организационный момент.
-Здравствуйте, ребята! Садитесь. Сегодня у нас открытый урок и у нас на уроке присутствуют гости. Давайте мы им улыбнемся и пожелаем доброго дня. На уроке мы с вами повторим пройденный материал, познакомимся с темой «Кремний и его соединения», решим задачи, проведем опыты.
2. Повторение пройденной темы.
-На предыдущих уроках мы с вами познакомились с углеродом и с его соединениями. Давайте, мы с вами повторим. Для этого выполним задания ГИА.
Задание № 1. (А)
Число электронов во внешнем электронном слое атома с зарядом ядра +6 равно:
1) 6 2) 3 3) 4 4) 2
Задание № 2
Кислотным оксидом является:
1) CO2 2)Al2 O3 3) Na 2O 4) NO
Задание № 3
Оксид углерода (IV) взаимодействует с
1) NaCl 2) P2 O5 3) Ca(OH)2 4) HNO3
Задание № 4 (В 1)
В ряду химических элементов Ge – Si – C
-
увеличиваются радиусы атомов
-
увеличивается электроотрицательность
-
усиливаются кислотные свойства их высших оксидов
-
возрастает значение высшей степени окисления
-
увеличивается число электронов во внешнем электронном слое атомов
Задание № 5 (С2)
К избытку карбоната кальция добавили 146 г раствора с массовой долей соляной кислоты 5 %. Вычислите объем (н.у.) выделившегося газа.
Ответ: 2,24 л.
Молодцы, ребята!
3.Новая тема.
- Сегодня мы познакомимся с ещё одним неметаллом, значимость которого очень велика, т.к. по распространенности на Земле он второй после кислорода, - это кремний.
Дадим характеристику этому химическому элементу: (Слайд) (сообщение одного из обучающихся, работа с периодической системой)
1.Строение.
Кремний – элемент IV группы и 3-го периода, порядковый номер 14, А=28, 14 протонов и 14 нейтронов, 14 электронов. Строение его электронной оболочки следующая: 14 Si 2e 8e 4e
2. Нахождение в природе.
(материал по этому вопросу может быть подготовлен и освещён обучающимися)
- Земная кора на одну четверть состоит из соединений кремния. Наиболее распространённым является оксид кремния (IV) – кремнезём. В природе он образует минерал кварц и многие другие разновидности: горный хрусталь, аметист, агат, опал, яшма, халцедон, сердолик (полудрагоценные камни), а также обычный кварцевый песок .
Именно кремень положил начало каменному веку. Причин этому две: доступность и распространённость, а также способность образовывать на сколе острые режущие края.
Второй тип природных соединений кремния – силикаты. Самые распространённые алюмосиликаты: гранит, различные виды глин, слюды (слайд 7)
Не содержащий алюминия силикат – асбест ( из него изготавливают огнестойкие ткани)
Оксид кремния (IV) необходим и растениям, и животным. Он придаёт прочность стеблям растений и покровам животных ( камыши твёрдо стоят, осока режет, как лезвие, чешуя рыб, панцири насекомых, крылья бабочек, перья птиц, шерсть животных содержат оксид кремния (IV). ( слайд 8)
Кремний придаёт гладкость и прочность костям человека, входит в состав низших живых организмов – диатомовых водорослей и радиолярий (образует их скелеты) ( слайд 9)
3. Открытие кремния.
(материал по этому вопросу может быть подготовлен и освещён обучающимися)
- Уже в глубокой древности люди широко использовали в своём быту соединения кремния. Вспомните древних людей. Из чего были изготовлены их орудия труда? Но сам кремний впервые был получен в 1824 г. Шведским химиком И.Я. Берцелиусом. Однако, за 12 лет до него кремний получили Ж. Гей-Люссак и Л. Тенар, но он был очень загрязнён примесями.
Латинское название «силициум» берёт своё начало от латинского «силекс» - камень. С греческого языка «кремнос» - утёс, скала.
4. Физические свойства (слайд 12)
(материал по этому вопросу может быть подготовлен и освещён учащимися)
- Вы обратили внимание, что когда мы говорим о содержании в природных условиях элемента кремния, то упоминаем только его соединения, но не простое вещество.
Кремний в свободном виде в природе не встречается в отличие от углерода (алмаз, графит, аморфный С и т.д.)
кремний – неметалл, существует в кристаллическом и аморфном виде.
Кристаллический кремний – серовато-стального цвета с металлическим блеском, твёрдый (7 баллов по шкале Мооса), но хрупкий, малореакционноспособный; полупроводник, (с повышением температуры электропроводность повышается), и с нарушением правильности структуры.
Такие свойства обусловлены строением кристаллов, аналогичным структуре алмаза.
Физические константы: g = 2,33 г/см3; t пл.= 1415 0С; t кип.= 3500 0С
Аморфный кремний представляет собой белый порошок.
5. Получение кремния (слайд 13)
- Способы получения кремния основаны в основном на восстановлении оксида кремния (IV) сильными восстановителями – активными металлами (Mg, Al) и углеродом.
Лабораторный способ: SiO2 + 2Mg = 2MgO + Si
Промышленный способ:
1900oC
S iO2 + 2C 2CO + Si
iO2 + 2C 2CO + Si
SiCi4 + 2Zn = 2ZnCi2 + Si
6. Химические свойства (слайд 14)
а) кремний - восстановитель
Все реакции протекают при нагревании!
-
Si + O2 = SiO2 (оксид кремния (IV))
S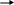 i0 – 4e- Si+4 восстановитель
i0 – 4e- Si+4 восстановитель
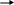 O2 + 4e- 2O-2 окислитель
O2 + 4e- 2O-2 окислитель
-
Si + 2Cl2 = SiCl4 (хлорид кремния)
-
Si + 2S = SiS2 (сульфид кремния)
20000C
-
S
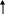 i + C Si+4C-4 (карбид кремния или карборунд, по твёрдости близок к алмазу)
i + C Si+4C-4 (карбид кремния или карборунд, по твёрдости близок к алмазу)
-
S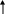 i + 2H2O(пар) = SiO2 + H2
i + 2H2O(пар) = SiO2 + H2
-
Si + 2NaOH(конц.) + H2O = Na2SiO3 + 2H2
б) кремний – окислитель
Si + 2Ca = Ca2Si (силицид кальция)
Вывод: свойства кремния и углерода похожи. Оба неметалла взаимодействуют с кислородом, галогенами, серой, металлами. Но в отличие от углерода кремний напрямую не соединяется с водородом.
7. Соединения кремния
Свойства кремнезёма (слайд15,16)
Учитель подробно рассматривает свойства оксида кремния (IV) и проводит сравнительный анализ двух оксидов – SiO2 и CO2. результаты обсуждения в виде таблицы выводятся на экран.
Обратите внимание на одно важное свойство оксида кремния:
SiO2 + 4HF = 2H2O + SiF4
Оксид кремния входит в состав стекла, поэтому плавиковую кислоту нельзя хранить в стеклянной посуде.
Вывод: физические свойства оксидов резко отличаются, т.к. они образуют разные кристаллические решётки – молекулярную (CO2) и атомную (SiO2), но химические свойства схожи. Отличие состоит в различном отношении к воде.
Силан SiH4 (слайд 17)
-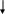
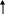 Силан получают косвенно, действуя на силициды металлов водой или кислотами:
Силан получают косвенно, действуя на силициды металлов водой или кислотами:
Mg2Si + 4H2O = 2Mg(OH)2 + SiH4
Силан – бесцветный газ, самовоспламеняющийся на воздухе и сгорающий с образованием оксида кремния и воды:
SiH4 + 2O2 = SiO2 + 2H2O
Кремниевая кислота и её соли (слайд 18)
-кремниевая кислота H2SiO3 -единственная нерастворимая неорганическая кислота, - двухосновная,
- слабая H2SiO3 H2O +SiO2
слабая H2SiO3 H2O +SiO2
При высыхании образует силикагель, используемый в качестве адсорбента.
Получить кремниевую кислоту можно только из её солей.
Проведение лабораторного опыта и составление уравнения реакции получения кремниевой кислоты (самостоятельно, на доске)
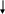
Na2SiO3 + 2HCl = 2NaCl + H2SiO3
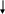
SiO32- + 2Н+ = H2SiO3
Соли кремниевой кислоты называют силикатами (слайд 19).
Их можно получить сплавлением оксида кремния с оксидами металлов или карбонатами:
S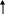 iO2 + CaO = CaSiO3
iO2 + CaO = CaSiO3
SiO2 + CaCO3 = CaSiO3 + CO2
Закрепление материала.
Лабораторная работа «Ознакомление с природными силикатами»
Цель: рассмотреть и изучить некоторые физические свойства природных разновидностей оксида кремния (IV).
Оборудование: стеклянная пластинка, «шкала твердости»
1 ряд: кварц, песок;
2 ряд: кремнезем, кремень;
3 ряд: полевой шпат, слюда
|
Инструкция 1. Рассмотрите образцы природных силикатов. 2. Отметьте их свойства: цвет, твердость и др. 3. Результаты исследований оформите в виде таблицы.
| Название силиката | Состав силикатов | Свойства (цвет, твердость) | Применение | |
|
|
|
|
|
Пара учащихся (сидящих за одной партой) в каждом ряду оформляет свою таблицу. Затем все обсуждают свои результаты и делают выводы.
IV.Домашнее задание.
§ 31 стр.178- 180, упр.4 (а) Графу «Применение» заполнить дома.
Подготовить сообщения о силикатной промышленности: «Стекло», «Цемент», «Керамика».








 iO2 + 2C 2CO + Si
iO2 + 2C 2CO + Si 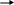 i0 – 4e- Si+4 восстановитель
i0 – 4e- Si+4 восстановитель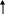 i + C Si+4C-4 (карбид кремния или карборунд, по твёрдости близок к алмазу)
i + C Si+4C-4 (карбид кремния или карборунд, по твёрдости близок к алмазу)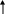 i + 2H2O(пар) = SiO2 + H2
i + 2H2O(пар) = SiO2 + H2