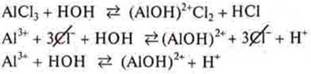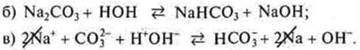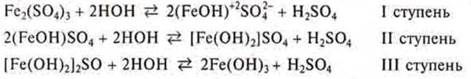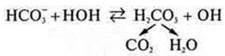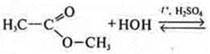ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ПРОФЕССИОНАЛЬНОЕ
ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
КАМЧАТСКОГО КРАЯ
«КАМЧАТСКИЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ»
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
ЛЕКЦИИ
По дисциплине «Химия»
По теме: «Гидролиз неорганических и органических веществ»
Для специальности: 31.02.03 Лабораторная диагностика
Уровень подготовки базовый
| Рассмотрена на заседании цикловой комиссии общепрофессиональных дисциплин Протокол № ____ «__» ___________ 2025 г. Председатель ЦМК ____________/ Г.В. Яковишин | СОГЛАСОВАНО Заместитель директора по УПР __________/Н.В. Вострикова «___» ______ 2025г. |
Составитель:
Потапова Елена Витальевна – преподаватель высшей квалификационной категории ГБПОУ КК «Камчатский медицинский колледж»
Петропавловск-Камчатский, 2025
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Методическая разработка лекции по теме «Гидролиз неорганических и органических веществ» разработана в соответствии с ФГОС СПО специальности 31.02.03 Лабораторная диагностика» и рассчитано на одно занятие (2 часа) в соответствии с календарно-тематическим планом программы учебной дисциплины.
Данная тема входит в изучение общеобразовательной дисциплины профильного уровня «Химия». Преподавание реализовано с учётом профессиональной направленности обучающихся по специальности 31.02.03 Лабораторная диагностика
Актуальность темы:
Понимание процессов, происходящих при гидролизе солей, необходимо для объяснения явлений, происходящих в живых организмах, природных комплексах и системах. Многие вопросы биологии, медицины, связаны с явлением гидролиза солей, поскольку он является основой их устойчивости и равновесия. В основе процесса пищеварения лежит реакция гидролиза, её надо учитывать при приготовлении растворов. Усвоение пищи связано с переходом питательных веществ в растворенное состояние. Поэтому будущему медицинскому работнику необходимо иметь представление о гидролизе.
Тип учебного занятия: лекция
Цели занятия:
Учебные:
- дать представление о гидролизе неорганических и органических веществ;
- научить записывать уравнение гидролиза неорганических солей в молекулярном и ионном виде;
- научить определять рН среды водного раствора солей, определять характер среды растворов солей по их составу. Показать практическое применение гидролиза.
- показать практическое применение гидролиза в природе и жизни человека;
Развивающие:
способствовать развитию клинического и логического мышления, медицинской наблюдательности;
способствовать развитию умения сравнивать и выделять различия;
развивать познавательную и поисковую активность;
Воспитательные:
повышение интереса к предмету, формирование положительного отношения к образовательному процессу, к самостоятельной работе;
содействие личностному самоопределению обучающихся в отношении их будущей профессии
Обучающийся должен обладать общими компетенциями, включающими в себя способность:
ОК 01. Выбирать способы решения задач профессиональной деятельности применительно к различным контекстам;
ОК 04. Эффективно взаимодействовать и работать в коллективе и команде;
ОК 05. Осуществлять устную и письменную коммуникацию на государственном языке Российской Федерации с учетом особенностей социального и культурного контекста;
ОК 08. Использовать средства физической культуры для сохранения и укрепления здоровья в процессе профессиональной деятельности и поддержания необходимого уровня физической подготовленности.
Занятие способствует формированию у обучающихся следующих личностных результатов:
ЛР.12 Способный искать нужные источники информации и данные, воспринимать, анализировать, запоминать и передавать информацию с использованием цифровых средств; предупреждающий собственное и чужое деструктивное поведение в сетевом пространстве.
ЛР.13 Проявляющий навыки сотрудничества со сверстниками, детьми младшего возраста, взрослыми в образовательной, общественно полезной, учебно-исследовательской, проектной деятельности.
ЛР.14 Развивающий творческие способности, способный креативно мыслить.
ЛР.21 Соблюдающий и пропагандирующий правила здорового и безопасного образа жизни, спорта; предупреждающий либо преодолевающий зависимости от алкоголя, табака, психоактивных веществ, азартных игр и т.д.
ЛР.26 Готов к выполнению поставленной задачи, направленной на помощь пациенту в любой ситуации.
Обучающийся (базовый уровень) должен обладать профессиональными компетенциями, соответствующими видам деятельности:
ПК 1.1. Организовывать рабочее место.
ПК 1.2. Обеспечивать безопасную окружающую среду.
ПК 3.2. Пропагандировать здоровый образ жизни.
После изучения данной темы обучающийся должен:
уметь:
- давать понятия гидролизу;
-составлять уравнение гидролиза;
– характеризовать: общие химические свойства солей;
–объяснять: зависимость свойств химического элемента и образованных им веществ от положения в Периодической системе Д.И. Менделеева;
– называть: изученные вещества;
– определять: принадлежность веществ к разным классам неорганических соединений; типы реакций в неорганической химии; типы и pH среды раствора.
– характеризовать: общие химические свойства основных классов неорганических соединений;
– объяснять: практическое применение и значение гидролиза в биохимических реакциях организма.
знать:
- Типы гидролиза в зависимости от кислоты и основания, которыми образованна соль.
- Классификацию кислот на сильные и слабые.
-Классификацию оснований на сильные и слабые.
- Значение гидролиза солей в живом организме, в природе, в быту.
Междисциплинарные связи:
ОДП.03 Биология
ОП.01 Анатомия и физиология человека
ПМ.01 Проведение мероприятий по профилактике инфекций, связанных с оказанием медицинской помощи.
Методы организации и осуществления учебно-познавательной деятельности:
словесный (лекция, объяснение, фронтальная беседа);
наглядный (демонстрация таблиц, мультимедийной презентации, видеофрагментов)
Место проведения лекции: учебная аудитория ГБПОУ КК «Камчатский медицинский колледж».
Материально-техническое оснащение занятия:
СТРУКТУРНО-ЛОГИЧЕСКАЯ СХЕМА ЗАНЯТИЯ
| Этапы занятия | Время | Действия преподавателя | Действия обучающихся |
| Организационный момент | 2 | Приветствует обучающихся, осуществляет контроль присутствия на занятии, готовности к занятию учебного кабинета и обучающихся, оценивает внешний вид обучающихся. | Занимают рабочие места, приветствуют преподавателя, слушают, отвечают |
| Сообщение темы, определение целей, плана проведения занятий. | 3 | Сообщает тему, задает вопросы, побуждающие к обсуждению актуальности изучаемой темы. Организует обсуждение. | Записывают тему, участвуют в обсуждении. |
| Актуализация опорных знаний | 5 | Проводит опрос | Отвечают на вопросы |
| Изучение нового материала | 30 | Объясняет новый материал | Конспектируют материал лекции, составляют схему |
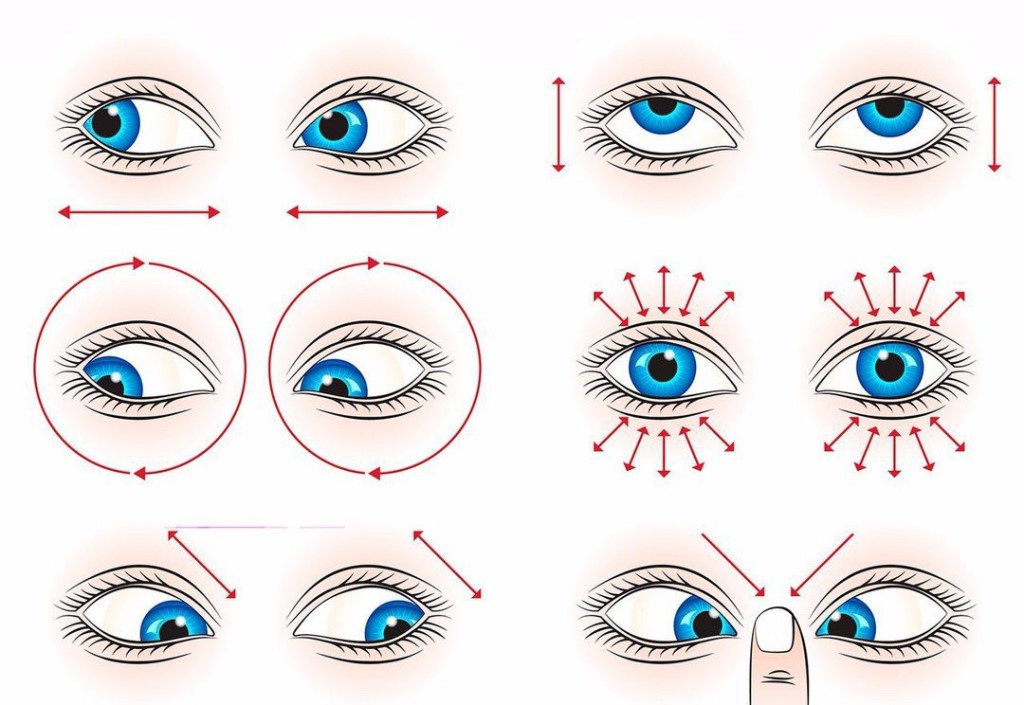
| Физкультминутка | 5 | Демонстрирует студентам технику выполнения упражнений (Приложение №А) | Выполняют упражнения |
| Просмотр видеофрагмента | 15 | Видеоурок «Гидролиз» (РЭШ, https://resh.edu.ru/subject/lesson/5912/main/ | Конспектируют, смотрят. Разбирают уравнения составления гидролиза |
| Составления уравнений гидролиза | 20 | Объясняет задание | Выполняют в тетради |
| Рефлексия | 5 | Проводит рефлексию | Отвечают на вопросы: Я не знал, но теперь знаю… |
| Сообщение задания для внеаудиторной самостоятельной работы. Выставление оценок. | 5 | Объясняет выполнение внеаудиторной самостоятельной работы: 1) Задания для закрепления знаний, умений определять характер среды и цвет индикатора 2) Учить материал лекции | Записывают задание для выполнения |
| ИТОГО: | 90 |
|
Ход занятия
Основные понятия: гидролиз, гидролиз по катиону, гидролиз по аниону, молекулярный вид уравнения гидролиза, общий ионный и краткий ионный виды уравнения, реакция среды.
Оборудование: проектная доска, компьютер.
Актуализация знаний:
Дайте определение понятию «соли» (Соли — сложные вещества, состоящие из катионов металлов и анионов кислотных остатков. ИЮПАК определяет соли как химические соединения, состоящие из катионов и анионов).
Какие Соли бывают, перечислите? (средние, основные, кислые, средние, двойные, комплексные).
Дайте определение понятию «электролит» (Электролиты — это вещества растворы или расплавы которых проводят электрический ток. NaCl, H2SO4, NaOH)
Дайте определение понятию «неэлектролит» (Неэлектролиты-это вещества, водные растворы или расплавы которых не проводят электрический ток. Кислород O2, азот N2, водород H2, многие органические вещества – спирты, глюкоза, сахароза, бензол и др.
Что такое кислота? (Кислота — это сложное соединение состоящая из катиона водорода и кислотного остатка)
Гидролиз — взаимодействие соли с водой, в результате которого идет образование слабого электролита.
Если кислота — кислая соль, если основание — основная соль, и происходит изменение среды раствора.
Гидролиз — процесс обратимый. Гидролизу подвергаются растворимые соли, в состав которых входит либо катион слабого электролита, либо анион слабого электролита.
Если катион слабого электролита — идет гидролиз по катиону.
Если анион слабого электролита — идет гидролиз по аниону.
Если катион и анион много зарядные (H2SO4, H3PO4) — гидролиз идет ступенчато.
Если в состав соли входят катион и анион слабых электролитов (выпадает осадок, выделяется газ), идет необратимый гидролиз.
Гидролизу не подвергаются соли, образованные катионами и анионами сильных электролитов, а также нерастворимые в воде соли.
Пример:
В эксперименте были соли:
АlСl3 — соль образована слабым электролитом — основанием Аl(ОН)3, сильной кислотой — соляной, гидролизуется по катиону.
Na2CO3 — соль образована сильным основанием NaOH и слабой кислотой.
Н2СO3 — угольной, гидролизуется по аниону.
NaCl — соль образована сильным основанием NaOH и сильной кислотой НСl, гидролиза нет.
Алгоритм составления уравнения гидролиза соли:
1. Составить уравнение диссоциации соли, определить ион слабого электролита.
2. Составить уравнение его взаимодействия с водой, определить продукты гидролиза в виде ионов.
3. Сделать вывод о среде электролита.
4. Составить уравнение в молекулярном и ионном виде.
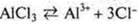
Al3+ — катион алюминия, слабое основание гидролиза по катиону
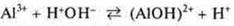
среда кислая, т. к. [Н+] [ОН-]
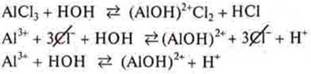
Другой вариант алгоритма составления уравнения гидролиза соли:
а) по химической формуле соли определить, какой кислотой и каким основанием образована соль;
б) записать левую часть уравнения в молекулярном виде;
в) составить уравнение в общем ионном виде, предположим, согласно этому уравнению, продукты правой части уравнения в молекулярном виде;
г) сократить одинаковые ионы в левой и правой частях уравнения общего ионного вида;
д) составить уравнение гидролиза в кратком виде, определить среду.
Пример:
а) Na2CO3 — соль образована NaOH — сильное основание, Н2СO3 — слабая кислота, гидролиз по аниону СO32-;
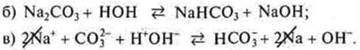
Предполагаем продукты правой части уравнения: соль NaHCO3 и основание NaOH; записываем в правую часть молекулярного уравнения;
г) составляем краткое ионное уравнение гидролиза, сокращаем катионы натрия:
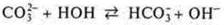
Вывод: [ОН-] [Н+] — среда щелочная; pH 7.
Сделаем общий вывод проведенного в начале урока эксперимента: соли подверглись гидролизу, вследствие чего раствор вызвал определенную реакцию среды.
Если следует дать ответ быстро, не составляя уравнения гидролиза соли, следует помнить: «сильное пересиливает слабое».
Определить, какими по силе электролитами образована соль, если сильным основанием — щелочная реакция среды: Кд осн Кд кис, если сильной кислотой — среда кислая: Кд кисл Кд осн, если и основание, и кислота сильные — реакция среды нейтральная: Кд кисл = Кд осн.
Пример:
Какую реакцию среды имеют растворы солей CuSO4, KNO2, Na2SO4?
CuSO4 — реакция среды кислая, т. к. соль образована сильной кислотой — серной.
KNO2 — реакция среды щелочная, т. к. соль образована сильным основанием.
Na2SO4 — реакция среды нейтральная, т. к. соль образована сильной кислотой и сильным основанием.
Если соль образована многозарядным ионом, то гидролиз идет ступенчато.
Пример:
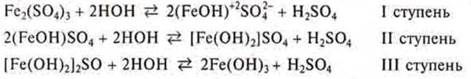
Почему при гидролизе соли не наблюдается выпадение осадка, т. е. не доходит гидролиз до III ступени?
Так как гидролиз — процесс обратимый, то как только начинает возрастать концентрация катионов водорода, то по принципу Лe Шателье равновесие смещается в сторону обратной реакции, в сторону исходных продуктов.
Если требуется усилить гидролиз, то можно повысить t°, увеличить концентрации исходных продуктов или добавить в раствор кислоту, катионов водорода. Гидролиз будет подавлен.
Чтобы усилить гидролиз соли, следует добавить в раствор соединение, связывающее катион водорода, т.е. добавить раствор щелочи.
Наблюдается образование воды Н+ + ОН- = Н2O, вследствие чего концентрация катионов водорода уменьшается и равновесие смещается в сторону прямой реакции. Гидролиз усиливается.
Можно добавить раствор соли, который имеет щелочную реакцию среды.
В случае гидролиза соли, образованной слабой кислотой, слабым основанием, образуются конечные продукты — слабое основание, слабая кислота. Гидролиз необратимый.
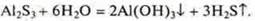
Какая реакция среды при таком гидролизе возможна? Среда определяется сравнением Кд слабых электролитов. Среда определяется большим значением Кд.
Пример.
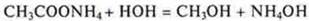
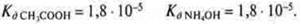
В данном случае реакция среды будет нейтральной, т. к. Кд реагентов равны.
В таблице растворимости солей, кислот, оснований в воде в примечании указано «в водной среде разлагаются», т. е. подвергаются гидролизу.
Обобщение и выводы
1. Гидролиз — взаимодействие соли с водой с образованием слабого электролита и изменением реакции среды.
2. Гидролиз — обратимый процесс.
3. Возможен гидролиз: а) по катиону; б) по аниону.
4. Реакция среды зависит от соотношения Кд электролитов, образовавших соль.
5. Гидролиз необратим в том случае, если хотя бы один из продуктов гидролиза уходит из сферы реакции. Он сразу идет и по катиону, и по аниону.
Практическое значения гидролиза:
Гидролиз имеет большое значение в живом организме, живой природе, в практической жизни человека.
В качестве моющего средства в древности использовали золу, в состав которой входит К2СО3 — карбонат калия, в воде гидролизуется с образованием щелочной реакции.
Раствор становится мыльным. В настоящее время в быту используют мыло, моющие стиральные порошки — натриевые, калиевые соли высших жирных карбоновых кислот — стеариновой и пальмитиновой.
Гидролизуясь в водном растворе они дают щелочную реакцию:
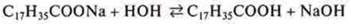
В состав моющих средств входят соли неорганических кислот: фосфат, карбонат, они усиливают моющее действие.
В фотографическом деле соли — бура Na2B2О4, Na2CО3, К2СО3, гидролизуясь, создают щелочную реакцию.
При недостатке кислотности почвы у растений развивается заболевание хлороз. В почву вводится удобрение (NH4)2SО4, которое повышает кислотность почвы благодаря гидролизу по катиону:
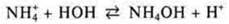
Благодаря солям, входящим в состав крови — NaHCО3, NО2, НРО4, поддерживается определенная реакция среды. Они регулируют избыток Н+ и избыток ОН-. При избытке Н+ они связываются с ОН- и равновесие смещается вправо, усиливается гидролиз.
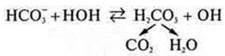
При избытке ОН- равновесие будет смешаться влево. Благодаря этому pH крови колеблется незначительно.
В полости рта поддерживается определенная среда. Благодаря аниону НPO42-, входящему в состав слюны, pH колеблется от 7 до 7,5.
Гидролиз органических веществ
Гидролиз характерен и для большинства органических веществ — это их важнейшее органическое свойство.
Однако в этих случаях вода — реагент, и не обязательно один из продуктов — слабый электролит, как при гидролизе неорганических веществ, и не всегда изменяется среда раствора.
Гидролиз органических веществ также процесс обратимый, возможно наступление химического равновесия, и необходимо знать условия его смещения по принципу Ле Шателье.
Следует помнить, что изучение теоретических основ гидролиза требует знаний не только ранее изученных вопросов курса химии, но и вопросов курса биологии, особенно обмен веществ в живом организме.
| Органические соединения | Уравнение гидролиза | Практическое применение |
| Галогеналканы | 
| Получение спирта. Присутствие щелочи смещает равновесие вправо, идет связывание HCl |
| Сложные эфиры | 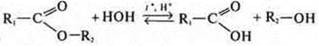 Среда кислая (неорганическая кислота). Для смещения равновесия вправо гидролиз ведут в присутствии щелочи с образованием соли карбоновой кислоты и спирта 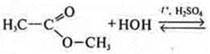
| Щелочное окисление в промышленности |
| Жир сложного эфира высших карбоновых кислот и глицерина. 1811 г. Э. Шеврель | 
В живом организме гидролиз жира — ферментативный процесс. | Производство мыла, глицерина
В живом организме синтезируется жир, соответственный данному организму, и затем участвует в обменном процессе. |
| Углеводы. Крахмал
Обмен углеводов ( биология) | 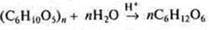 В живом организме гидролиз ферментативный. Схема 4, с. 161 учебника.
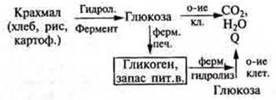
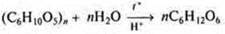
| Глюкоза — важнейший энергетический материал в живом организме
В промышленности продукты гидролиза: декстрины, мальтоза, глюкоза. Патока — смесь декстринов, мальтозы, глюкозы. Кондитерская пром-ть. Декстрины обладают клеющим действием. С ними связано появление корочки на хлебе, жареном картофеле; при накрахмаливании и глажении белья — плотной пленки |
| Биополимеры — белки (обмен белков; см. учебник биологии) | 
| В организме гидролиз до аминокислот, которые участвуют в синтезе белков, свойственных данному организму. Источник энергии в организме |
| Гидролиз АТФ (аденозинтрифосфорная кислота) | 
|
|
Задания для самостоятельной работы студентов:
1.Задания для закрепления знаний, умений определять характер среды и цвет индикатора (приложение Б)
| Формула соли | Характер среды | Цвет индикатора |
| 1.хлорид цинка |
|
|
| 2.сульфит калия |
|
|
| 3.силикат натрия |
|
|
| 4.фосфат калия |
|
|
| 5. гидрокарбонат натрия |
|
|
2.
| Название соли | Характер среды | Тип гидролиза |
| 1. сульфат меди(2) |
|
|
| 2. фосфат натрия |
|
|
| 3.хлорид магния |
|
|
| 4.карбонат калия |
|
|
| 5. нитрат натрия |
|
|
3.
| Формула соли (дать название) | Характер среды | Значение PH |
| 1.Cu(NO3)2 |
|
|
| 2 Na2S |
|
|
| 3 K3PO4 |
|
|
| 4 K2SO3 |
|
|
| 5 Na2SO4 |
|
|
4.
| Соль | Сила кислоты | Сила основания
|
| 1.Cu(NO3)2 |
|
|
| 2 Na2S |
|
|
| 3 K3PO4 |
|
|
| 4 K2SO3 |
|
|
| 5 Na2SO4 |
|
|
II. Обобщение и выводы
Мы изучили более углубленно процесс гидролиза, типы, значение в биохимических реакциях.
В повседневной жизни мы постоянно сталкиваемся с процессами гидролиза – при стирке белья, мытье посуды, умывании мылом. Даже процессы пищеварения, в частности, расщепления жиров, белков, углеводов протекают благодаря гидролизу.
Рассмотрение данной темы в курсе предмета « Химии » показывают огромную роль гидролиза в процессах жизнедеятельности организма. На нём основываются процессы питания и выделения, поддержания гомеостаза (постоянства среды) и перераспределения энергии. Без этого процесса не было бы возможным усвоение пищевых продуктов, так как высасываться в кишечнике способны только относительно небольшие молекулы. Образующиеся в процессе переваривания пищи вещества-мономеры, вступают в ряд реакций. Во многих из них они окисляются, и энергия, выделяющаяся при этом окислении, используется для синтеза АТФ из АДФ – основного процесса аккумулирования энергии в живых организмах. Эта энергия необходима для роста и нормального функционирования организма. Человек получает её как за счёт многостадийного процесса окисления пищи – белков, жиров и углеводов, так и за счёт гидролиза некоторых сложных эфиров, амидов, пептидов и гликозидов. Гидролиз – также основа синтеза мочевины.
III. Задание для внеаудиторной самостоятельной работы:
Заполнить таблицы по определению характеру среды и цвету индикатора.
Выучить конспект.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
Основная литература:
Габриелян, О. С. Химия: 11-й класс: базовый уровень: учебник / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — 5-е изд., стер. — Москва: Просвещение, 2023. — 128 с.
Урок 7. Гидролиз органических и неорганических соединений. - Химия - 11 класс – Видео. // Российская электронная школа: сайт. – URL: https://resh.edu.ru/subject/lesson/5912/conspect/92790/ (дата обращения: 12.03.2024).
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс: учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение. – 2018. – 352 с.
ПРИЛОЖЕНИЕ А
Физкультминутка для глаз
ПРИЛОЖЕНИЕ Б
Цвет индикаторов в различных средах
| Название | Окраска индикатора в среде |
| Кислая [H+]* [OH-]
рН | Нейтральная [H+] = [OH-]
рН = 7 | Щелочная [OH-] [H+]
рН 7 |
| Лакмус | красный | фиолетовый | синий |
| Фенолфталеин | бесцветный | бесцветный | малиновый |
| Метилоранж | розовый | оранжевый | желтый |