

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока


Методическая разработка практического занятия № 8 по теме: «Внутриаптечный контроль лекарственных форм с лекарственными средствами элементов II группы периодической системы Д.И. Менделеева»
Методическая разработка практического занятия № 8
по теме:
«Внутриаптечный контроль лекарственных форм с лекарственными средствами элементов II группы
периодической системы Д.И. Менделеева»
ПМ.02. «Изготовление лекарственных форм и проведение обязательных
видов внутриаптечного контроля»
МДК.02.02. «Контроль качества лекарственных средств»
для специальности 33.02.01, Фармация
базовый уровень подготовки
Просмотр содержимого документа
«Методическая разработка практического занятия № 8 по теме: «Внутриаптечный контроль лекарственных форм с лекарственными средствами элементов II группы периодической системы Д.И. Менделеева»»
|
| Автономная некоммерческая организация «Профессиональная образовательная организация медицинский колледж «Монада» |
Методическая разработка практического занятия № 8
по теме:
«Внутриаптечный контроль лекарственных форм с лекарственными средствами элементов II группы
периодической системы Д.И. Менделеева»
ПМ.02. «Изготовление лекарственных форм и проведение обязательных
видов внутриаптечного контроля»
МДК.02.02. «Контроль качества лекарственных средств»
для специальности 33.02.01, Фармация
базовый уровень подготовки
г. Евпатория, 2021
Рассмотрена и одобрена на заседании
ЦК Профессиональных модулей
специальности Фармация
протокол № ____ от ____ _______2021 г.
Председатель ЦК __________ Заховаева А.С.
Методическая разработка практического занятия составлена в соответствии с ФГОС СПО по специальности 33.02.01 Фармация, утвержденным приказом Министерства образования и науки Российской Федерации от 12.05.2014 № 501 и зарегистрированным в Минюсте России 26.06.2014 N 32861.
Автор-разработчик: – Заховаева А.С. – преподаватель высшей квалификационной категории
Организация-разработчик – АНО «ПОО медицинский колледж «Монада»
Рецензент: Мельникова Н.В. – кандидат фармацевтических наук, преподаватель высшей квалификационной категории, преподаватель ПМ 01 Реализация лекарственных средств и товаров аптечного ассортимента АНО «ПОО медицинский колледж «Монада».
Пояснительная записка
Данная методическая разработка составлена в соответствии с рабочей программой по междисциплинарному курсу МДК.02.02. «Контроль качества лекарственных средств» профессионального модуля ПМ.02. «Изготовление лекарственных форм и проведение обязательных видов внутриаптечного контроля» для специальности 33.02.01 Фармация и предназначена для проведения практических занятий с обучающимися групп 0ФМ-3 и 0ФМ-4.
Структура методической разработки:
методический блок, где даны рекомендации по работе с методической разработкой; определены цели занятия, актуальность темы, мотивация, место проведения занятия, оснащение; указаны междисциплинарные связи, уровень освоения, формируемые компетенции, список литературы, задание для самостоятельной внеаудиторной работы обучающихся; представлена хронологическая карта занятия, в которой указаны виды деятельности преподавателя и обучающихся на каждом его этапе.
информационный блок – материалы практического занятия, материально-техническое обеспечение занятия, технологическая карта практического занятия, иллюстративный материал, сопровождающий практическое занятие;
блок контроля знаний включает: перечень вопросов для активизации познавательной деятельности обучающихся, вопросы для закрепления нового материала и коррекции ошибок по данной теме, тематические и ситуационные задачи, тестовые задания.
На занятии используются следующие методы обучения:
1. Словесные:
- объяснительно-иллюстративный, рассказ, беседа, объяснение;
- проблемные вопросы;
- индивидуальный и фронтальный опрос.
2. Наглядные:
- показ (схем, стендов, субстанций, реактивов, титрантов, приборов и установок и т.д.);
- демонстрация (видеоуроки, презентации)
3. Практические – упражнения в правильном определении подлинности и количественного содержания лекарственных веществ в лекарственных формах.
Содержание:
1. Методический блок.
2. Информационный блок.
3. Блок контроля знаний.
4. Приложения.
I. МЕТОДИЧЕСКИЙ БЛОК
Технологическая карта практического занятия № 8
Название: ПМ.02. «Изготовление лекарственных форм и проведение
обязательных видов внутриаптечного контроля»
МДК.02.02. «Контроль качества лекарственных средств»
Специальность: 33.02.01 Фармация
Группа: 0-ФМ-4
Тема занятия: Внутриаптечный контроль лекарственных форм с лекарственными средствами элементов II группы периодической системы Д.И. Менделеева
Количество часов: 4
Вид занятия: практическое
Тип занятия: занятие по применению полученных знаний и умений, приобретению практического опыта
Уровень освоения знаний 2
Цели занятия:
1. Учебные цели:
Обучающийся должен иметь практический опыт проведения внутриаптечного контроля лекарственных средств – соединений магния, кальция, цинка.
Обучающийся должен знать:
1) Основные положения приказов МЗ РФ по изготовлению лекарственных форм и проведению обязательных видов внутриаптечного контроля;
2) Основные положения нормативно-технических документов по проведению обязательных видов внутриаптечного контроля;
3) Методы полного химического анализа и обязательных видов внутриаптечного контроля;
4) Правила оценки качества изготовленных лекарственных форм;
5) Общую характеристику II группы периодической системы
6) Свойства, идентичность, испытания на чистоту, количественное определение и применение лекарственных средств из соединений магния, кальция, цинка.
7) Правила и порядок хранения соединений магния, кальция, цинка.
Обучающийся должен уметь:
1) пользоваться нормативно – технической документацией и справочной литературой для поиска необходимой информации п проведению внутриаптечного контроля лекарственных средств – соединений магния, кальция, цинка;
2) проводить органолептический, физический, химический контроль лекарственных средств соединений магния, кальция, бария, цинка,;
3) применять технику выполнения качественного и количественного анализа лекарственных средств соединений магния, кальция, бария, цинка; 4) определять допустимые отклонения согласно нормативным документам;
5) соблюдать правила техники безопасности при работе с реактивами в учебной лаборатории ККЛС;
6) выполнять практические задания по алгоритму практического занятия.
2. Развивающие цели:
Развивать познавательный интерес к заданной теме, навыки самостоятельной работы, память, мышление, внимание, осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач.
3. Воспитательные цели:
Воспитывать чувство ответственности за порученное дело, аккуратность, добросовестность, умение принимать решение в стандартных и нестандартных ситуациях, ориентироваться в условиях смены технологий в профессиональной деятельности фармацевта, правила деонтологического поведения с посетителями аптеки.
Актуальность темы
Инъекционные растворы кальция хлорида применяются как противоаллергические, гемостатические и дезинтоксикационные средства.
Растворы магния сульфата при инъекционном введении выполняют роль спазмолитического, обезболивающего и противосудорожного средства.
Растворы цинка сульфата в глазных каплях и в виде растворов для промываний слизистых обладают антисептическим действием.
Важность фармакологического применения требует полного химического соответствия ГФ.
Соблюдение технологических правил изготовления этих лекарственных форм, их стабильность зависит от физико-химических свойств субстанций, растворимости, термической устойчивости.
Формируемые компетенции:
ОК: ОК 1. Понимать сущность и социальную значимость своей будущей профессии, проявлять к ней устойчивый интерес.
ОК 2. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество.
ОК 3. Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность.
ОК 4. Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития
ОК 5. Использовать информационно-коммуникационные технологии в профессиональной деятельности.
ОК 6. Работать в коллективе и в команде, эффективно общаться с коллегами, руководством, потребителями.
ОК 7. Брать на себя ответственность за работу членов команды (подчиненных), за результат выполнения задания.
ОК 8. Самостоятельно определять задачи профессионального и личностного развития, заниматься самообразованием, осознанно планировать повышение своей квалификации.
ОК 9. Ориентироваться в условиях частой смены технологий в профессиональной деятельности.
ОК 10. Бережно относиться к историческому наследию и культурным традициям народа, уважать социальные, культурные и религиозные различия.
ОК 11. Быть готовым брать на себя нравственные обязательства по отношению к природе, обществу и человеку.
ОК 12. Вести здоровый образ жизни, заниматься физической культурой и
спортом для укрепления здоровья, достижения жизненных и профессиональных целей.
ПК: ПК 2.1. Изготавливать лекарственные формы по рецептам и требованиям учреждений здравоохранения.
ПК 2.2. Изготавливать внутриаптечную заготовку и фасовать лекарственные средства для последующей реализации.
ПК 2.3. Владеть обязательными видами внутриаптечного контроля лекарственных средств.
ПК 2.4. Соблюдать правила санитарно-гигиенического режима, охраны труда, техники безопасности и противопожарной безопасности.
ПК 2.5. Оформлять документы первичного учета.
Место проведения: учебный кабинет № 202.
Учебно-методическое оснащение: рабочая программа профессионального модуля, КТП, технологическая карта практического занятия, конспект занятия, методические рекомендации для обучающихся (инструкция проведения практического занятия), рабочие тетради, инструкция по технике безопасности, алгоритм контроля качества лекарственной формы, ГФ, Приказ МЗ РФ 2015 г № 751н, материалы контроля, бланки ППК; основные этикетки, предупреди-тельные этикетки, образцы лек. формы, ПСЭ Д.И Менделеева, калькулятор.
Материально-техническое обеспечение: Штативы с пробирками, горка с реактивами, исследуемый раствор – цинка сульфат изотонический, 0,05М раствор трилона Б, КХТС, аммиачный буферный раствор, 10% NaOH, желтая кровяная соль, красная кровяная соль, натрия сульфид, магния сульфат, 50% раствор кальция хлорида, цинка оксид, магния оксид, бария хлорид.
Межпредметные связи:
| Входящие | Выходящие |
| 1. Основы латинского языка с медицинской терминологией 2. Органическая и неорганическая химия 3. Аналитическая химия 4. Основы патологии человека | 1. Фармакология 2. Фармакогнозия. 3. Технология изготовления лекарственных форм 4. Организация и экономика фармации. |
Этапы и хронология занятия (180 минут)
| № п/п | Этапы занятия | Время | Содержание занятия |
| 1 | 2 | 3 | 4 |
| 1. | Организационный этап | 2 мин. | Приветствие, проверка присутствующих, их готовности к занятию, заполнение журнала, проверка санитарного состояния аудитории и внешнего вида обучающихся |
| 2. | Формулировка темы | 2 мин. | Сообщение темы занятия, ее актуальности, целей, плана занятия |
| 3. | Определение мотивации | 2 мин. | Лекарственные препараты на основе магния сульфата, кальция хлорида, цинка сульфата, а также оксидов магния и цинка широко используются в клинической практике в виде растворов для инъекций, растворов для внутривенного введения, суспензий, порошков и т.д. Поэтому контроль качества лекарственных форм, содержащих ионы кальция, магния и цинка согласно нормативным документам подвергаются полному химическому анализу. |
| 4. | Инструктаж по правилам и мерам техники безопасности при работе в учебной лаборатории ККЛС | 5 мин. | Доведение инструкцию по правилам и мерам безопасности при работе в учебной лаборатории, оформление журнала инструктажа (подписи обучающихся) |
| 5. | Контроль исходного уровня знаний | 15 мин. | а) проверка знаний: вопросы к устному фронтальному опросу, тестовый контроль; б) проверка внеаудиторной самостоятельной работы: проверка домашнего задания; в) подведение итогов контроля: оценка исходных знаний |
| 6. | Обучающий этап | 23 мин., в т. ч.:
|
|
| 6.1. | Ознакомление с ходом практического занятия по алгоритму | 3 мин. | Доведение порядка работы на примере предложенной лекарственных форм. |
| 6.2. | Ознакомление с проведением обязательных видов внутриаптечного контроля (письменного; органолептического; контроля при отпуске). | 10 мин. | Доведение инструкции о порядке проведения обязательных видов внутриаптечного контроля раствора цинка сульфата изотонического. |
| 6.3. | Ознакомление с проведением полного химического анализа с теоретическим обоснованием. | 10 мин. | Доведение инструкции о порядке проведения полного химического контроля раствора цинка сульфата изотонического. |
| 7. | Самостоятельная работа обучающихся | 80 мин., в т. ч.: |
|
| 7.1. |
| 30мин. | Проведение обязательных видов внутриаптечного контроля. |
| 7.2. |
| 30мин. | Проведение полного химического анализа глазных капель, содержащих цинка сульфат, включая качественный и количественный анализ субстанции (цинка сульфат) и изотонирующего вещества (натрия хлорид). |
| 7.3. |
| 20 мин | Оформление вывода о качестве изготовленной лекарственной формы с определением допустимых норм отклонения. |
| 8. | Контроль конечного уровня усвоения знаний. | 45 мин | Вопросы для закрепления нового материала и коррекции ошибок Тесты, решение ситуационных задач |
| 9. |
| 6 мин. | Подведение итогов Выставление и комментарии оценки за тесты и задания Анализ и оценивание деятельности обучающихся на занятии Задание на дом |
Список использованной литературы и Интернет-ресурсов
для подготовки к занятию:
Нормативная:
Приказ Министерства здравоохранения РФ от 26 октября 2015 № 751н "Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность";
Приказ Министерства здравоохранения РФ от 16 июля 1997 г. № 214 «О контроле качества лекарственных средств, изготовляемых в аптечных организациях (аптеках)»;
Приказ Министерства здравоохранения РФ от 16 октября 1997 г. N 305 «О нормах отклонений, допустимых при приготовлении лекарственных средств и фасовке промышленной продукции в аптеках»;
Приказ Министерства здравоохранения РФ от 21октября 1997 г. № 308 «Об утверждении инструкции по изготовлению в аптеках жидких лекарственных форм»;
Приказ Министерства здравоохранения РФ от 21октября 1997 г. № 309 «Об утверждении инструкции по санитарному режиму аптечных учреждений»;
Методические указания по приготовлению, контролю качества, хранению и использованию растворов внутреннего употребления для новорожденных в аптеках и ЛПУ от 30 декабря 1986 г. № 133-2/18-9.
Основная:
Т.В. Плетенева…, Контроль качества лекарственных средств. ГЭОТАР-Медиа, 2014;
Контроль качества лекарственных средств. Авторы-составители О.О. Новиков, Д.И. Писарев – Ростов-на-Дону, «Феникс», 2018;
Дополнительная (в том числе электронные книги):
Лабораторный практикум по контролю качества лекарственных средств: Учебно-методическое пособие – Издательский Дом Воронежского государственного университета, 2014;
Глущенко Н.Н., Плетенева Т.В., Попков В.А. Фармацевтическая химия. Москва, «Академия», 2004
Арзамасцев А.П. Фармацевтическая химия: Учебное пособие – М.: ГЭОТАР-МЕД, 2004;
Интернет-ресурсы:
www.nauki-online.ru
www.medlinks.ru
www.medvuz.info.ru
www.medbook.net.ru
www.studmedlib.ru
www.Med-Tutorial.ru
www.leim.ru
Преподаватель ________________ А.С. Заховаева
II. ИНФОРМАЦИОННЫЙ БЛОК
Глоссарий (терминологический словарь)
Металлические свойства – способность атомов отдавать электроны.
Именно наличием свободных электронов объясняются общие физические свойства металлов: высокая электропроводность и теплопроводность, характерный металлический блеск, ковкость.
Металлические свойства усиливаются в группах сверху вниз.
В каждой главной подгруппе наиболее выражены металлические свойства у элементов седьмого периода.
В периодах происходит ослабление металлических свойств.
В каждом периоде самые сильные металлические свойства у элементов IA группы, то есть у щелочных металлов.
Самый сильный металл – франций.
Неметаллические свойства противоположны металлическим Неметаллические свойства – способность атомов принимать электроны.
В группе сверху вниз неметаллические свойства ослабевают.
Самый сильный неметалл каждой группы располагается вверху (во втором периоде).
Неметаллические свойства в периодах усиливаются слева направо.
В каждом периоде наиболее выражены неметаллические свойства у элементов VIIA группы (у галогенов).
В периодах неметаллические свойства усиливаются, а в группах – ослабевают.
Самый сильный неметалл – фтор.
Щелочноземельные металлы – химические элементы 2-й группы периодической таблицы элементов: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba), радий (Ra).
Все щёлочноземельные металлы серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение – стронций). Рост плотности щёлочноземельных металлов наблюдается только начиная с кальция. Самый тяжёлый – радий.
Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами, водородом и гелием. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и в большинстве соединений имеют степень окисления +2 (очень редко +1).
Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера.
Реакционная способность – это способность вещества вступать в химическую реакцию. При твердофазных химических реакциях реакционная способность определяет скорость процесса, химический состав, кристаллическую структуру и морфологию (размер, форма) продукта реакции, а также пространственное протекание реакции (топологию реакции).
Токсичность (от греч. Toxikon – яд), способность вещества вызывать нарушения физиологических функцций организма, в результате чего возникают симптомы интоксикаций (заболевания), а при тяжелых поражениях – его гибель.
Магнезит – распространённый минерал, карбонат магния MgCO3. Название от области Магнесия (Фессалия, Греция), где был впервые обнаружен.
Кристаллизационная вода – вода в минералах, находящаяся в кристаллической решетке в виде молекул Н2О, занимающих определенные места (например, гипс CaSO4 2Н2О, мирабилит Na2SO4 10H2О). Выделение кристаллизационной воды при нагревании происходит в определенном интервале температуры.
Кристаллогидраты – кристаллы, содержащие молекулы воды и образующиеся, если в кристаллической решётке катионы образуют более прочную связь с молекулами воды, чем связь между катионами и анионами в кристалле безводного вещества. При низких температурах вода в кристаллогидратах может быть связана как с катионами, так и с анионами солей. Многие соли, а также кислоты и основания выпадают из водных растворов в виде кристаллогидратов.
Дисперсность – физическая величина, характеризующая размер взвешенных частиц в дисперсных системах. Это величина, показывающая какое число частиц можно уложить вплотную в одном кубическом метре. Чем меньше размер частиц, тем больше дисперсность.
Дисперсность имеет смысл отношения площади поверхности частиц к занимаемому ими объёму или к их суммарной массе.
Антацидные средства (от др.-греч. ἀντι- «против» + лат. acidus «кислый») – лекарственные препараты, предназначенные для лечения кислотозависимых заболеваний желудочно-кишечного тракта посредством нейтрализации кислоты хлористоводородной (соляной), входящей в состав желудочного сока.
Рентгeноконтрастные средства – используемые в рентгенодиагностике контрастные вещества. Применяются для улучшения визуализации внутренних органов и анатомических структур при лучевых методах исследования (рентгеновской компьютерной томографии и рентгенографии). Рентгенопозитивные препараты, используемые в большинстве случаев, как правило, содержат йод или барий. В качестве рентгенонегативных контрастных веществ применяются воздух, закись азота, углекислый газ. Рентгенопозитивные препараты содержат тяжёлые химические элементы, поскольку чем больше атомный номер элемента, тем сильнее он поглощает рентгеновское излучение.
Контрастное усиление при магнитно-резонансой томографии основано на других физических принципах, в связи с чем при МРТ-исследованиях используются контрастные препараты с принципиально иным составом.
ПЛАН
ПРАКТИЧЕСКОГО ЗАНЯТИЯ
| 1. Изучаемые вопросы: | Уровень освоения |
| 1. Ознакомление с ходом практического занятия согласно алгоритма. | II |
| 2. Ознакомление с проведением обязательных видов внутриаптечного контроля (письменного; органолептического; контроля при отпуске). | II |
| 3. Ознакомление с проведением полного химического анализа с теоретическим обоснованием. | II |
| 2. Отрабатываемые манипуляции: | Уровень освоения |
| 1. Проведение обязательных видов внутриаптечного контроля. | II |
| 2. Проведение полного химического анализа глазных капель, содержащих цинка сульфат, включая качественный и количественный анализ субстанции (цинка сульфат) и изотонирующего вещества (натрия хлорид). | II |
| 3. Оформление вывода о качестве изготовленной лекарственной формы с определением допустимых норм отклонения. | II |
Инструкция к проведению практического занятия
1. Проведение обязательных видов внутриаптечного контроля лекарственной формы:
Rp: Solutionis Zinci sulfatis 0,25% - 10,0
Sterillis!
Isotonicae!
Da tales dosis № 10
Da. Signa: глазные капли: по 2 капли 2 раза в день
1.1. Письменный контроль:
Паспорт письменного контроля (обратная сторона)
Общий объем = 10 мл∙10 = 100 мл
Цинка сульфата 0,25
Эквивалент цинка сульфата
по натрия хлориду 0,12.
Соответственно:
натрия хлорида для изготовления:
0,9 – (0,25∙0,12) = 0,87 г.
Воды очищенной до 100 мл.
Паспорт письменного контроля (лицевая сторона)
Дата ____ № Требования _____
Aguae purificatae 50 ml
Zinci sulfatis 0,25
Natrii cloridi 0,87
Aguae purificatae ad 100 m
Sterillisetur!
V = 100 ml
10 № 10
Приготовил:____ (подпись)
Проверил _____ (подпись)
№ анализа ______
1.2. Органолептический контроль:
Прозрачный раствор без запаха, без механических включений, кислой реакции среды.
1.3. Контроль при отпуске:
На каждом флаконе должна быть этикетка «глазные капли» с указанием:
- названия лечебно-профилактического учреждения;
- наименования лекарственной формы, концентрации и объема;
- номера анализа;
- даты изготовления;
- срока годности (30 дней);
и дополнительные этикетки: «Хранить в прохладном, защищенном от света месте» и «Беречь от детей»
2. Проведение полного химического анализа
2.1. Проведение качественного анализа (реакции идентичности):
а) цинка сульфат;
| Методика определения | Химические реакции |
| 1. В пробирку помещают 2 мл исследуемого раствора. К раствору прибавляют 0,2 мл раствора натрия гидроксида концентрированного; образуется белый осадок. | ZnSO4+2NaOH→Zn(OH)2+Na2SO4 |
| 2. К полученному осадку прибавляют 2-3 капли раствора натрия гидроксида концентрированного. Осадок растворяется. | ↓Zn(OH)2+2NaOH→Na2[Zn(OH)4]
|
| 3. В пробирку помещают 2 мл исследуемого раствора. К раствору прибавляют 2-3 капли гексацианоферрата калия (III). Образуется осадок белого цвета. | 3ZnSO4+2K3[Fe(CN)6] → →Zn3[Fe(CN)6]2 ↓+3K2SO4 |
| 4. В пробирку помещают 2 мл исследуемого раствора. К раствору прибавляют 2-3 капли бария хлорида. Образуется белый осадок, который не растворяется при прибавлении 2-х капель щелочи или кислоты. | ZnSO4+BaCl2→BaSO4↓+ZnCl2 |
б) натрия хлорид
| Методика определения | Химические реакции |
| В пробирку помещают несколько капель исследуемого раствора, прибавляют 1-2 капли 2% раствора серебра нитрата. К полученному осадку прибавляют 5-6 капель гидроксида аммония. Осадок растворяется. | NaCl+AgNO3→AgCl↓+NaNO3 AgCl↓+2NH4OH→[Ag(NH3)2]Cl+2H2O |
2.2. Количественное определение:
а) цинка сульфат;
2 мл исследуемого раствора помещают во флакон для титрования, прибавляют 5 мл аммиачного буферного раствора, прибавляют несколько крупинок кислотно-хром-темно-синего. В титровальную установку помещают 0,05М раствор трилона Б и титруют до синего окрашивания.
Химизм титрования:
ZnSO4+H2Ind ↔ [ZnInd]+H2SO4
ZnSO4+Na2[H2Y] →Na2[ZnY]+H2SO4
[ZnInd]+ Na2[H2Y] → Na2[ZnY]+H2Ind
1 мл 0,05М раствора трилона Б соответствует 0,01438 г/мл цинка сульфата.
ХZnSO4 = 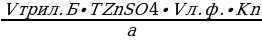
ТZnSO4/трил.Б = 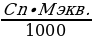 =
= 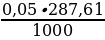 = 0,01438 г/мл; Mэкв. = м.м. = 287,61
= 0,01438 г/мл; Mэкв. = м.м. = 287,61
Формулы расчета титра, теоретического объема титранта приведены в
таблице.
Расчет теоретического объема титранта, ушедшего на титрование:
масса цинка сульфата в 10 мл составляет 0,025 г,
масса цинка сульфата в аликвоте: – Х; Х = 0,005 г
Объем 0,05М. трилона Б, ушедший на титрование цинка сульфата, составляет:
Vтрил.Б = 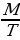 =
= 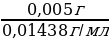 = 0,348 мл
= 0,348 мл
б) натрия хлорид
Во флакон для титрования помещают 0,5 мл исследуемого раствора, прибавляют 2 капли калия хромата. Титруют 0,1н. раствором серебра нитрата до получения красно-коричневого окрашивания.
1 мл 0,1н. раствора серебра нитрата соответствует 0,005844 г/мл натрия хлорида.
ХNaCl = 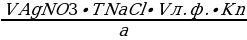 Mэкв. = м.м. = 58,44
Mэкв. = м.м. = 58,44
Формулы расчета титра, теоретического объема титранта приведены в
таблице.
Расчет теоретического объема титранта, ушедшего на титрование:
масса натрия хлорида в 10 мл составляет 0,087 г,
масса натрия хлорида в аликвоте: – Х; Х = 0,00435 г
Объем 0,1 н. AgNO3, ушедший на титрование натрия хлорида, составляет:
VAgNO3 = 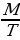 =
= 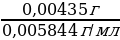 = 0,74 мл
= 0,74 мл
2.3. Оформление результатов полного химического контроля с определением норм отклонения
Согласно приказа 2015 г. № 751н:
- норма отклонения цинка сульфата в 1 флаконе составляет ± 15%. Это значит, что количество цинка сульфата может быть от 0,0212 г до 0,0287 г.
- норма отклонения натрия хлорида в 1 флаконе составляет ± 15%. Это значит, что количество натрия хлорида может быть от 0,074 г до 0,1 г.
Инструкция для обучающихся
1. Проведение обязательных видов внутриаптечного контроля лекарственной формы:
Rp: Solutionis Zinci sulfatis 0,25% - 10,0
Sterillis!
Isotonicae!
Da tales dosis № 10
Da. Signa: глазные капли: по 2 капли 2 раза в день
1.1. Письменный контроль:
1.2. Органолептический контроль.
2. Проведение полного химического анализа
2.1. Проведение качественного анализа (реакции идентичности):
а) цинка сульфат
Методика определения
1. В пробирку помещают 2 мл исследуемого раствора. К раствору прибавляют 0,2 мл раствора натрия гидроксида концентрированного; образуется белый осадок.
2. К полученному осадку прибавляют 2-3 капли раствора натрия гидроксида концентрированного. Осадок растворяется.
3. В пробирку помещают 2 мл исследуемого раствора. К раствору прибавляют 2-3 капли гексацианоферрата калия (III). Образуется осадок белого цвета.
4. В пробирку помещают 2 мл исследуемого раствора. К раствору прибавляют 2-3 капли бария хлорида. Образуется белый осадок, который не растворяется при прибавлении 2-х капель щелочи или кислоты.
б) натрия хлорид
Методика определения
В пробирку помещают несколько капель исследуемого раствора, прибавляют 1-2 капли 2% раствора серебра нитрата. К полученному осадку прибавляют 5-6 капель гидроксида аммония. Осадок растворяется.
2.2. Количественное определение цинка сульфата: (определение метода, его обоснование)
Методика определения:
2 мл исследуемого раствора помещают во флакон для титрования, прибавляют 5 мл аммиачного буферного раствора, прибавляют несколько крупинок кислотно-хром-темно-синего. В титровальную установку помещают 0,05М раствор трилона Б и титруют до синего окрашивания.
Химизм титрования
Расчет количества вещества в растворе проводят по формуле:
ХZnSO4 = 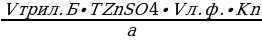
Расчет титра цинка сульфата проводят по формуле:
ТZnSO4/трил.Б = 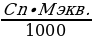
Расчет предварительного объема титранта проводят по формуле:
Vтрил.Б = 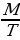
Произвести фактический расчет количества вещества в растворе, определить нормы отклонения для цинка сульфата в соответствии с таблицами норм отклонений.
2.3. Количественное определение натрия хлорида (определение метода, его обоснование)
Методика определения:
Во флакон для титрования помещают 0,5 мл исследуемого раствора, прибавляют 2 капли калия хромата. Титруют 0,1н. раствором серебра нитрата до получения красно-коричневого окрашивания.
Химизм титрования
Расчет количества вещества в растворе проводят по формуле:
ХNaCl = 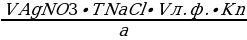
Расчет титра натрия хлорида проволят по формуле:
ТNaCl/AgNO3 = 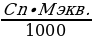
Расчет предварительного объема титранта проводят по формуле:
Vтрил.Б = 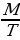
Произвести фактический расчет количества вещества в растворе, определить нормы отклонения для натрия хлорида в соответствии с таблицами норм отклонений. Сделать вывод о качестве лекарственной формы. Результаты контроля зарегистрировать в журнале полного химического анализа и в тетрадях по практическим занятиям.
III. БЛОК КОНТРОЛЯ ЗНАНИЙ
Вопросы для активизации познавательной деятельности обучающихся:
1. Какие соли катионов s- и d-элементов используют как лекарственные средства?
2. Почему запрещено применение в медицине и фармацевтическом анализе соединений ртути?
3. Какая соль магния называется «горькая/английская соль». Каково ее терапевтическое применение?
4. Какие лекарственные средства, содержащие ион кальция, применяют в медицине?
5. Известно, что ион бария обладает токсическим действием. Используют ли соли бария в качестве фармацевтических препаратов?
6. Охарактеризуйте физические и химические свойства магния сульфата и кальция хлорида. В какой химической форме присутствует магний и кальций в жидких средах организма?
7. Какова физиологическая роль ионов Ca2+ и Mg2+ в организме?
8. Приведите примеры реакций определения подлинности препаратов магния и кальция. Каковы условия их проведения?
9. Принимая во внимание то, что в организме ионы кальция и магния – антагонисты, перечислите катионы металлов, являющиеся недопустимыми примесями в препаратах магния сульфата и кальция хлорид.
Вопросы для закрепления нового материала и коррекции ошибок
1. Какое физиологическое отличие фармакологического применения ионов магния, кальция, цинка?
2. Какими свойствами обладает бария сульфат и как провести идентификации. Этого соединения?
3. Почему небезопасно присутствие в препарате растворимых солей бария?
4. Какими реакциями идентификации можно отличить ионы магния,
кальция, цинка?
5. Назовите метод количественного определения для солей щелочноземельных металлов, его сущность и условия проведения
6. В каких условиях необходимо правильно хранить кальция хлорид, бария сульфат и почему?
7. Почему при комплексонометрическом определении необходимо добавлять аммиачный буферный раствор?
8. При лечении каких заболеваний используют цинка оксид и цинка сульфат, кальция хлорид, магния сульфат?
9. Объясните принципы изменения окраски индикатора в точке эквивалентности.
10. Как определяют примеси растворимых солей бария, тяжелых металлов при анализе бария сульфата? Напишите химизм реакций.
11. Приведите формулу расчета процентного содержания кальция хлорида, магния сульфата при их количественном определении.
12. Дайте характеристику индикаторов метода комплексонометрии. Каким требованиям они должны соответствовать?
13. Напишите химизм реакций идентификации цинка оксида и цинка сульфата.
Тестовые задания
Вариант № 1
1. Лекарственные средства кальция, магния, цинка при количественном определении титруют раствором:
а) натрия эдетата;
б) щелочи;
в) кислоты;
г) йода;
д) калия перманганата.
2. При количественном определении лекарственных средств кальция, магния, цинка методом комплексонометрии титрование проводят с:
а) натрия гидрокарбонатом;
б) кислотой уксусной;
в) фосфатным буферным раствором;
г) аммиачным буферным раствором;
д) аммония гидроксидом.
3. Аммиачный буферный раствор при количественном определении лекарственных средств кальция, магния, цинка добавляют для:
а) сохранения постоянной рН титрованной смеси;
б) содействия перехода цвета индикатора;
в) усиления растворимости продуктов титрования;
г) уменьшения диссоциации трилона Б;
д) усиления кислотных средств трилона Б.
4. Содержание цинка сульфата в глазных каплях определяют методом:
а) рефрактометрии;
б) комплексонометрии;
в) меркуриметрии;
г) аргентометрии;
д) нейтрализации.
5. Укажите субстанцию, легко растворимую в воде и спирте:
а) калия хлорид;
б) магния сульфат;
в) кальция хлорид;
г) цинка сульфат;
д) натрия тиосульфат.
6. При растворении кальция хлорида в воде происходит:
а) выделение газа;
б) уменьшение объема раствора;
в) нагревание раствора;
г) охлаждение раствора;
д) увеличение объема раствора.
7. В условиях аптеки из субстанции кальция хлорид гексагидрат готовят 50% р-р, из которого изготавливают другие ЛС. Это обусловлено тем, что:
а) субстанция гигроскопична;
б) изготовление лекарств с использованием концентратов повышает их качество;
в) субстанция выветривается;
г) субстанция чрезвычайно гигроскопична, под влиянием влаги расплывается, состав ее становится нестабильным, что приводит к неточностям в дозировании;
д) субстанция растворяется в воде и спирте.
8. Количественное определение магния сульфата проводят методом:
а) йодометрии;
б) перманганатометрии;
в) комплексонометрии;
г) алкалиметрии;
д) ацидиметрии.
9. Каким реактивом определяют ионы магния в лекарственных средствах:
а) натрия нитритом;
б) калия хлоридом;
в) натрия карбонатом;
г) калия ферроцианидом;
д) динатрия гидрофосфатом с аммиачным буферным раствором.
10. С помощью калия ферроцианида определяют катионы:
а) цинка;
б) магния;
в) калия;
г) натрия;
д) серебра.
11. О каком свойстве кальция хлорида гексагидрата следует помнить при его хранении:
а) восстанавливаться;
б) гигроскопичность;
в) выветриваться;
г) окисляться;
д) разлагаться.
12. Слабительное действие магния сульфата для внутреннего применения обусловлено:
а) наличием иона магния;
б) наличием иона сульфата;
в) высокой концентрацией соли в воде;
г) наличием кристаллизационной воды;
д) действием иона магния.
13. Какая смесь обусловливает постоянное значение рН (9,5-10) при количественном определении цинка сульфата методом комплексонометрии:
а) NH4OH, NaOH;
б) NH4Cl, NaOH;
в) Na2CO3, NH4OH;
г) NaHCO3, Na2CO3;
д) NH4Cl, NH4OH.
14. Под действием какого реактива ион цинка осаждается в виде белого осадка:
а) натрия сульфата;
б) натрия хлорида;
в) натрия сульфида;
г) кальция хлорида;
д) бария хлорида.
15. Для идентификации кальция хлорида фармакопейной является реакция с:
а) калия нитратом;
б) аммония оксалатом;
в) сульфатами щелочных металлов;
г) натрия тиосульфатом;
д) кислотой серной.
16. Методом комплексонометрии количественно определяют ЛС:
а) кислота борная;
б) натрия гидрокарбонат;
в) магния сульфат;
г) натрия хлорид;
д) натрия тиосульфат.
17. Укажите субстанцию, содержащую в своем составе воду кристаллизационную:
а) калия ацетат;
б) калия хлорид;
в) калия йодид;
г) натрия бромид;
д) магния сульфат.
18. При хранении кальция хлорида кристаллического следует учитывать его способность:
а) выветриваться;
б) восстанавливаться;
в) расплываться на воздухе;
г) окисляться;
д) разлагаться.
19. Какое лекарственное средство легко растворяется в 95% этаноле:
а) натрия цитрат;
б) натрия хлорид;
в) натрия гидрокарбонат;
г) кальция хлорид гексагидрат;
д) калия хлорид.
20. Какое лекарственное средство с раствором калия фероцианида образует белый осадок:
а) этанол;
б) калия хлорид;
в) кислота глютаминовая;
г) метамизола натриевая соль;
д) цинка сульфат гептагидрат.
21. Ионами антагонистами являются ионы:
а) кальция и магния;
б) натрия и магния;
в) калия и магния;
г) магния и цинка;
д) цинка и ртути.
22. Количественное определение кальция хлорида в растворе нельзя определить методом:
а) комплексонометрии;
б) йодометрии;
в) меркуриметрии;
г) аргентометрии (по Мору);
д) аргентометрии (по Фольгарду).
Вариант № 2
1. Под действием какого реактива ион цинка осаждается в виде белого осадка:
а) натрия сульфата;
б) натрия хлорида;
в) натрия сульфида;
г) кальция хлорида;
д) бария хлорида.
2. Аммиачный буферный раствор при количественном определении лекарственных средств кальция, магния, цинка добавляют для:
а) сохранения постоянной рН титрованной смеси;
б) содействия перехода цвета индикатора;
в) усиления растворимости продуктов титрования;
г) уменьшения диссоциации трилона Б;
д) усиления кислотных средств трилона Б.
3. При растворении кальция хлорида в воде происходит:
а) выделение газа;
б) уменьшение объема раствора;
в) нагревание раствора;
г) охлаждение раствора;
д) увеличение объема раствора.
4. Лекарственные средства кальция, магния, цинка при количественном определении титруют раствором:
а) натрия эдетата;
б) щелочи;
в) кислоты;
г) йода;
д) калия перманганата.
5. О каком свойстве кальция хлорида гексагидрата следует помнить при его хранении:
а) восстанавливаться;
б) гигроскопичность;
в) выветриваться;
г) окисляться;
д) разлагаться.
6. В условиях аптеки из субстанции кальция хлорид гексагидрат готовят 50% раствор, из которого потом изготавливают другие лекарственные средства. Это обусловлено тем, что:
а) субстанция гигроскопична;
б) изготовление лекарств с использованием концентратов повышает их качество;
в) субстанция выветривается;
г) субстанция чрезвычайно гигроскопична, под влиянием влаги расплывается, состав ее становится нестабильным, что приводит к неточностям в дозировании;
д) субстанция растворяется в воде и спирте.
7. Каким реактивом определяют ионы магния в лекарственных средствах:
а) натрия нитритом;
б) калия хлоридом;
в) натрия карбонатом;
г) калия ферроцианидом;
д) динатрия гидрофосфатом с аммиачным буферным раствором.
8. Методом комплексонометрии количественно определяют лекарственное средство:
а) кислота борная;
б) натрия гидрокарбонат;
в) магния сульфат;
г) натрия хлорид;
д) натрия тиосульфат.
9. Какое лекарственное средство с раствором калия фероцианида образует белый осадок:
а) этанол;
б) калия хлорид;
в) кислота глютаминовая;
г) метамизола натриевая соль;
д) цинка сульфат гептагидрат.
10. Укажите субстанцию, легко растворимую в воде и спирте:
а) калия хлорид;
б) магния сульфат;
в) кальция хлорид;
г) цинка сульфат;
д) натрия тиосульфат.
11. Слабительное действие магния сульфата для внутреннего применения обусловлено:
а) наличием иона магния;
б) наличием иона сульфата;
в) наличием кристаллизационной воды;
г) действием иона магния;
д) высокой концентрацией соли в воде.
12. Ионами антагонистами являются ионы:
а) кальция и магния;
б) натрия и магния;
в) калия и магния;
г) магния и цинка;
д) цинка и ртути.
13. Содержание цинка сульфата в глазных каплях определяют методом:
а) рефрактометрии;
б) комплексонометрии;
в) меркуриметрии;
г) аргентометрии;
д) нейтрализации.
14. Какая смесь обусловливает постоянное значение рН (9,5-10) при количественном определении цинка сульфата методом комплексонометрии:
а) NH4OH, NaOH;
б) NH4Cl, NaOH;
в) Na2CO3, NH4OH;
г) NaHCO3, Na2CO3;
д) NH4Cl, NH4OH.
15. Количественное определение магния сульфата проводят методом:
а) йодометрии;
б) перманганатометрии;
в) комплексонометрии;
г) алкалиметрии;
д) ацидиметрии.
16. Для идентификации кальция хлорида фармакопейной является реакция с:
а) калия нитратом;
б) аммония оксалатом;
в) сульфатами щелочных металлов;
г) натрия тиосульфатом;
д) кислотой серной.
17. При хранении кальция хлорида кристаллического следует учитывать его способность:
а) выветриваться;
б) восстанавливаться;
в) расплываться на воздухе;
г) окисляться;
д) разлагаться.
18. Количественное определение кальция хлорида в растворе нельзя определить методом:
а) комплексонометрии;
б) йодометрии;
в) меркуриметрии;
г) аргентометрии (по Мору);
д) аргентометрии (по Фольгарду).
19. При количественном определении лекарственных средств кальция, магния, цинка методом комплексонометрии титрование проводят с:
а) натрия гидрокарбонатом;
б) кислотой уксусной;
в) фосфатным буферным раствором;
г) аммиачным буферным раствором;
д) аммония гидроксидом.
20. С помощью калия ферроцианида определяют катионы:
а) цинка;
б) магния;
в) калия;
г) натрия;
д) серебра.
21. Укажите субстанцию, содержащую в своем составе воду кристаллизационную:
а) калия ацетат;
б) калия хлорид;
в) калия йодид;
г) натрия бромид;
д) магния сульфат.
22. Какое лекарственное средство легко растворяется в 95% этаноле:
а) натрия цитрат;
б) натрия хлорид;
в) натрия гидрокарбонат;
г) кальция хлорид гексагидрат;
д) калия хлорид.
Ситуационные задачи
№ 1.
В начале рабочего дня в аптеке фармацевт приготовила на рабочем месте 20% раствор кальция хлорида объемом 1 л. При анализе установлено, что концентрация раствора составила 22%.
Вопросы:
1. Как исправить такую концентрацию?
2. Какой объем концентрата получится при разведении?
3. Какому виду контроля подвергается эта лекарственная форма?
4. Какому методу количественного определения отдается предпочтение? Ответ обоснуйте.
№ 2.
В рецептурно-производственный отдел аптеки поступил рецепт, содержащий следующую пропись:
Возьми: Настоя травы пустырника – 200,0
Натрия бромида,
Магния сульфата – по 4,0
Смешай. Дай.
Обозначь: по 1 ст. ложке 3 раза в день.
Вопросы:
1. Какой метод количественного определения применяют для магния сульфата?
2. Рассчитайте объем титранта и титр определяемого вещества.
3. Сделайте вывод о качестве лекарственной формы, если при количественном определении установлено, что содержание магния сульфата составляет 4,13 г.
№ 3.
В аптеку поступило требование:
Rp: Sol. Zinci sulfatis 2%-200 ml
Da. Signa: по 1 столовой ложке 2 раза в день.
Вопросы:
1. Какая ошибка допущена при выписывании этой лекарственной формы?
2. Какая субстанция должна быть указана в этом требовании?
3. Почему растворы цинка сульфата не применяются внутрь? Ответ обоснуйте.
№ 4.
При количественном определении субстанции в растворе было установлено содержание ее (m=1,98 г). Лекарственная форма была изготовлена по прописи:
Rp: Sol. Magnesii sulfatis 2%-100 ml
Da. Signa: по 1 столовой ложке 2 раза в день.
Вопрос:
Сделать вывод о качестве лекарственной формы с учетом норм расчета отклонений.
№ 5.
В аптеку поступил рецепт на изготовление присыпки при гипергидрозе стоп. При этом было обнаружено, что временно отсутствует цинка оксид.
Вопрос:
Можно ли заменить отсутствующую субстанцию цинка сульфатом? Ответ обоснуйте.
№ 6.
В рецептурно-производственный отдел аптеки поступил рецепт, содержащий следующую пропись:
Rp.: Zinci sulfatis 0,2
Acidi borici 0,3
Lanolini anhydrici 2,0
Vaselini ad 15,0
Misce, fiat unguentum.
Da. Signa. Для смазывания рук.
Вопросы:
1. Физический контроль. Нормы допустимых отклонений изготовленной мази.
2. Каков срок годности изготовленной в аптеке мази?
3. При физическом контроле масса готовой лекарственной формы составила 16,0. Правильно ли была приготовлена лекарственная форма?
№ 7.
В рецептурно-производственный отдел аптеки поступил рецепт, содержащий следующую пропись:
Rp.: Acidi borici Streptocidi ana 0,5
Unguenti Zinci 15,0
Lanolini 20,0
Misce fiat unguentum
Da. Signa. Наносить на пораженные участки кожи.
Вопрос:
При физическом контроле масса готовой лекарственной формы составила 35,0. Правильно ли была приготовлена лекарственная форма?
Рекомендации для обучающихся по выполнению внеаудиторной самостоятельной работы:
1. По конспекту лекций и учебнику Т.В. Плетенева…, Контроль качества лекарственных средств. ГЭОТАР-Медиа, 2014, повторить основные (контрольные) вопросы темы:
1) Общая характеристика II группы периодической системы
2) Свойства, идентичность, количественное определение и применение лекарственных средств из соединений магния, кальция, цинка.
3) Правила и порядок хранения соединений магния, кальция, цинка.
2. Выучить (повторить) основные определения по теме.
3. Составить опорный конспект лекции.
4. Подготовить слайды и комментарии к ним для презентации по теме (по 2 слайда одному обучающемуся).
IV. ПРИЛОЖЕНИЯ
Приложение 1.
ФОРМУЛЫ РАСЧЕТОВ
ПРИ ПРОВЕДЕНИИ ПОЛНОГО ХИМИЧЕСКОГО АНАЛИЗА
1. Определение массовой доли вещества в растворе:
Х =  X =
X = 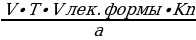
где: V – объем титранта, ушедшего на титрование;
T – титр определяемого вещества;
Vлек.формы – объем лекарственной формы на одну фасовку;
а – аликвота, объем лекарственной формы, взятой для определения.
2. Определение теоретического объема титранта:
V = 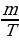
где: m – масса определяемого вещества в объеме, взятом на ттрование;
T – титр определяемого вещества.
3. Определение титра определяемого вещества:
T = 
где: Сn – концентрация титранта;
Mэкв. – масса эквивалента определяемого вещества.
4. Определение относительной погрешности (фактического отклонения) при оценке качества изготовленной лекарственной формы:
X = 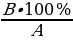 – 100%
– 100%
где: A – массовая доля вещества по прописи;
B – массовая доля вещества по результатам анализа.
Приложение № 2
Эталоны ответов на тестовые задания
Вариант № 1
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| а | г | а | б | в | г | г | в | д | а | б | в | д | в | б | в | д | в | г | д | а | б |
Вариант № 2
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| в | а | г | а | б | г | д | в | д | в | д | а | б | д | в | б | в | б | г | а | д | г |
Критерии оценки тестовых заданий:
«отлично» – 90% и более правильных ответов;
«хорошо» – 80-89% правильных ответов;
«удовлетворительно» – 50-79% правильных ответов;
«неудовлетворительно» – менее 50% правильных ответов.
Приложение № 3
Эталоны ответов на ситуационные задачи
№ 1.
1. При определении концентрации раствора с превышенным содержанием вещества применяют расчет по формуле:
Х =  = 100 мл воды очищенной.
= 100 мл воды очищенной.
2. При разведении такого раствора объем концентрата кальция хлорида составляет 1100 мл.
3. В соответствии с требованиями приказа МЗ РФ 2015 г № 751н данная лекарственная форма подвергается полному химическому анализу, так как это концентрат.
4. Концентрацию 20% раствора целесообразно определять рефрактомет-рически, так как при титриметрическом анализе необходимо проводить разведение.
№ 2.
1. Количественное определение натрия сульфата проводят комплексонометрическим методом, так как концентрация вещества не превышает 4%.
2. Объем титранта и титр определяемого вещества рассчитываем по формуле:
TMgSO4 = 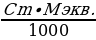
Объем титранта рассчитываем по формуле:
V = 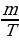
где: m – масса определяемого вещества в навеске, взятой на титрование;
Т – титр определяемого раствора.
3. Вывод о качестве лекарственной формы определяется расчетом норм отклонения (приказ МЗ РФ 2015 г. № 751н – приложение 3, таблица 4)
Для 4,0 они составляют ± 4%
4,0 – 100%
Х – 4% Х = 0,16
Это значит, что количество магния сульфата может составлять от 3,84 до 4,16.
Вывод: лекарственная форма удовлетворительного качества.
№ 3. В рецепте должен быть выписан раствор магния сульфата для внутрен-него применения, так как сульфаты цинка на поверхности слизистой образуют нерастворимые альбуминаты.
Сульфаты кальция не растворяются в воде, поэтому внутрь применяться не могут. Сульфат бария как нерастворимая соль бария, может применяться внутрь, но не в такой дозировке (50 г на 1 прием).
№ 4. При определении количественного содержания магния сульфата в лекарственной форме по приказу 2015 года № 751н допустимая норма отклонения составляет ± 5%.
Это означает, что количество магния сульфата допустимо в пределах от 1,9 г до 2,1 г. Поэтому при определении количественного содержания магния сульфата в лекарственной форме (1,98 г) можно сделать вывод, что лекарствен-ная форма удовлетворительного качества.
№ 5.
В состав присыпок при гипергидрозе стоп может входить только цинка оксид, так как он обладает подсушивающим, вяжущим действием.
Кроме того присыпка – это недозированная лекарственная форма. Цинка сульфат – сильнодействующее вещество (список Б). Лекарственные формы этой группы не могут входить в состав недозированных лекарственных форм.
№ 6.
1. Приказ Министерства здравоохранения Российской Федерации от 26.10.2015 г. № 751н «Об утверждении правил изготовления и отпуска лекарст-венных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевти-ческую деятельность» приложение 3, таблица № 7 «Допустимые отклонения в общей массе мазей» – прописанная масса, грамм: от 10 до 20, отклонения, %: ±8.
2. Согласно приказу Министерства здравоохранения Российской Федерации от 26.10.2015 г. № 751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность» – 10 суток.
3. Общая масса по прописи составляет 15 г. Допустимые отклонения ± 8%.
15,0 – 100%
Х – 8% Х – 1,2
Допускается масса в пределах от 13,8 г до 16,2 г.
По результатам физического контроля лекарственная форма удовлетворительного качества.
№ 7.
Общая масса по прописи составляет 36,0. Допустимые отклонения ± 5%.
36,0 – 100%
Х – 5% Х = 1,8.
Допускается масса в пределах от 34,2 г до 37,8 г. По результатам физического контроля лекарственная форма удовлетворительного качества.
Приложение 4.
Допустимые отклонения в массе навески отдельных лекарственных средств в жидких лекарственных формах при изготовлении массо-объемным методом
| Прописанная масса, г | Отклонения, % |
| До 0,02 | ± 20 |
| Свыше 0,02 до 0,1 | ± 15 |
| Свыше 0,1 до 0,2 | ± 10 |
| Свыше 0,2 до 0,5 | ± 8 |
| Свыше 0,5 до 0,8 | ± 7 |
| Свыше 0,8 до 1 | ± 6 |
| Свыше 1 до 2 | ± 5 |
| Свыше 2 до 5 | ± 4 |
| Свыше 5 | ± 3 |
Примечание: Отклонения, допустимые в массе навески отдельных лекарственных средств в жидких лекарственных формах при изготовлении способом по массе или массо-объемным способом, а также в мазях, определяются не на концентрацию в процентах, а на массу навески каждого лекарственного средства, входящего в эти лекарственные формы.
Например, при изготовлении 10 мл 2% раствора пилокарпина гидрохлорида масса навески должна составлять 0,2 г, для которой допускается отклонение ± 10%. При анализе достаточно установить, что было взято не менее 0,18 г и не более 0,22 г пилокарпина гидрохлорида.
Периодическая система химических элементов
Приложение 6
Журнал регистрации результатов органолептического, физического и химического контроля внутриаптечной заготовки, лекарственных форм, изготовленных по индивидуальным рецептам (требованиям лечебных организаций), концентратов,
тритураций, спирта этилового и фасовки
| Дата заполне- ния и контроля | № п/п (анализа) | № рецепта | № серии или заказа | Состав лекарственного средства или определяемое вещество (ион) | Результаты контроля | Фамилия изготовив-шего, расфасо-вавшего | Подпись проверив-шего | Заключение (уд. или неуд) | ||
| физического и органолеп-тического | качествен-ного (+) или (–) | полного химиче-ского (определе-ние подлинности, формулы расчета, плотность, показатель преломления и т.д.) | ||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Приложение 7.
АЛГОРИТМ
КОНТРОЛЯ КАЧЕСТВА ЛЕКАРСТВЕННОЙ ФОРМЫ
1. Содержание рецепта. Назначение лекарств.
2. Совместимость ингредиентов в лекарственной форме.
3. Требования действующей инструкции по контролю качества лекарств.
4. Письменный, физический, органолептический виды контроля.
5. Химический контроль:
5.1. Качественный экспресс-анализ (химизм, аналитический эффект, методика выполнения реакций).
5.2. Количественный экспресс-анализ (определение метода, его обоснование, химизм, техника выполнения, расчет массовой части вещества).
6. Расчет фактического и допустимого отклонений.
7. Вывод о качестве приготовления (изготовления) лекарственной формы.
8. Документальное оформление результатов контроля.













