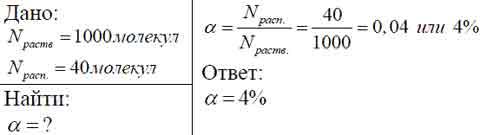Государственное бюджетное профессиональное образовательное учреждение
Московской области
«Московский областной медицинский колледж №1»
Наро - Фоминский филиал
Специальность: 34.02.01 «Сестринское дело»
Цикловая методическая комиссия
Общеобразовательных, гуманитарных и естественнонаучных дисциплин
Химия
I курс
Методическая разработка
практического занятия №16
(для студентов)
по теме
«Гидролиз как обменный процесс . Реакции в растворах электролитов.
2020 год
Специальность: 34.02.01 «Сестринское дело»
Разработчик: преподаватель – Чернышова Н.И..
ГБПОУ МО «Московский областной медицинский колледж № 1» Наро – Фоминский филиал
| Рассмотрено и утверждено на заседании ЦМК общеобразовательных, гуманитарных и естественнонаучных дисциплин
Протокол № от « » 2020 г. Председатель ЦМК ___________________ Чернышова Н.И.
| Согласовано Зам. директора по УР
« » _____________ 2020 год
______________________________ Шабарова М. Н.
|
Методическое пособие разработано в соответствии с требованиями Федерального государственного образовательного стандарта среднего профессионального образования (ФГОС СПО) по специальности 34.02.01 Сестринское дело и предназначено для преподавателя для проведения практического занятия «Гидролиз как обменный процесс.» по учебной дисциплине «Химия».
ОГЛАВЛЕНИЕ
| №/№ | Наименование | Страницы |
| 1 | Пояснительная записка | 3 |
|
| Введение |
|
| 2 | План занятия | 6 |
| 3 | Опорный конспект хода занятия. | 6-9
|
| 4 | Вводная часть.Актуализация знаний. Фронтальная беседа по вопросам. | 6-7 |
| 5 | Самостоятельная работа студентов. | 8-9 |
| 6 | Лабораторная работа .Оформление результатов работы. | 10 |
| 7 | Контроль усвоения изучаемого материала. Тест по теме: «Электролитическая диссоциация» (приложение № 3).
| 11-13 |
| 8 | Подведение итогов занятия.
| 9 |
| 9 | Задание для внеаудиторной самостоятельной работы и домашнее задание | 9 |
| 10 |
Приложение № 1
| 10 |
| 11 | Пиложение№2 | 11 |
| 12 | Пиложение№3 | 12 |
| 13 | Пиложение№4 Контрольно – тестовая часть | 13-20 |
| 14 | Эталоны ответов | 21 |
| 15 | Список использованной литературы | 22 |
Пояснительная записка
Методическое пособие рекомендовано для студентов при проведении практических занятий и контроля текущего уровня знаний по дисциплине «Химия» Специальность: 34.02.01 «Сестринское дело».
Введение
Данная методическая разработка занятия по теме «Гидролиз солей. Реакции в растворах солей.» продолжает изучение закономерностей протекания химических реакций, смещения равновесия обратимых процессов и является одним из существенных вопросов теории растворов.
Процессы гидролиза происходят в любых живых системах, антропогенных комплексов.
При изучении данной темы студентам важно научиться в процессе решения соответствующих задач и тестов умению объяснять сущность гидролиза солей, записывать краткие и полные ионные уравнения реакций гидролиза, объяснять изменение кислотности среды и образование кислых или основных солей в этом процессе. Также важно узнать о практическом значении гидролиза не только солей, но и других соединений. Особо интересен гидролиз в медицине. Умение экспериментально подтверждать основные случаи гидролиза солей также является одним из ведущих умений при изучении химии как науки.
Предлагаемое пособие содержит теоретический, экспериментальный и контрольно-оценочный блоки, что отвечает принципу системности в изучении темы «Растворы»
Цели занятия:
Обучающая: Закрепить у студентов знания теории электролитической
диссоциации, умение разделять вещества на электролиты и не электролиты,
определять характер среды по окраске индикатора.
Сформировать знания о
гидролизе, как особом свойстве солей. Доказать влияние состава соли на
направление реакции, и привести учащихся к выводу о смещении равновесия
диссоциации молекул воды, за счет связывания одного из ее ионов ионами
соли.
Сформировать умение по составу соли (ее природе) прогнозировать
реакцию среды.
Развивающая: На примере свойств солей, различной природы, их отношение к воде, продолжить развитие умений наблюдать, сравнивать изучаемые явления, выявлять причинно – следственные связи, делать соответствующие выводы.
Воспитывающая: Через проблемный метод обучения раскрыть перед студентами научный путь познания через доказательство гипотезы, способствовать переходу знаний в убеждения. Посредством эксперимента привить навыки трудолюбия, бережного отношения к реактивам, к природе, эстетические качества
-формирование ПК:
ПК 2.1. Представлять информацию в понятном для пациента виде, объяснять ему суть вмешательств.
-формирование ОК:
Понимать сущность и социальную значимость будущей профессии, проявлять к ней устойчивый интерес.
Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество.
Принимать решения в стандартных и нестандартных ситуациях, нести за них ответственность.
Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития.
Использовать информационно-коммуникационные технологии в профессиональной деятельности.
Работать в коллективе и команде, эффективно общаться с коллегами, руководством, потребителями.
Брать на себя ответственность за работу членов команды (подчиненных), результата выполнения задания.
Ориентироваться в условиях частой смены технологий в профессиональной деятельности.
Бережно относиться к историческому наследию и культурным традициям народа. Уважать социальные, культурные и религиозные различия.
Быть готовым брать на себя нравственные обязательства по отношению к природе, обществу и человека.
Организовывать рабочее место с соблюдением требований охраны труда, производственной санитарии, инфекционной и противопожарной безопасности.
Вести здоровый образ жизни, заниматься физической культурой и спортом для укрепления здоровья, достижения жизненных и профессиональных целей.
Методы обучения: диалогическое изложение, беседа, объяснение, химический эксперимент.
Приемы обучения: постановка и решение учебных проблем, раскрытие причинно-следственных связей, организация наблюдений, сравнения, использование алгоритмов.
Средства обучения: причинно-следственные связи, оборудование и реактивы для эксперимента, таблицы, алгоритмы.
Задачи:
научить студентов пользоваться опорными знаниями, составлять конспект урока;
углубить их знание свойств солей
научить учащихся определять характер среды растворов солей по их составу, составлять ионные уравнения реакций гидролиза значения гидролиза в природе и жизни человека;
вызвать интерес к предмету, развивать умение логически рассуждать, грамотно выражать свои мысли;
Закрепить практический опыт по проведению практического эксперимента по изучению условий протекания реакций ионного обмена до конца и определения реакции среды растворов солей при гидролизе;
Закрепить практический опыт обращаться с лабораторным оборудованием и посудой; проводить наблюдения, делать выводы;
Закрепить практический опыт по соблюдению правил по технике безопасности при работе в химическом кабинете.
закрепить умения и навыки химического эксперимента, умение работать с таблицами, справочным материалом, дополнительной литературой.
Тип занятия: практическое занятие
Вид занятия: проблемно-исследовательский.
Учения: эвристическая беседа, лабораторные опыты.
Дидактическое оснащение урока:
Мультимедиа проектор
Презентация к уроку в программе MS PowerPoint.
Таблица растворимости, таблица рН среды
Оборудование для эксперимента: штатив с пробирками, растворы лакмуса и фенолфталеина, растворы солей; хлорида натрия, карбоната натрия, хлорида аммония. Для лабораторной работы: растворы следующих солей: KCl; K2S; AlCl3.
Реактивы: растворы HCl, CuSО4, NaOH, FeСl3 Na2CО3, NaCl, индикаторы фенолфталеин и метилоранж, раствор H2SO4, кристаллический карбонат натрия.
Раздаточный материал:
Методическая разработка практического занятия для студентов, таблицы, алгоритмы, тестовое задание.
Место проведения:
Кабинет
Тема: « Гидролиз солей. Реакции в растворах электролитов.»
Продолжительность занятия - 180 м
План занятия:
Вводная часть – 15 минут
Организационный момент-2 мин.
1.2. Актуализация знаний-3 мин.
1.3. Контроль исходного уровня знаний- 10 мин.
2. Основная часть – 120 минут
2.1 Самостоятельная работа студентов – 30 мин.
2.2. Решение задач по теме –20 мин.
2.3. Самостоятельная работа студентов по изучению изучению условий протекания реакций ионного обмена до конца и определения реакции среды растворов солей при гидролизе (лабораторная работа) – 70 мин.
3. Заключительная часть – 45 минут
3.1 Письменная работа студентов – 30 мин.
3.2. Подведение итогов – 10 мин.
3.3. Домашнее задание – 5 мин.
 Опорный конспект хода занятия
Опорный конспект хода занятия
1. Вводная часть
Откройте тетради и запишите тему и цель занятия.
Актуализация знаний.
Прослушайте, выделите и запишите главную мысль.
Электролиты являются составной частью жидкостей и плотных тканей живых организмов. Ионы натрия, калия, кальция, магния, водорода, анионы ОН-, Сl-, SO42-, НСО3- имеют большое значение для физиологических и биохимических процессов. Водородные ионы способствуют нормальному функционированию ферментов, обмену веществ, перевариванию пищи. Ионы натрия и хлорид - ионы в наш организм попадают при использовании в пищу поваренную соль. В медицине применяется 0,85% раствор хлорида натрия в качестве физиологического раствора при большой потере жидкости организмом.
Многие химические реакции протекают в водных растворах. Знания свойств, присущих электролитам в растворах, а также представление об электронном строении атомов и молекул позволяет по - новому рассматривать свойства оснований, кислот, солей.
1.2. Ответьте устно на вопросы:
Какие вещества называют электролитами, какие неэлектролитами? Приведите примеры известных вам электролитов и неэлектролитов.
Какие электролиты относятся к настоящим электролитам, а какие – к потенциальным?
Сформулируйте основные положения теории электролитической диссоциации С. Аррениуса?
Какие электролиты называют сильными, а какие - слабыми?
Что такое кислоты, основания и соли (нормальные, кислые) с точки зрения теории электролитической диссоциации?
Какие реакции называются ионными? Какими уравнениями они выражаются?
В каких случаях реакции обмена между электролитами в водных растворах необратимы, в каких обратимы?
Какие вещества называются индикаторами? Какие индикаторы вы знаете?
Что показывает водородный показатель – рН? Как его определяют?
Что называется гидролизом солей? В чём его сущность?
Какие типы солей подвергаются гидролизу, какие соли не подвергаются гидролизу?
12. Для каких солей возможен необратимый гидролиз?
13. Какие факторы и как влияют на степень гидролиза?
2.Основная часть.
2.1. Самостоятельная работа студентов.
Выполните самостоятельно упражнения, используя приложения № 1- 2.
1. Напишите уравнения электролитической диссоциации:
а) сульфата железа (III); б) гидрокарбоната калия; в) ортофосфорной кислоты;
г) гидроксида кальция; д) гидроксохлорида меди (II); е) серной кислоты;
ж) гидроксида лития.
При диссоциации каких веществ образуется больше ионов?
2. Какие из приведенных реакций протекают до конца? Составьте молекулярные и ионные уравнения реакций, протекающих до конца между:
а) хлоридом магния и сульфатом калия;
б) карбонатом кальция и азотной кислотой;
в) серной кислотой и гидроксидом аммония;
г) нитратом серебра и соляной кислотой.
Определите суммы коэффициентов в сокращенных ионных уравнениях.
3. Составьте в молекулярной форме уравнения реакций, которым соответствуют следующие ионно - молекулярные уравнения:
а) СО32- + 2Н+ → Н2О + СО2↑
б) 3Са2+ + 2РО43- → Са3(РО4)2↓
в) ОН- + Н+ → Н2О
г) Ва2+ + SО42- → BaSО4↓
Могут ли в растворе одновременно находиться следующие пары веществ:
а) гидроксид натрия и хлорид бария;
б) гидроксид кальция и углекислый газ;
в) сульфат калия и гидроксид бария;
г) гидрокарбонат натрия и серная кислота;
д) соляная кислота и нитрат алюминия?
5. Какие из перечисленных солей подвергаются гидролизу? Составьте уравнения гидролиза в ионной и молекулярной форме и определите реакцию среды растворов солей, которые гидролизуются:
BaSO4, K2СO3, MgSO4, (NH4)2CO3, AgCl, NaNO3, Fe2S3, CaCl2, Zn(NO3)2, CuCO3, Ba(NO3)2, Na2SO3, AlCl3
2.2. Решение задач.
Решите задачи на вычисление степени диссоциации и числа продиссоциированных молекул в растворе.
Первую задачу решаем на доске, совместно с преподавателем, остальные самостоятельно.
Задача 1.
Из каждой тысячи молекул электролита, растворенного в воде, 40 распалось на ионы. Определите степень диссоциации электролита.
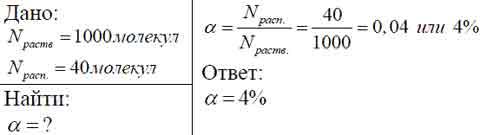
Задача 2.
Степень диссоциации электролита равна 60%. Сколько молекул этого вещества из каждого десятка распадается на ионы?
Задача 3.
Из каждых 500 молекул электролита 8 распадаются на ионы. Чему равна степень диссоциации этого электролита? К электролитам какого типа (сильных или слабых) его можно отнести?
2.3. Лабораторная работа.
Самостоятельная работа студентов по отработке навыков
проводения практического эксперимент по изучению условий протекания реакций ионного обмена до конца и определения реакции среды растворов солей при гидролизе
Перед выполнением лабораторной работы повторите правила техники безопасности при работе в химической лаборатории.
Проделайте опыты, руководствуясь методическими указаниями лабораторной работы (приложение № 1). Оформите отчет о проделанной работе.
Заключительная часть.
Контроль усвоения изучаемого материала.
Выполните тест по теме: «Электролитическая диссоциация» (приложение № 4).
Подведение итогов занятия.
Работа студентов на занятии оценивается по критериям:
Теоретическая подготовка по данной теме.
Качество и аккуратность выполнения опытов.
Умение работать с лабораторным оборудованием.
Домашнее задание:
О.Е.Саенко Химия с.80-85 изучить текст. Выполнить задания с.84№ 9,10(а-в)
Доклады на темы:
« Теория электролитической диссоциации»;
«Электролиты и неэлектролиты, их значение и применение в технике, быту»;
«Вода – слабый электролит. Понятие о рН растворов»;
«Гидролиз солей как один из видов реакций обмена. Типы гидролиза и факторы, влияющие на степень гидролиза».
Приложение № 1
Лабораторная работа
Тема «Реакции в растворах электролитов. Гидролиз солей».
Цель работы: практически изучить условия протекания реакций ионного обмена идущие до конца, исследовать процесс гидролиза солей.
Реактивы: растворы HCl, CuSО4, NaOH, FeСl3 Na2CО3, NaCl, индикаторы фенолфталеин и метилоранж, раствор H2SO4, кристаллический карбонат натрия.
Ход работы:
Опыт 1. Реакции, идущие до конца за счет образования осадка.
В пробирку налейте 2 - 3 мл раствора сульфата меди (II) и прибавьте понемногу раствора щелочи – гидроксида натрия. В пробирке образуется осадок гидроксида меди (II). Каков его цвет?
Напишите молекулярное и ионное (полное и сокращенное) уравнения реакции.
Опыт 2. Реакции, идущие до конца за счет образования малодиссоциирующего вещества.
Налейте в пробирку 2 -3 мл раствора щелочи. Прибавьте 1 каплю фенолфталеина. Как изменился цвет раствора? К полученному раствору добавьте соляную кислоту до исчезновения окраски.
Напишите молекулярное, полное и сокращенное ионное уравнения реакции.
Опыт 3. Реакции, идущие до конца за счет образования газообразного вещества.
В пробирку внесите немного кристаллического карбоната натрия и добавьте соляной кислоты. Какой газ выделяется при этом?
Напишите молекулярное и полное и сокращенное ионное уравнения реакции.
Опыт 4. Определение среды растворов солей.
В пробирки налейте растворы солей хлорида железа (III), карбоната натрия и хлорида натрия объемом по 1 мл. Каждый раствор исследуйте индикатором метилоранжем. Что наблюдаете? Какова среда этих растворов? Дайте объяснение полученным результатам и напишите молекулярные и ионные уравнения реакций. По какому типу идет гидролиз каждой соли? Сделайте вывод.
Приложение № 2
Степень и константа электролитической диссоциации.
Сильные и слабые электролиты
Сильные электролиты — это такие электролиты для которых степень
диссоциации в водных растворах близка к 1 (100 %).
К сильным электролитам относятся:
1. практически все соли;
2. некоторые кислоты - НClO4, НС1O3, HNO3, H2SO4, HMnO4, Н2Сг2O7 , HI, HBr, НС1
3. щёлочи — LiOH; NaOH; KOH; CsOH; RbОН; Са(ОН)2, Sг(ОН)2, Ва(ОН)2
Слабые электролиты — это такие электролиты, для которых степень диссоциации водных растворах меньше 0,3 (30 %).
К слабым электролитам относятся:
1 . слабые кислоты – НClO2, НС1O, HNO2, H2SO3, H2CO3, H2SiO3, Н3PO4, Н3PO3,
НF, Н3ВО3, СН3СООН, H2S, HCN
2. слабые малорастворимые в воде основания и амфотерные гидроксиды - Fе(ОН)2,
Fе(ОН)3, Сu(ОН)2, РЬ(ОН)2, Al(OH)3, Cr(OH)3
3. вода — Н2O
В уравнениях электролитической диссоциации слабых электролитов ставят знак
обратимости, так как они диссоциируют не полностью:
HCN Н++ CN-
Приложение № 3
Алгоритм составления ионных уравнений
1. Напишем молекулярное уравнение реакции.
2. Составим полное ионное уравнение, записывая:
а) в виде ионов формулы сильных электролитов:
- сильных кислот,
- сильных оснований (щелочей),
- растворимых в воде солей;
б) в виде молекул формулы:
- слабых электролитов (Н2О, СН3СООН, NH4OH, H2SO3, H2CO3, H2S, HCN и др.),
- малорастворимых веществ (AgC1, Fe(OH)2, СаСО3 и т.д.),
- газообразных (летучих) веществ (CO2, H2S, NНз и др.),
- оксидов металлов и неметаллов (Na2O, СаО, Р2O5 и т.д.)
3. Сравнивая левую и правую части полного ионного уравнения, установим, какие ионы не участвуют в реакции (формулы этих ионов можно подчеркнуть).
4. Напишем сокращенное ионное уравнение, включив в него формулы только тех ионов и молекул, которое участвуют в реакции.
5. Если в сокращенном ионном уравнении коэффициенты перед ионами и молекулами имеют общий множитель, то их можно сократить на него.
При составлении ионных уравнений пользуются таблицей растворимости, по
которой определяют растворимость солей, оснований и кислот в воде. В уравнениях
реакций ставят знак ↓, если среди продуктов реакции есть осадок — нерастворимые или малорастворимые вещества. Знак ↑ показывает газообразные и летучие соединения.
Приложение № 4
Тест по теме: «Электролитическая диссоциация»
I вариант
Выбрать один правильный ответ
1. Распад электролита на ионы – это:
а) ассоциация; б) гидратация; в) диссоциация;
2. Сильный электролит – это:
а) H2S б) НСl в) Н2СО3 г) NH4OH
3. Схема диссоциации кислоты – это:
а) Ме(ОН)n → Меn+ + nОН-
б) HmR → mH+ + Rm-
в) MemRn → Men+ + Rm-
4. Анион — это:
а) Н+ б) S2- в) Na+ г) Mg2+
5. Группа веществ электролитов – это:
а) NaCl, NaOH ,Na2О
б) KCl, КОН, HCl
в) Н2, Н2О, HCl
6. Состояние вещества в растворе, если α=0
а) вещество полностью распалось на ионы
б) вещество частично распалось на ионы
в) диссоциация вещества отсутствует
7. Гидроксид - ионы образуются при диссоциации:
a) NH4Cl б) NaOH в) Cu(OH)2
8. Реакция, практически осуществимая до конца - это:
а) HNO3 + KCl =
б) BaCl2 + NH4NO3 =
в) AgNО3 + HCl =
9. Вещество, при диссоциации которого образуются катионы Na+ и Н+, а также анионы SO32- является:
а) кислотой; б) щелочью; в) средней солью; г) кислой солью
10. Установите соответствие:
Реагенты Уравнения
а) Ва(ОН)2 и Na2SО4 l.K+ + NО3- = KNO3
б) К2СО3 и HNО3 2.Ва2+ + SО42- = BaSО4
3. СОз2- + 2Н+ = СО2 + Н2O
11. Реакция, которая происходит при растворении гидроксида магния в серной кислоте, описывается сокращенным ионным уравнением:
а) Mg2+ + SО42- = MgSО4;
б) Н+ + ОН- = Н2О;
в) Mg(OH)2 + 2Н+ = Mg2+ + 2Н2O;
г) Mg(ОH)2 + SО42-= MgSО4 + 2OН-.
12. Группа формул сильных электролитов:
а) Н2О и H2SО4 б) Н2СОз и NH4OH
в) СаСОз и HNО3 г) НС1 и КОН
13. Ионы, которые могут одновременно находиться в растворе:
а) Ag+,NО3-,A13+,C1-, б) К+, Cl- , Ва2+, SO42-.
в) Na+, СО32- , NH4+, ОН-. г) Аl3+, NO3-, К+, I-
14. В каком растворе содержится больше всего ионов?
а) cульфат калия; б) гидроксид калия;
в) фосфорная кислота; г) соляная кислота.
15. Степень диссоциации не зависит от:
а) объема раствора; б) природы электролита;
в) температуры; г) концентрации.
16. Сокращенное ионное уравнение А13+ + ЗОН- = А1(ОН)з соответствует взаимодействию:
а) хлорида алюминия с водой;
б) хлорида алюминия с гидроксидом калия;
в) алюминия с водой;
г) алюминия с гидроксидом калия.
17. Электролит, который диссоциирует ступенчато, - это:
а) гидроксид магния; б) фосфорная кислота;
в) гидроксид калия; г) сульфат натрия.
18. Слабым электролитом является:
а) гидроксид бария; б) гидроксид алюминия;
в) плавиковая кислота; г) йодоводородная кислота.
19. Сумма коэффициентов в кратком ионном уравнении взаимодействия гидроксида бария и углекислого газа равна:
а) 6 б) 4 в) 7 г) 8
20. В растворе не могут находиться следующие пары веществ:
а) хлорид меди и гидроксид натрия;
б) хлорид калия и гидроксид натрия;
в) соляная кислота и гидроксид натрия;
г) серная кислота и нитрат натрия.
21. Формулы веществ, вступающих в реакцию друг с другом с образованием осадка:
а) СаСl2 и Na2CO3 б) H2SO4 и NaOH
в) MgCO3 и HNO3 г) КNOз и ВаСl2
22. Щелочная среда образуется в растворе каждого вещества из следующих пар солей:
a) NaCl и FeSО4 б) Ca(NО2)2 и Na2SО3
в) КС1 и СаС12 г) KNO3 и NH4C1
23. Формула соли, подвергающейся гидролизу по катиону:
а) А1(NO3)3 б) ВаСl2
в) СаВг2 г) К2СОз
24. Индикатор фенолфталеин в растворе соли Na2CO3 приобретает цвет:
а) синий б) красный
в) малиновый г) оранжевый
25. Гидролиз протекает при растворении в воде:
а) бромида кальция; б) фосфата кальция; в) нитрита кальция; г) сульфита кальция.
26. Гидролиз какой соли идет по аниону?
а) КС1 б) A12(SО4)3
в) NaNО3 г) Li2S
Тест по теме: «Электролитическая диссоциация»
II вариант
Выбрать один правильный ответ
1. Вещество, образующее при диссоциации катионы водорода и анионы кислотного остатка, - это:
а) соль б) вода в) кислота г) щелочь
2. Растворение веществ - это процесс:
а) физический б) физико - химический в) химический
3. Основоположником теории электролитической диссоциации является
а) А.Л. Ле - Шателье б) С.А. Аррениус в) А Авогадро
4. Состояние вещества в растворе, если α= 1
а) вещество полностью распалось на ионы
б) диссоциация вещества отсутствует
в) вещество частично распалось на ионы
5. Сильный электролит – это:
a) NaOH б) Сu(ОН)2 в) BaSO4 г) H2CO3
6. Схема диссоциации соли – это:
а) Ме(ОН)n → Меn+ + nОН-
б) HmR → mH+ + Rm-
в) MemRn → Men+ + Rm-
7. Электролиты – это:
а) KCl, NaOH, CuCl2
б) H2S, Н2, Н2О
в) Na2SО4, HCl, CuO
8. Реакция, практически осуществимая до конца, - это:
а) CuCl2 + ZnS =
б) KCl + HNO3 =
в) NaOH + К2СО3 =
9. Вещество, образующее при диссоциации сульфит - ионы, - это:
a) K2S б) K2SО3 в) K2SО4
10. Установите соответствие:
Реагенты Уравнения
а) H2S + CuCl2 = 1. Н+ + Сl- = HCl
б) Ва(ОН)2 + Na2SO4 = 2. S2- + Cu2+ = CuS
3.Ba2+ + SO42- = BaSO4
11. Взаимодействие карбоната бария с хлороводородной кислотой можно представить сокращенным ионным уравнением:
а) ВаСО3 + 2 Н+ → Ва2+ + СО2 + Н2О
б) Ва2+ + СОз2- + 2 Н+ + 2 Cl- → Ва2+ + СОз2- + 2 НСl↑
в) СОз2- + 2 Н+ → СO2↑ + Н2O
г) 2 Н+ + СОз2- → Н2СO3
12. Группа формул слабых электролитов:
а) Н2O и H2SO4 б) Н2СО3 и NH4OH
в) CaSO3 и HNO3 г) НСl и КОН.
13. Одновременно в растворе могут находиться ионы:
а) Ва2+, Cr3+, Cl-, SO42- б) Ca2+,Na+,F-,NО3-
в) Са2+, NH4+, Cl-, NO3- г) Fe3+, Na+, OH- , NO3-
14. В каком растворе содержится меньше всего ионов?
а) сульфат калия; б) гидроксид бария;
в) фосфорная кислота; г) соляная кислота.
15. Степень диссоциации зависит от:
а) объема раствора; б) природы электролита;
в) агрегатного состояния вещества; г) катализатора .
16. Сокращенное ионное уравнение Fe3+ + ЗОН- = Fe(OH)3 соответствует
взаимодействию:
а) хлорида железа с водой;
б) сульфат железа с гидроксидом калия;
в) оксид железа с водой;
г) железа с гидроксидом калия.
17. Электролит, который диссоциирует ступенчато, - это:
а) азотная кислота; б) фосфорная кислота;
в) гидроксид калия; г) сульфат натрия.
18. Сильным электролитом является:
а) гидроксид бария; б) гидроксид алюминия;
в) угольная кислота; г) сероводородная кислота.
19. Практически необратимо реакция обмена протекает между растворами:
а) Хлорида лития и серной кислоты.
б) Гидроксида калия и азотной кислоты.
в) Хлорида бария и азотной кислоты.
г) Сульфата цинка и хлорида калия.
20. Сумма коэффициентов в уравнении электролитической диссоциации нитрата меди (II) равна:
а) 3 б) 4 в) 5 г) 6.
21. Формулы веществ, вступающих в реакцию друг с другом с образованием газа:
а) СаСl2 и Na2CO3. б) H2SO4 и NaOH.
в) MgCO3 и HNO3 г) К2СО3 и ВаС12
22. Кислая реакция среды в водном растворе:
а) (NH4)2CO3; FeCl3 б) CuCl2; NaCl
в) Na2S; К2СО3 г) Fe(NО3)3; ZnSО4
23. Укажите пару солей, которые не подвергаются гидролизу:
а) А1С13 и SrSО4 б) КМnО4 и NH4NО3
в) ВаСl2 и KNO3 г) NaClO4 и KF
24. Гидролиз какой соли идет по катиону?
а) КС1 б) NaNО2
в) ВаВг2 г) ZnCl2
25. Гидролизу по аниону подвергается соль:
а) хлорид бария; б) нитрит калия; в) хлорид аммония; г) cульфат натрия.
26. Какая окраска будет у лакмуса в растворе соли К2SO3?
а) красная б) не окрашивается
в) синяя г) желтая
Тест по теме: «Электролитическая диссоциация»
III вариант
Выбрать один правильный ответ
1. Вещество, образующее при диссоциации катионы металла и анионы кислотного остатка, - это:
а) соль б) вода в) кислота г) щелочь
2. Сильный электролит – это:
а) H2SO4 б) Н2SO3 в) Н2СО3 г) H2S
3. Схема диссоциации кислой соли – это:
а) Ме(ОН)n → Меn+ + nОН-
б) HmR → mH+ + Rm-
в) MenHRn → Men+ + H+ + Rm-
4. Анион — это:
а) Н+ б) SО42- в) Na+ г) Са2+
5. Группа веществ электролитов – это:
а) CuCl2, Cu(OH)2 ,Cu2О
б) LiCl, LiОН, HCl
в) O2, Н2О, H2SO4
6. Состояние вещества в растворе, если α=0,2
а) вещество полностью распалось на ионы
б) вещество частично распалось на ионы
в) диссоциация вещества отсутствует
7. Гидроксид - ионы образуются при диссоциации:
a) NH4OH б) Al(OH)3 в) Cu(OH)2 г) Zn(OH)2
8. Реакция, практически осуществимая до конца - это:
а) HNO3 + KOH =
б) CaCl2 + NH4NO3 =
в) NaNО3 + HCl =
9. Вещество, при диссоциации которого образуются катионы Ca2+ и гидроксид – ионы OН- является:
а) кислотой; б) основанием; в) средней солью; г) кислой солью
10. Установите соответствие:
Реагенты Уравнения
а) Ca(ОН)2 и Na2CО3 l.Na+ + NО3- = NaNO3
б) Na2СО3 и HNО3 2.Cа2+ + CО32- = CaСО3
3. СО32- + 2Н+ = СО2 + Н2O
11. Реакция, которая происходит при растворении гидроксида цинка в соляной кислоте, описывается сокращенным ионным уравнением:
а) Zn2+ + Сl- = ZnCl2;
б) Н+ + ОН- = Н2О;
в) Zn(OH)2 + 2Н+ = Zn2+ + 2Н2O;
г) Zn(ОH)2 + 2Cl- = ZnCl2 + 2OН-.
12. Группа формул сильных электролитов:
а) Н2О и HCl б) Н2SОз и NH4OH
в) BаСОз и HNО3 г) H2SО4 и LiОН
13. Ионы, которые могут одновременно находиться в растворе:
а) Ag+,NО3-,Fe3+,C1-, б) Na+, Cl- , Ва2+, SO42-.
в) K+, СО32- , NH4+, ОН-. г) Аl3+, Cl-, К+, OH-
14. В каком растворе содержится больше всего ионов?
а) cульфат магния; б) гидроксид натрия;
в) серная кислота; г) азотная кислота.
15. Степень диссоциации не зависит от:
а) катализатора; б) природы электролита;
в) температуры; г) концентрации.
16. Сокращенное ионное уравнение Cu2+ + 2ОН- = Cu(ОН)2 соответствует взаимодействию:
а) хлорида меди с водой;
б) хлорида меди с гидроксидом натрия;
в) меди с водой;
г) меди с гидроксидом калия.
17. Электролит, который диссоциирует ступенчато, - это:
а) гидроксид железа (III); б) cернистая кислота;
в) гидроксид лития; г) сульфат рубидия.
18. Слабым электролитом является:
а) гидроксид кальция; б) гидроксид аммония;
в) соляная кислота; г) бромоводородная кислота.
19. Сумма коэффициентов в кратком ионном уравнении взаимодействия гидроксида натрия и серной кислоты равна:
а) 3 б) 4 в) 5 г) 8
20. В растворе не могут находиться следующие пары веществ:
а) нитрат кальция и гидроксид натрия;
б) хлорид натрия и гидроксид бария;
в) соляная кислота и сульфат калия;
г) серная кислота и хлорид бария.
21. Формулы веществ, вступающих в реакцию друг с другом с образованием воды:
а) СаСl2 и Na2CO3 б) H2SO4 и NaOH
в) MgSO4 и HNO3 г) КNOз и ВаСl2
22. Кислая среда образуется в растворе каждого вещества из следующих пар солей:
a) NaCl и ZnSО4 б) K2SO3 и Na2CО3
в) КС1 и BaС12 г) Zn(NО3)2 и NH4C1
23. Формула соли, подвергающейся гидролизу по катиону:
а) Fe(NO3)3 б) CаСl2
в) BаВг2 г) К2СОз
24. Индикатор фенолфталеин в растворе соли K2CO3 приобретает цвет:
а) синий б) красный
в) малиновый г) оранжевый
25. Гидролиз протекает при растворении в воде:
а) бромида натрия; б) карбоната кальция; в) нитрита калия г) сульфида магния.
26. Гидролиз какой соли идет по аниону?
а) FeС13 б) A12(SО4)3
в) Na2SО4 г) Li2SО3
Тест по теме: «Электролитическая диссоциация»
IV вариант
Выбрать один правильный ответ
1. Вещество, образующее при диссоциации катионы металла и гидроксид - ионы, - это:
а) соль б) вода в) кислота г) щелочь
2. Группа веществ неэлектролитов – это:
а) CuCl2, CuSO4 ,H2SO4
б) LiCl, LiОН, HCl
в) O2, Н2О, BaSO4
3. Катион — это:
а) S2- б) SО42- в) СО32- г) Ca2+
4. Состояние вещества в растворе, если α= 1
а) вещество полностью распалось на ионы
б) диссоциация вещества отсутствует
в) вещество частично распалось на ионы
5. Слабый электролит – это:
a) NaOH б) Сu(ОН)2 в) МgSO4 г) H2CO3
6. Схема диссоциации основания – это:
а) Ме(ОН)n → Меn+ + nОН-
б) HmR → mH+ + Rm-
в) MemRn → Men+ + Rm-
7. Нелектролиты – это:
а) ZnCl2, KOH, BaCl2
б) Cu(OН)2, Н2, Н2О
в) Na2SО3, HCl, H2SO4
8. Реакция, практически осуществимая до конца, - это:
а) NaCl + ZnS =
б) KCl + HNO3 =
в) KOH + Na2СО3 =
9. Вещество, образующее при диссоциации сульфат - ионы, - это:
a) K2S б) K2SО3 в) K2SО4 г) KHSO4
10. Установите соответствие:
Реагенты Уравнения
а) H2SО4 + ВаCl2 = 1. Cu2+ + SO42- = CuSO4
б) Сu(ОН)2 + H2SO4 = 2. Cu(OH)2 + 2H+ = Cu2+ + 2H2O
3.Ba2+ + SO42- = BaSO4
11. Взаимодействие карбоната кальция с соляной кислотой можно представить сокращенным ионным уравнением:
а) СаСО3 + 2Н+ → Са2+ + СО2 + Н2О
б) Са2+ + СОз2- + 2 Н+ + 2 Cl- → Са2+ + СОз2- + 2 НСl↑
в) СОз2- + 2 Н+ → СO2↑ + Н2O
г) 2 Н+ + СОз2- → Н2СO3
12. Группа формул сильных электролитов:
а) Н2O и H2SO4 б) Н2СО3 и NH4OH
в) Ca(ОН)2 и HNO3 г) Н2S и КОН.
13. Одновременно в растворе могут находиться ионы:
а) Ва2+, Cr3+, Cl-, NO3- б) Аl3+,Na+,PO43-,NО3-
в) Ag+, NH4+, Cl-, NO3- г) Fe3+, K+, OH- , NO3-
14. В каком растворе содержится меньше всего ионов?
а) сульфат калия; б) гидроксид натрия;
в) фосфорная кислота; г) серная кислота.
15. Степень диссоциации зависит от:
а) объема раствора; б) температуры;
в) агрегатного состояния вещества; г) катализатора
16. Сокращенное ионное уравнение Zn2++ 2ОН- = Zn(OH)2 соответствует
взаимодействию:
а) хлорида цинка с водой;
б) сульфата цинка с гидроксидом натрия;
в) оксида цинка с водой;
г) цинка с гидроксидом калия.
17. Электролит, который диссоциирует ступенчато, - это:
а) азотная кислота; б) гидрокарбонат кальция;
в) гидроксид калия; г) сульфат натрия.
18. Слабым электролитом является:
а) гидроксид калия; б) гидроксид бария;
в) сернистая кислота; г) серная кислота.
19. Практически необратимо реакция обмена протекает между растворами:
а) Хлорида натрия и азотной кислоты.
б) Хлорида бария и серной кислоты.
в) Хлорида бария и азотной кислоты.
г) Сульфата цинка и хлорида калия.
20. Сумма коэффициентов в уравнении электролитической диссоциации сульфата железа (III) равна:
а) 3 б) 4 в) 5 г) 6.
21. Формулы веществ, вступающих в реакцию друг с другом с образованием осадка:
а) СаСl2 и Na2CO3. б) H2SO4 и NaOH.
в) MgCO3 и HNO3 г) К2СО3 и LiС1
22. Кислая реакция среды в водном растворе:
а) (NH4)2CO3; AlCl3 б) CuCl2; NaCl
в) Na2SO4; К2СО3 г) Fe(NО3)3; MgSО4
23. Укажите пару солей, которые не подвергаются гидролизу:
а) А1С13 и SrSО4 б) К2SО4 и NH4NО3
в) ВаSO4 и NaNO3 г) NaCl и K2CO3
24. Гидролиз какой соли идет по катиону?
а) КС1 б) NaNО2
в) ZnCl2 г) K2CO3
25. Гидролизу по аниону подвергается соль:
а) хлорид кальция; б) сульфит калия; в) хлорид аммония; г) cульфат натрия.
26. Какая окраска будет у метилоранжа в растворе соли Аl2 (SO4)3?
а) красная б) не окрашивается
в) розовая г) желтая
Эталон ответов к тесту: «Электролитическая диссоциация»
| № | Вариант 1 | Вариант 2 | Вариант 3 | Вариант 4 |
| 1 | в | в | а | г |
| 2 | б | б | а | в |
| 3 | б | б | в | г |
| 4 | б | а | б | а |
| 5 | б | а | б | г |
| 6 | в | в | б | а |
| 7 | б | а | а | б |
| 8 | в | а | а | в |
| 9 | г | б | б | в |
| 10 | а-2, б-3 | а-2, б-3 | а-2,б-3 | а-3,б-2 |
| 11 | в | а | в | а |
| 12 | г | б | г | в |
| 13 | г | в | в | а |
| 14 | в | г | в | б |
| 15 | а | б | а | б |
| 16 | б | б | б | б |
| 17 | б | б | б | б |
| 18 | в | а | б | в |
| 19 | а | б | а | б |
| 20 | а | б | г | г |
| 21 | а | в | б | а |
| 22 | б | г | г | г |
| 23 | а | в | а | в |
| 24 | в | г | в | в |
| 25 | в | б | в | б |
| 26 | г | в | г | в |
Литература
Основная:
Саенко О.Е. Химия: учебник для колледжей:общеобразрвательная подготовка/ О.Е. Саенко.- Ростов н/Д: Феникс,2018
Дополнительная:
1. Габриелян О.С., Остроумов И.Г., Введенская А.Г. Общая химия в тестах, задачах и упражнениях. – М., 2003.
2. Учебник Г. М. Чернобельская, И. И. Чертков «Химия»; М; «Медицина», 1991
3.Ю.М. Ерохин «Химия», Издательство «Мастерство»; 2003 г
4. Н. А. Тюкавкина «Органическая химия», М., издательство «Медицина», 1998
5. В. Г. Иванов, О. Н. Гева «Практикум по органической химии», М., изд-во «Академия», 2000г
6. И. Г. Хомченко «Общая химия», сборник задач и упражнений, М., изд-во «Новая волна», 2001 г.
7. Кузьменко Н.Е., Еремин В.В., Попков В.А. Краткий курс химии. – М., 2000.
8. Пичугина Г.В. Химия и повседневная жизнь человека. – М., 2004.
9. Титова И.М. Химия и искусство: организатор-практикум для учащихся 10–11 классов общеобразовательных учреждений. – М., 2007.
10. Ерохин Ю.М., Фролов В.И. Сборник задач и упражнений по химии (с дидактическим материалом): учеб. пособие для студентов средн. проф. завед. – М., 2004.







 Опорный конспект хода занятия
Опорный конспект хода занятия