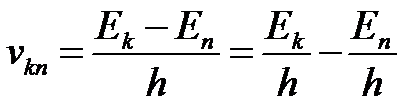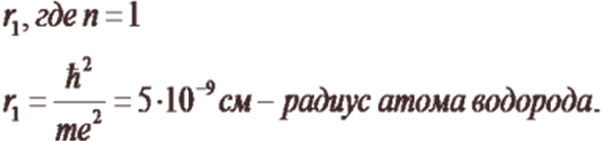11а - 11б –
Тема. Квантовые постулаты Бора. Модель атома водорода по Бору.
Цель урока: изучить квантовые постулаты Бора, модель атома водорода Бора, показать значение теории Бора в развитии физической науки.
Ход урока:
1. Организационный момент.
2. Проверка домашнего задания и актуализация изучаемой темы.
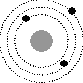
1. .На рисунке изображены схемы четырех атомов. Черными точками обозначены электроны. Атому  соответствует схема...
соответствует схема...
1
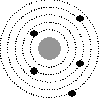
2
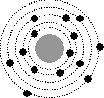
3

4
Ответ: 2.
Фронтальный опрос
– Какова была цель опыта Резерфорда? Опишите установку Резерфорда, ход эксперимента.
–Какие результаты получил Резерфорд?
- Какие выводы сделал Резерфорд из опыта?
-- Почему большинство ученых отрицательно отнеслись к модели атома Резерфорда?
3.Изучение нового материала
Постулаты Бора.
Первым решился на это признание выдающийся физик XX в. датский ученый Нильс Бор. В 1913 г. он с помощью гениальной интуиции сформулировал в виде постулатов основные положения новой теории.
Изучая противоречия модели атома Резерфорда и законами классической физики, Нильс Бор выдвигает постулаты, определяющие строение атома и условия испускания и поглощения им электромагнитного излучения.
Постулаты Бора показали, что атомы подчиняются законам микромира.
I постулат (постулат стационарных состояний).
Атомная система может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает энергию, при этом электроны в атомах движутся с ускорением.
Атом может находиться в стационарном состоянии сколь угодно долго.
Стационарные состояния отличаются друг от друга различными орбитами, по которым движутся электроны в атоме. Набор электронных орбит, по сути, определяет стационарные состояния электрона в атоме. Стационарные состояния можно пронумеровать, присвоив им порядковый номер n=1, 2, 3, ...,причем каждое состояние обладает своей фиксированной энергией Еn
II постулат (правило частот).
Излучение света происходит при переходе атома из стационарного состояния с большей энергией Ek в стационарное состояние с меньшей энергией En. Энергия излучённого фотона равна разности энергий стационарных состояний: 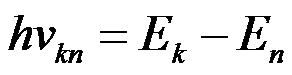
Отсюда можно выразить частоту излучения:
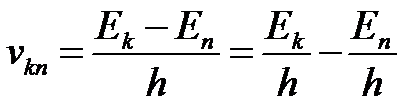
При поглощении света, атом переходит из стационарного состояния с меньшей энергией в стационарное состояние с большей энергией. При излучении атом переходит из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией.
Модель атома водорода по Бору
Используя законы механики Ньютона и правило квантования, на основе которого определяются возможные стационарные состояния атома. Бор смог вычислить радиусы орбит электрона и энергии стационарных состояний атома. Минимальный радиус орбиты определяет размеры атома.

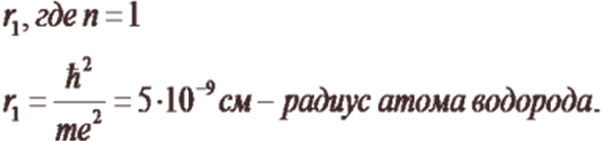
.
4.Закрепление нового материала
Тест на с. 288
А1) 3 А2) 2 А3) 3 А4) 2 А5) 2
Домашнее задание: § 75