Лысенко Ольга Александровна
учитель биологии и химии муниципального общеобразовательного учреждения
«Александровская школа Марьинского района» г. Донецка
lisenkooo@gmail.com
7 класс Урок химии Дата __________
Тема. Молярная масса.
Цели урока: научиться вычислять молярную массу; самовоспитание аккуратности в оформлении и записи задач; развивать умения применять знания на практике, развивать логическое мышление, умение анализировать условия химических задач, умение работать в должном темпе, организованность.
Ход урока:
Эпиграф урока: «Все на свете сбудется -
У того, кто трудится»
(русская пословица)
Актуализация знаний.
Ответьте устно на вопросы (постарайтесь не смотреть ответ: проверьте свои знания! Верьте в себя!):
Химические элементы, которые образуют в свободном состоянии простые вещества, не обладающие физическими и химическими свойствам металлов.
Аллотропия, свойство некоторых химических элементов, позволяющее им существовать в двух или больше различных физических формах.
Примеры аллотропных модификаций веществ: молекулярный кислород и озон; белый и желтый фосфор; графит и алмаз (углерод). Углерод может существовать в двух формах – графита и алмаза, которые известны как аллотропных модификаций углерода.
Химия - это наука о веществах, их свойствах и превращениях.
Относительная атомная масса элемента – это величина, показывающая, во сколько раз масса его атома больше 1/12 массы атома углерода. Относительная атомная масса обозначается: Ar
Как обозначается относительная молекулярная масса, как найти её значение?
Относительная молекулярная масса - это масса молекулы, соотнесенная к 1 а.е.м. Относительная молекулярная масса обозначается: Мr. Пример: Мr.(СО2)= Ar(С) + Ar (О)× 2= 12+ 16×2 = =12+32=44
Изучение нового материала
Задача:
Подумайте, в чём удобнее измерять вещества?
Давайте оставим пока химию и представим, что у нас есть куча картошки. Как нам удобнее пересчитать её? Конечно мешками.
В 1 мешке - 6 *1023 картофелин, а мешков 20 штук, тогда количество картошки мы найдём умножив количество мешков на количество картофелин в 1 мешке:
N = 20 мешков * 6 *1023 картофелин = 120 * 1023 картофелин
Для подсчёта количества вещества, пользуются не мешками, а такой единицей измерения как МОЛЬ. И в 1 моль вещества содержится 6 *1023 частиц этого вещества.
ЧТО ТАКОЕ МОЛЬ?
МОЛЬ - ЭТО ТАКОЕ КОЛИЧЕСТВО ВЕЩЕСТВА, В КОТОРОМ СОДЕРЖИТСЯ
6 * 1023 ЧАСТИЦ (молекул или атомов) ЭТОГО ВЕЩЕСТВА. (знать наизусть!)
Чему равно постоянная Авогадро?
Постоянная Авогадро
(Nа = 6 ·1023)
- число постоянное и названо в честь итальянского учёного Амедео Авогадро (знать наизусть!)
Как найти число молекул вещества в определённом количестве вещества ?
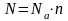 , где N - число молекул
, где N - число молекул
NA - постоянная Авогадро, молек./моль
n - количество вещества, моль
Следовательно, n = N / NA и NA = N / n
Что такое молярная масса?
МАССА 1 МОЛЬ ВЕЩЕСТВА НАЗЫВАЕТСЯ ЕГО МОЛЯРНОЙ МАССОЙ,
обозначается М и измеряется в г/моль. (знать наизусть!)
Т.е. чтобы отмерить 1 моль вещества нужно отмерить массу, равную его Ar или Mr .
1 моль Fe весит 56г a М(Fe) = 56 г/моль
1 моль S весит 32г a M(S) = 32 г/моль
1 моль Na Cl весит 59г a M(NaCl) = 59 г/моль
1 моль CuSO4 весит 160г a M(CuSO4) = 160 г/моль
ФИЗКУЛЬТМИНУТКА
«А теперь, ребята, встать,
Руки медленно поднять,
Пальцы сжать, потом разжать.
Руки вниз и так стоять.
Наклонитесь вправо-влево
И беритесь вновь за дело!»
Задача 1. Найти массу 24 * 1023 молекул озона.
| Дано | Формулы | Решение |
| О3 | m = M * n | n = 24 *1023/6 *1023 = 4 моль |
| N = 24 * 1023 молекул | n = N/NA | M(O3) = 48 г/моль |
| m = ? |
| m = 48 *4 = 192 г
|
Задача 2. Сколько молекул содержится в 111г гидроксида кальция Ca(OH)2?
| Дано | Формула | Решение |
| Ca(OH)2 | N = NA * n | M(Ca(OH)2) = 74 г/моль |
| m = 111г | n = m/M | n = 111/74 = 1,5 моль |
| N = ? |
| N = 6 *1023 *1,5 = 9 *1023молекул |
Самостоятельная работа:
работа с учебником: с. 122 (решить тестовые задания)
III. Домашнее задание: учить § 27, 28 (составить краткий конспект; правила – на изусть!), решить задачи:
№1 Рассчитайте количество вещества углекислого газа (СO2), если число его молекул равно 12,04·1023.
№ 2. Выполните соответствующие вычисления и заполните таблицу:
| m(H2SO4), г | M(H2SO4), г/моль | v(H2SO4), моль | v (H), моль | v (S), моль | v (O), моль | N(H2SO4) | N(H) | N(S) | N(O) |
| 49 |
|
|
|
|
|
|
|
|
|
Творческое задание: составить синквейн1 с одним из ключевых слов.
Примеры ключевых слов:
I синквейн - " вещество";
II синквейн - "масса";
III синквейн - "моль.
Благодарю за старание! Будьте ЗДОРОВЫ!
PS � Синквейн -"белый стих", состоящий из пяти слов. Правило составления синквейна: 1строка - заголовок, в который выносится ключевое слово, понятие, тема синквейна, выраженная в форме существительного; 2 строка -два прилагательных; 3 строка - три глагола; 4 строка - фраза, несущая определенный смысл; 5 строка -резюме, вывод: одно слово (обычно существительное).
1







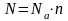 , где N - число молекул
, где N - число молекул

















