
Заявка для участия в конкурсе компьютерных презентаций « Взгляд »
kladznanyi.ru
Ф.И.О.
Токалова Наталья Валерьевна
Статус участника
Преподаватель химии, биологии и экологии, 1 категория
Страна/Регион/Населенный пункт
Россия, Свердловская область, город Лесной
Полное наименование учебного заведения
Министерство общего и профессионального образования Свердловской области ГАОУ СПО СО "Полипрофильный техникум им. О.В.Терешкина"
Контактные данные
с.т. 89193905431
Название работы
Урок по химии на тему «Теория электролитической диссоциации. Основные класс неорганических соединении в свете ТЭД»
(1 курс СПО)

Министерство общего и профессионального образования Свердловской области ГАОУ СПО СО "Полипрофильный техникум им. О.В.Терешкина"
Урок по химии на тему «Теория электролитической диссоциации. Основные класс неорганических соединении в свете ТЭД»
(1 курс СПО)
Преподаватель 1 категории
Токалова Наталья Валерьевна
г. Лесной
Тема урока «Теория электролитической диссоциации. Основные класс неорганических соединении в свете ТЭД»
Цели урока:
- Образовательная : обобщить, закрепить и совершенствовать знания студентов по данной теме
- Познавательная : определить глубину, прочность, осознанность полученных знаний, умение их применять, сравнивать, обобщать, логически мыслить, закреплять навыки работы с лабораторным оборудованием.
- Воспитательная : продолжить воспитывать чувство коллективизма, взаимопомощи, бережного отношение к оборудованию.
Методы: словесный, наглядный, частично – поисковый, практический.
Формы проведения занятия: слайд – урок
Формы организации деятельности студентов: индивидуальная, групповая, коллективная.
Средства:
- Слайды
- Таблицы: «Растворимость кислот, солей и оснований», «Электролитический ряд напряжения металлов»
- Лабораторное оборудование
Тип занятия: учебное занятие по проверке оценки и коррекции знаний , и способов деятельности.
Мотивация : самостоятельное выполнение заданий – самоконтроль – контроль – анализ
Оценка – коррекция – рефлексия
Хронокарта занятия
1. Организационный момент - 1 мин.
2. Мотивация занятий – 3 мин.
3. Проведение занятия – 36 мин.
4. Подведение итогов работы – 5 мин.

Электролитическая диссоциация

Эпиграф
«Вода, у тебя нет вкуса, ни цвета, ни запаха, тебя не возможно описать, тобой наслаждаются, не ведая, что ты такое! Нельзя сказать, что ты необходима для жизни, ты - сама жизнь!»


Береги воду!

Вода и химия

- Какие виды химической связи вам известны?
- Перечислите типы кристаллических решёток.
- Перечислите важнейшие классы неорганических веществ.
- Приведите примеры веществ с ионной и молекулярной решёткой.
- Что такое электрический ток?
- Что такое ионы?
- Какие ионы называют катионами, анионами?
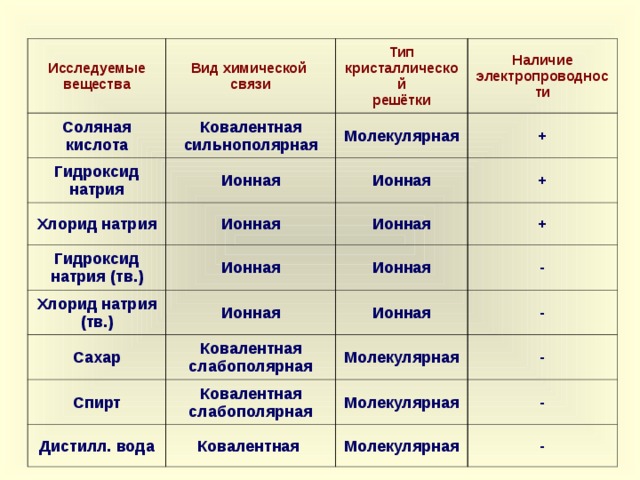
Исследуемые вещества
Вид химической
связи
Соляная кислота
Тип кристаллической
решётки
Гидроксид натрия
Ковалентная сильнополярная
Наличие электропроводности
Молекулярная
Ионная
Хлорид натрия
Ионная
+
Гидроксид натрия (тв.)
Ионная
Ионная
Ионная
+
Хлорид натрия (тв.)
Сахар
Ионная
+
Ионная
-
Ионная
Ковалентная слабополярная
Спирт
-
Молекулярная
Ковалентная слабополярная
Дистилл. вода
Ковалентная
-
Молекулярная
Молекулярная
-
-
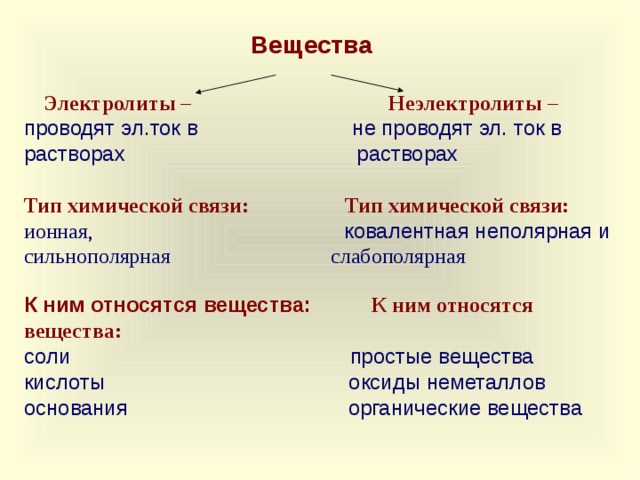
Вещества
Электролиты – Неэлектролиты –
проводят эл.ток в не проводят эл. ток в растворах растворах
Тип химической связи: Тип химической связи:
ионная, ковалентная неполярная и
сильнополярная слабополярная
К ним относятся вещества: К ним относятся вещества:
соли простые вещества
кислоты оксиды неметаллов
основания органические вещества

В 1887г. Шведский учёный
С.Аррениус для объяснения
особенностей водных растворов
веществ предложил теорию
электролитической диссоциации.
В дальнейшем эта теория была
развита многими учёными, в том
числе И.А. Каблуковым и
В.А. Кистяковским.
Аррениус Сванте (1859–1927)
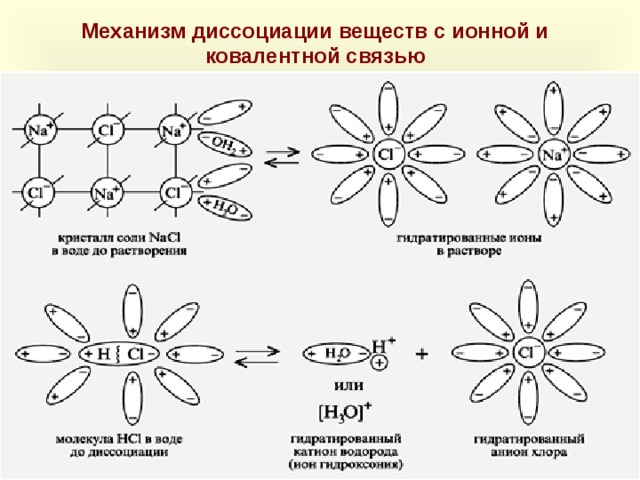
Механизм диссоциации веществ с ионной и ковалентной связью
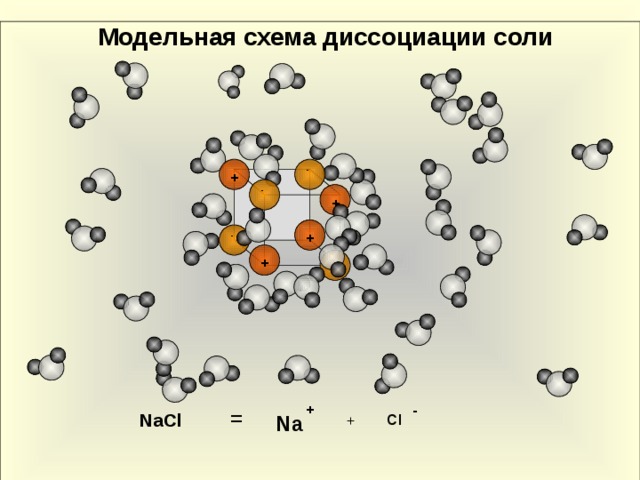
Модельная схема диссоциации соли
-
+
-
+
-
+
+
-
-
+
+
=
NaCl
Cl
Na

Задание
- Запишите сокращенные уравнения диссоциации предложенных веществ с ионным строением:
- Ba(OH)2; Na2SO4; K3PO4; Al2(SO4)3

Задание для 1 группы:
Впишите недостающие слова:
- Все вещества по их способности проводить электрический ток в растворах делятся на ______________ и ________________ .
Процесс распада электролита на ионы называется __________________ ______________.
В растворах электролиты диссоциируют на _______________ и ______________ ионы.
По степени электролитической диссоциации электролиты делятся на _________ и _______ .
2) Все соли – электролиты, CuSO 4 – ___________ .
Все растворимые основания – сильные электролиты,
NaOH – ___________________ .
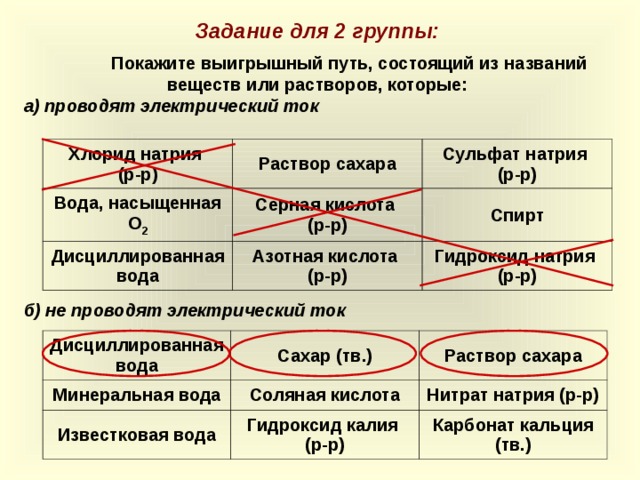
Задание для 2 группы:
Покажите выигрышный путь, состоящий из названий веществ или растворов, которые:
а) проводят электрический ток
Хлорид натрия
(р-р)
Раствор сахара
Вода, насыщенная O 2
Серная кислота
(р-р)
Дисциллированная вода
Сульфат натрия
(р-р)
Азотная кислота
(р-р)
Спирт
Гидроксид натрия
(р-р)
б) не проводят электрический ток
Дисциллированная вода
Минеральная вода
Сахар (тв.)
Раствор сахара
Известковая вода
Соляная кислота
Нитрат натрия (р-р)
Гидроксид калия
(р-р)
Карбонат кальция (тв.)
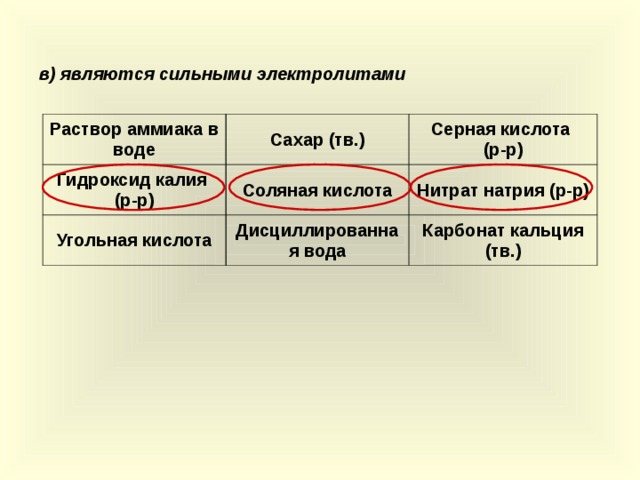
в) являются сильными электролитами
Раствор аммиака в воде
Сахар (тв.)
Гидроксид калия
(р-р)
Серная кислота
(р-р)
Соляная кислота
Угольная кислота
Дисциллированная вода
Нитрат натрия (р-р)
Карбонат кальция (тв.)

Задание для 3 группы:
Соотнесите:
1.
А) Электролиты 1) Кислоты
Б) Неэлектролиты 2) Оксиды
3) Простые вещества
4) Соли
5) Основания
2.
А) Сильные электролиты 1) Азотная кислот
Б) Слабые электролиты 2) Вода
3) Гидроксид натрия
4) Соляная кислота
5) Гидроксид алюминия
3.
Электролиты: Ионы в растворе электролита:
А) NaCl
Б) KOH
В) HNO 3
+
1) OH¯ 4) K
+
2) H 5) NO 3 ¯
–
+
3) Na 6)Cl

Подумай
- При каких условиях реакции ионного обмена идут до конца?

Задание
- Из предложенных уравнений выбрать реакции обмена:
- Na2SO4 + BaCL2 =
- Mg + HCL =
- Na2CO3 + HCL =
- Zn(OH)2 =
- KOH + HCL =
- SO3 + MgO =
- NaCL + KNO3 =

- Проделайте опыты и напишите уравнения химических реакций в молекулярном, полном ионном и сокращенном виде.

Итоговый контроль
I вариант
а) гидроксидом лития и азотной кислотой
б) карбонатом калия и серной кислотой
II вариант
а) сульфатом железа (II) и гидроксидом калия
б) сульфитом натрия и соляной кислотой

Домашнее задание
- Написать уравнение химических реакций в молекулярном, полном ионном и сокращенном виде:
- MgSO4 + Ba(NO3)2 =
- AgNO3 + HCL =
- H3PO4 + KOH =
- NaOH + Zn(NO3)2 =
- K2CO3 + H2SO4 =
- Cu(OH)2 + HCL =
- BaCL2 + Mg(NO3)2 =
- MgCL2 + Ba(NO3)2 =
- ALPO4 + NaOH =
- Ca(OH)2 + H2SO4 =

Транслит презентации
1 слайд – Титульный лист
2 слайд – План урока
3 слайд – Тема урока
4 слайд - Эпиграф
«Вода, у тебя нет вкуса, ни цвета, ни запаха, тебя невозможно описать, тобой наслаждаются, не ведая, что ты такое! Нельзя сказать, что ты необходима для жизни, ты сама – жизнь!»
5 слайд – Вода – самое распространенное богатство земного шара и величайший в мире химик. Без ее участия в мире не обходится ни один природный процесс, будь то образование новой горной породы, минерала или биохимическая реакция, протекающие в организме животных и растений.
6 слайд – Поэтому я хочу призвать Вас к бережному отношению к воде.
7 слайд – Для химиков в лаборатории вода является самым главным помощником. Чтобы заставить многие вещества вступать в реакцию, их прежде всего нужно перевести с помощью воды в раствор.
8 слайд – Какие виды химической связи Вам известны? Перечислите типы кристаллических решеток. Перечислите важнейшие классы неорганических соединений. Приведите примеры веществ с ионной и молекулярной решеткой. Что такое электрический ток? Что такое ионы? Какие ионы называются катионы, анионы?

9 слайд – Таблица с исследуемыми веществами: соляная кислота, гидроксид натрия, хлорид натрия, сахар, спирт, дистиллированная вода; типы кристаллических решеток, наличие электропроводности и химическая связь.
10 слайд – Схема классификации веществ на электролиты и неэлектролиты; тип химической связи; примеры.
11 слайд – Основоположник ТЭД Сванте Аррениус.
12 слайд – Механизм диссоциации веществ с ионной и ковалентной связью.
13 слайд – Модельная схема дессоциации соли хлорида натрия
NaCL = + Na + -CL + …..
14 слайд – Задание по написанию уравнений диссоциации предложенных веществ
15 слайд – Задание для группы 1
16 слайд – Задание для группы 2
17 слайд – Задание для группы 2
18 слайд – Задание для группы 3
19 слайд – При каких условиях реакции ионного обмена идут до конца
20 слайд – Из предложенных химических уравнений выбрать уравнение реакций обмена
21 слайд – Лабораторные опыты
22 слайд – Итоговый контроль
23 слайд – Домашнее задание
24 слайд – Спасибо за внимание

Литература
Габриелян О.С. Химия для преподавателя: учебно-методическое пособие / О.С. Габриелян, Г.Г. Лысова - М., 2010.
Габриелян О.С. Настольная книга учителя химии: 10 класс / О.С. Габриелян, И.Г. Остроумов - М., 2009.
Габриелян О.С. Настольная книга учителя химии: 11 класс: в 2 ч. / О.С. Габриелян, Г.Г. Лысова, А.Г. Введенская - М., 2009.
Кузнецова Н.Е. Обучение химии на основе межпредметной интеграции / Н.Е. Кузнецова, М.А. Шаталов. - М., 2004.
Чернобельская Г.М. Методика обучения химии в средней школе. - М., 2003.
Габриелян О.С. Лысова Г.Г. Химия для преподавателя: методическое пособие. - М., 20010.
http :// www . auk - olymp . ru / doc . v ? d =19 http :// courses . urc . ac . ru / eng / u 6-7. html
http :// courses . urc . ac . ru / eng / u 6-7. html
http :// www . ikt . ru









































