МЕТОДИЧЕСКАЯ РАЗРАБОТКА УРОКА
ПО ПРЕДМЕТУ «Физика и астрономия»
Тема: «Строение атома. Постулаты Бора.
Излучение и поглащение энергии атомом»
Содержание:
План урока:
Адресная категория
Цель урока
Описание ожидаемого результата
Фаза планирования и реализации
Анализ и оценка результатов урока
Пояснительная записка для обучающихся
Литература
Приложения
План урока
Адресная категория
Специальность: Хлебопекарное, макаронное и кондитерское производство
Курс, год обучения: 1 курс.
Учебная дисциплина: Физика и астрономия
Тема урока – «Строение атома. Постулаты Бора. Излучение и поглащение энергии атомом»
Тип урока: Урок изучения нового материала
Метод урока: Конструктивный, Графический органайзер, групповое исследование, листок выхода
Оборудование урока: Интерактивная доска, слайды по теме «Строение атома»,
конспект урока, карточки с заданиями, компьютер.
“ Отыщи всему начало, и ты многое поймёшь”.
Кузьма Прутков
1.2. Цели урока:
Обучающие цели:
- сформировать у обучающихся понятие атома, строение атома
- изучить постулаты Бора
- научиться находить структуру атома по таблице Менделеева
Развивающие цели:
- развивать умения применять имеющиеся знания на практике;
-развивать способности анализировать, делать выводы;
Воспитательные цели:
формировать познавательный интерес к физике;
формировать умение слушать своих товарищей, работать в коллективе; давать самооценку.
воспитание аккуратности и последовательности в действиях, чувство коллективизма, индивидуальности.
Описание ожидаемого результата.
Продукт деятельности:
По итогам урока обучающиеся должны:
- знать модели строения атомного ядра;
- уметь применять понятие атома и свойства при определений структуры химических элементов;
- уметь определять ядра атомов по представленной схеме;
Фаза планирования и реализации
Межпредметные связи:
Химия «Структура атома. Таблица Менделеева»
Биология «Структура ДНК»
Информатика «Программа создания презентации Power Point»
Экономика «Атомная энергетика в Казахстане»
Экология «Влияние атомной энергетики на окружающую среду»
Организационная форма:
Группа делится на микрогруппы по игре «Бодрячок», роли в микрогруппе обучающиеся распределяют самостоятельно.
Знания, умения обучающихся, необходимые для выполнения деятельности по теме занятия:
- Понятие атома. Модели атома, предложенные (Аристотелем, Демокритом, Томсоном, Резерфордом, Бором,)
- Структура атомного ядра.
- определение ядер атомов по представленной схеме;
- Влияние атомной энергетики
Возможности для интеграции умений трудоустройства и поиска работы:
данное занятие базовых технических умений по специальности, проводится так, чтобы способ организации деятельности обучающихся развивал такие умения трудоустройства и поиска работы, как:
- общение с людьми (умение говорить четко и ясно, слушать);
общение с целью определять и получать информацию, обобщать ключевые моменты, предоставлять информацию другим;
эффективно работать, как часть команды;
ясно и четко отвечать на вопросы;
планировать и применять действия, необходимые для выполнения задачи.
Материалы, учебно-методическая, справочная литература:
- Жданов Л.С, Жданов Г.Л, Физика М..Наука, 1984
- опорные конспекты;
- презентация, слайды;
- карточки с заданиями
- тестовые задания 16.1.-16.2
- С.Туякбаев, Ш.Насохова, Б.Кронгарт, В.Кем, Физика, учебник для 11кл.
Естественно- математического направления. Алматы. Изд-во Мектеп, 2007
Ход урока
Организационный момент- 1 мин.
Планирование деятельности обучающихся на уроке 2 мин.
определение целей урока совместно с обучающимися.
объяснение обучающимся задач урока, критериев оценки, о листке выхода
Уровень знаний оценивают сами обучающиеся
| ФИО |
Определение проблемы | Решение проблемы | Применение решения проблемы
| Листок выхода | Средний балл |
| Граф. органайзер презентация |
| Домашнее задание | Синквейн |
| Задание I | Задание II | Задание III | Презентация |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Проверка знаний по темам 16.1.-16.2.Фотоэффект.Уравнение Эйнштейна для фотоэффекта. Давление света. Химическое действие света
Для работы над тестовыми заданиями – 2 минуты, для проверки 2 минуты
1 вариант
1. Что такое фотоэффект?
а) Взаимодействия между электроном и нуклонами
б) упорядоченное движение заряженных частиц
в) явление вырывания электронов из вещества под действием света
г) зависимость скорости распространения волн в среде от их длины
2. С помощью какого прибора измеряется сила фототока?
а) миллиамперметром и гальванометром
б) магнитометром
в) динамометром
г) термометром
3. В каком году Эйнштейн объяснил законы фотоэффекта?
а) 1905г. б) 1906г. в) 1907г. г) 1908г.
4. Уравнение Эйнштейна..
а) 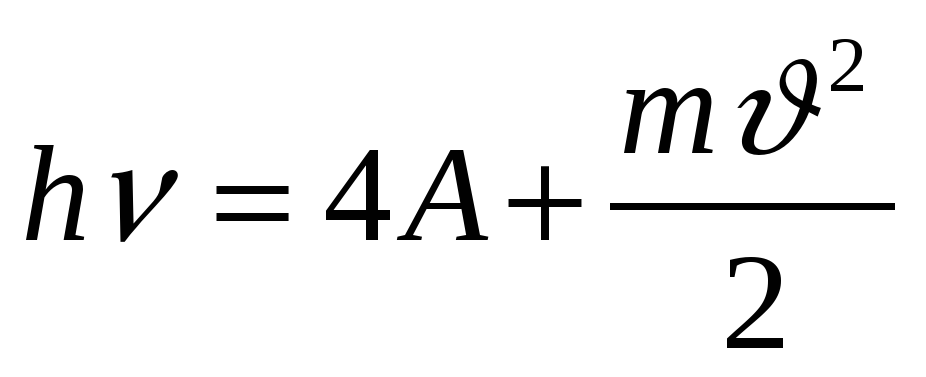 б)
б) 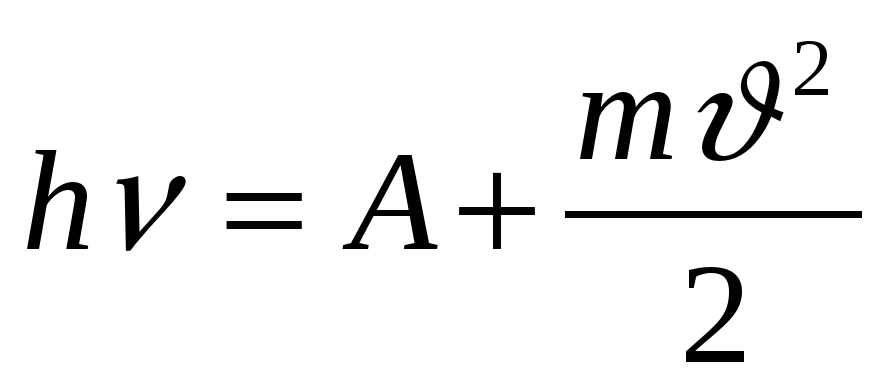 в)
в) 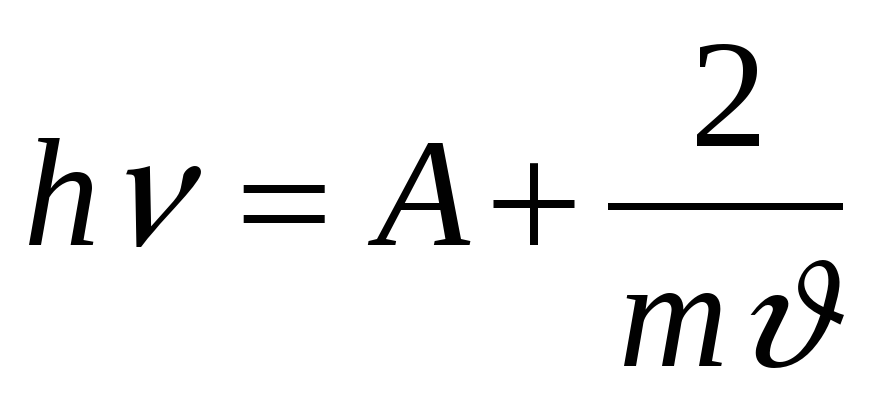
 г)
г) 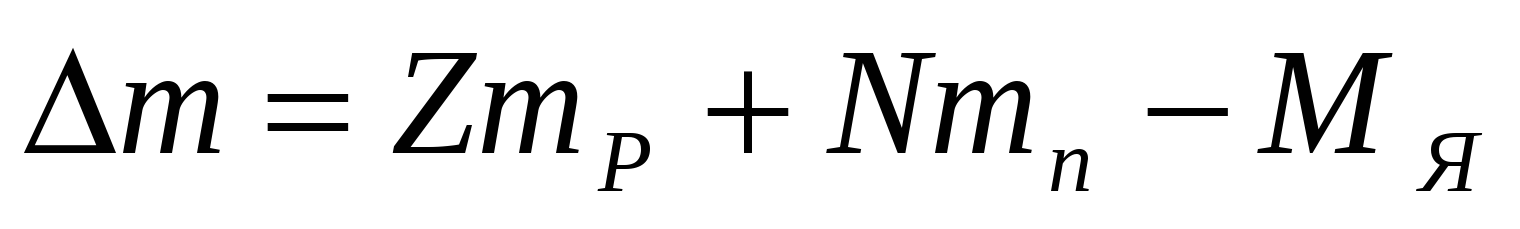
5. Фотохимические реакции- это…
а) химические реакции, протекающие под действием воздуха
б) разложение синего сложного цвета в спектр
в) явление превращения жидкости в пар
г) химические реакции, протекающие под действием света
2 вариант
1. Что называется красной линией фотоэффекта?
а) максимальное значение фотоэффекта
б) минимальное значение фотоэффекта
в) минимальная частота света, ниже которой фотоэффект не наблюдается
г) максимальная частота света, ниже которой фотоэффект не наблюдается
2. Давление, которое производят электромагнитные световые волны, падающие на поверхность какого-либо тела – это…
а) фототок
б) давление света
в) давление фотоэффекта
г) Электрический ток
3. В каком году русский ученый Лебедев измерил давление света на твердые тела?
а) 1900г.
б) 1901г.
в) 1902г.
г) 1903г.
4. Уравнение Эйнштейна..
а) 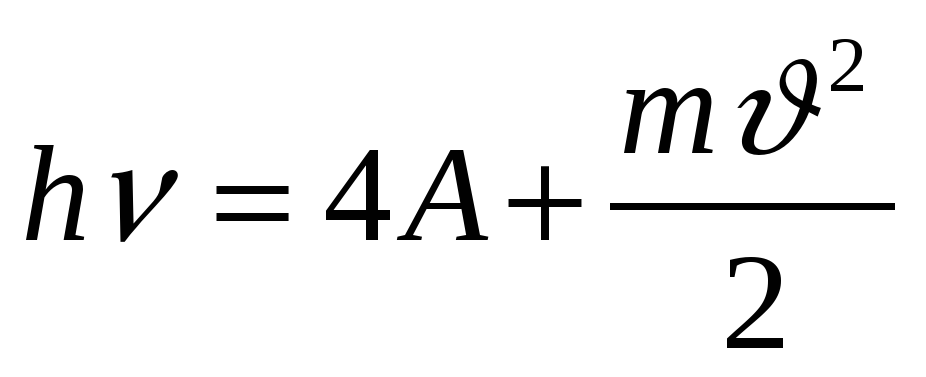 б)
б) 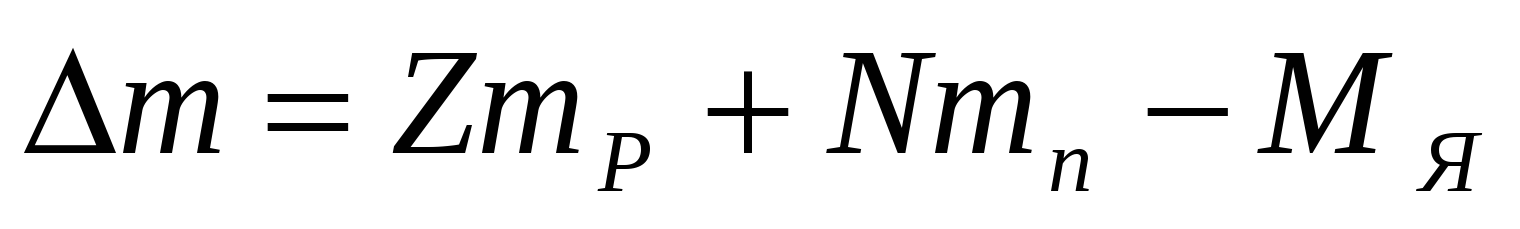 в)
в) 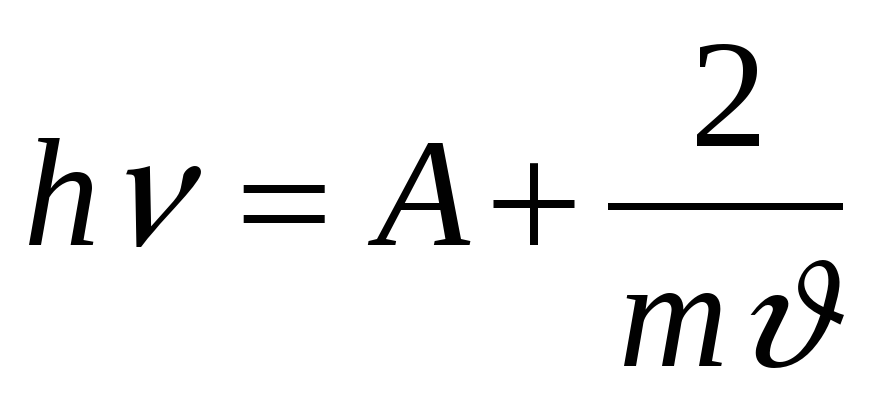
 г)
г) 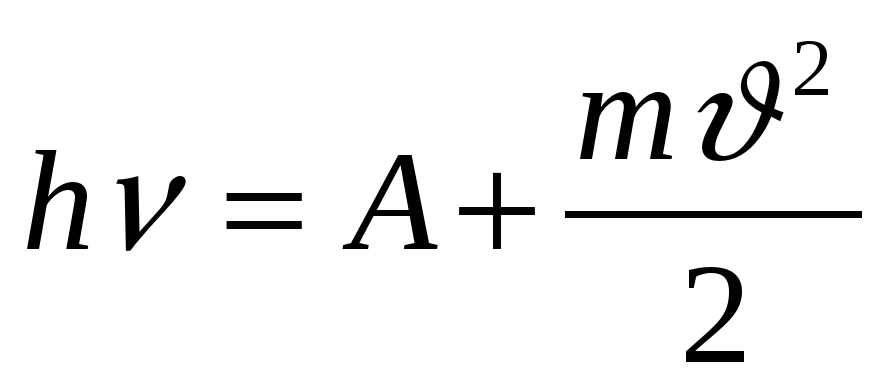
5. Согласно квантовой теории каждый фотон имеет энергию:
а) Е=h/v б) E=hv в) E=v/h г) E= v/h*2
3 вариант
Какой ученый в 1900 году измерил давление света на твердые тела?
а) Лебедев б) Бор в) Резерфорд г) Содди
Постоянная Планка равна…
а) 1,6*10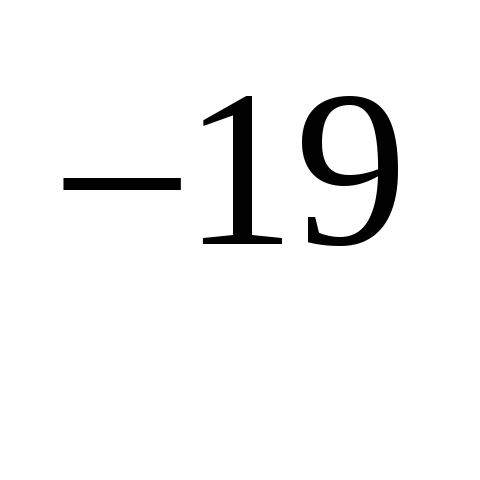 Кл б) 9,1*10
Кл б) 9,1*10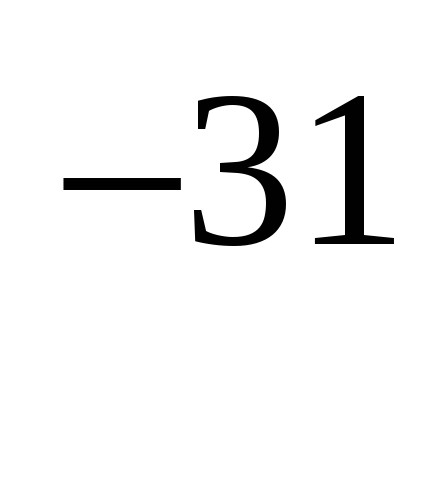 кг в )
кг в )  г) �
г) �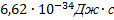 �
�
3. В каком году Лебедев измерил давление света на газы?
а) 1901г. б) 1907-1910 гг в) 1908г г) 1906г
4. Максимальное значение фототока называют…
а) красной границей
б) фототок насыщения
в) дисперсией
г) спектром
5. По какой формуле определяется красная граница фотоэффекта
а) 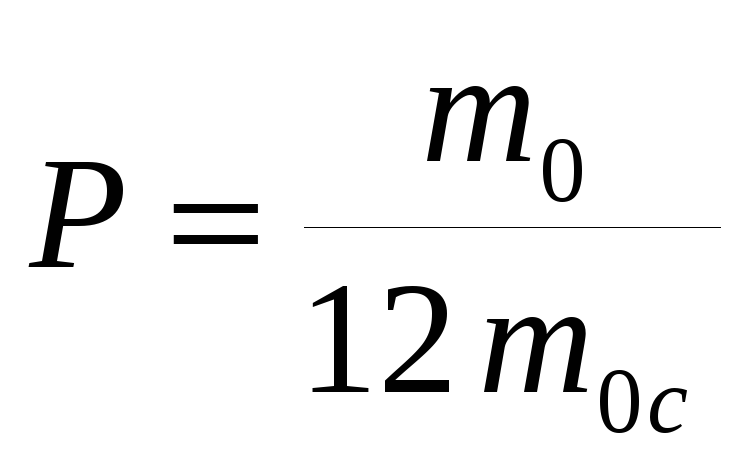 б)
б) 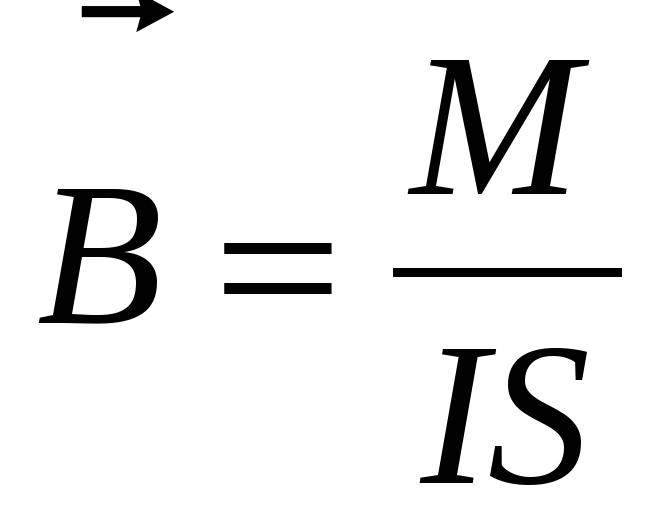 в)
в) 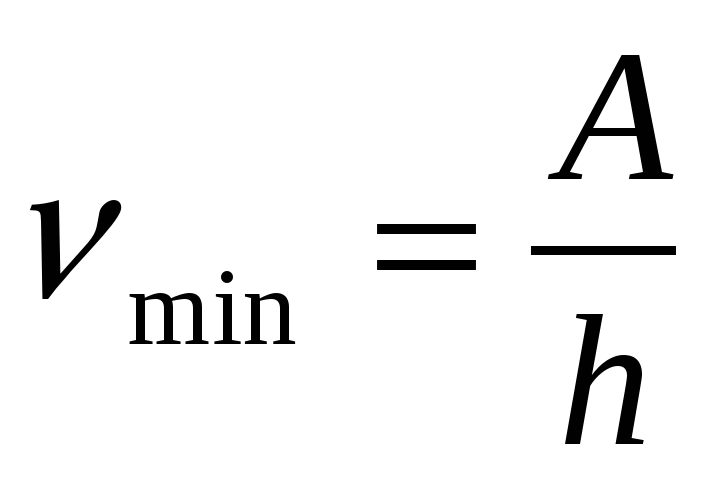 г) Ф= BScos
г) Ф= BScos
4 вариант
Как называется изображение объекта, полученное под действием света?
а) фотохимическим б) дифракцией в)скрытым г)дисперсией
Что такое фотоэффект?
а) Взаимодействия между электроном и нуклонами
б) упорядоченное движение заряженных частиц
в) явление вырывания электронов из вещества под действием света
г) зависимость скорости распространения волн в среде от их длины
Формула для определения давления света
а) 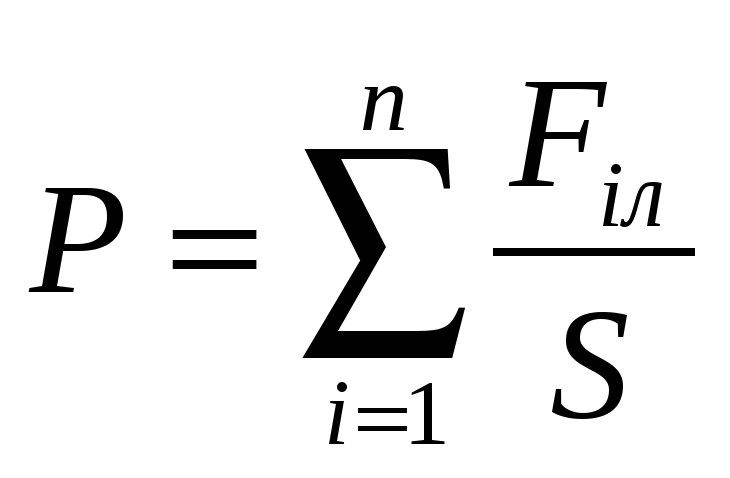 б)
б) 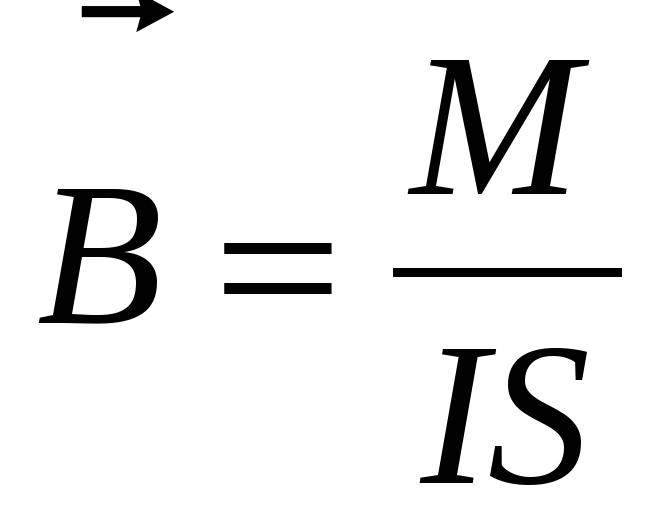 в)
в) 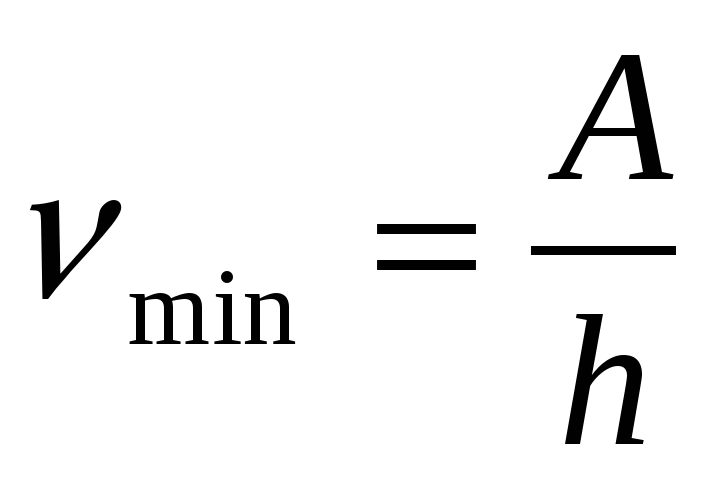 г) Ф= BScos
г) Ф= BScos
4. Какой ученый в 1900 году измерил давление света на твердые тела?
а) Лебедев б) Бор в) Резерфорд г) Содди
5. Что называется красной линией фотоэффекта?
а) максимальное значение фотоэффекта
б) минимальное значение фотоэффекта
в) минимальная частота света, ниже которой фотоэффект не наблюдается
г) максимальная частота света, ниже которой фотоэффект не наблюдается
5 вариант
1. Согласно квантовой теории каждый фотон имеет энергию:
а) Е=h/v б) E=hv в) E=v/h г) E= v/h*2
2. Максимальное значение фототока называют…
а) красной границей
б) фототок насыщения
в) дисперсией
г) спектром
3. Давление, которое производят электромагнитные световые волны, падающие на поверхность какого-либо тела – это…
а) давление света
б) фототок
в) давление фотоэффекта
г) Электрический ток
4. С помощью какого прибора измеряется сила фототока?
а) термометром
б) магнитометром
в) динамометром
г) миллиамперметром и гальванометром
5.Постоянная Планка равна…
а) 1,6*10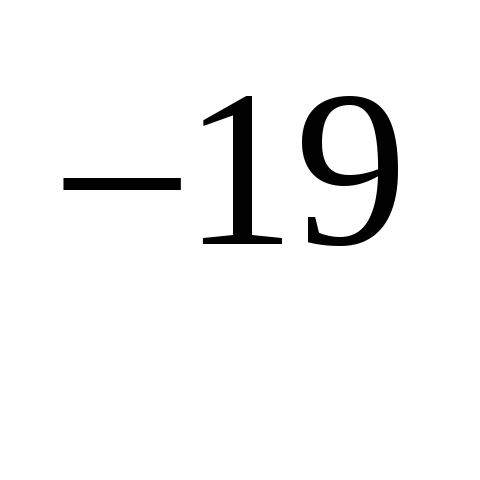 Кл б) 9,1*10
Кл б) 9,1*10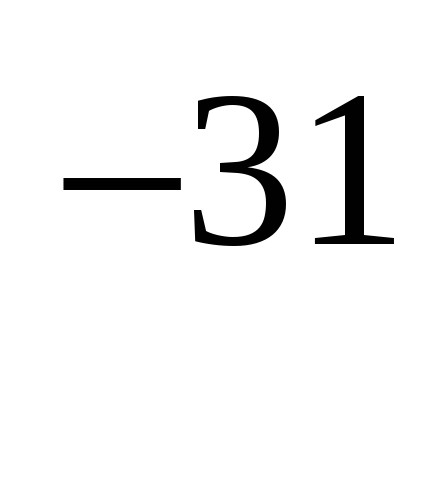 кг в ) �
кг в ) �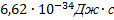 � г)
� г) 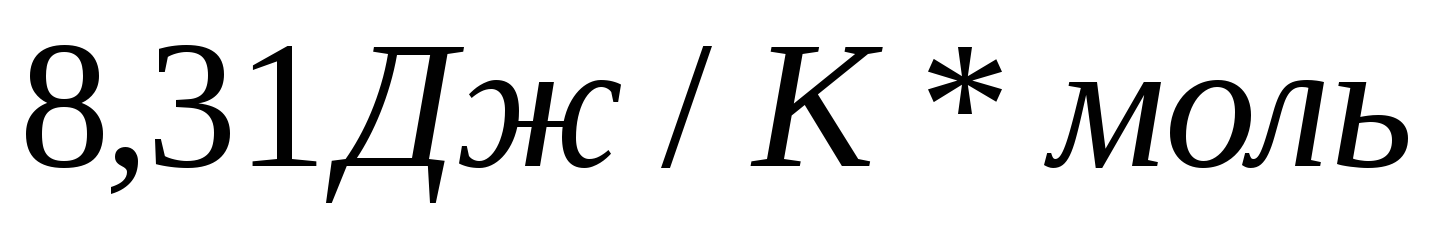
Ответы тестовых заданий
| Задание/ вариант | 1 Вариант | 2 Вариант | 3 Вариант | 4 Вариант | 5 Вариант |
|
|
| 1 | В | В | А | В | Б |
| 2 | А | Б | Г | В | Б |
| 3 | А | А | Б | А | А |
| 4 | Б | Г | Б | А | Г |
| 5 | Г | Б | В | В | В |
Определение проблемы.
Наша тема называется : «Строение атома. Постулаты Бора. Излучение и поглащение энергии атомом». Вы не раз встречались с понятием атома. В разделе молекулярная физика и по предмету химии использовали свойства веществ при решении задач.
Составьте синквейн на слово «АТОМ»- 7 мин
Имя существительное
Имя прилагательное
Глагол
Ваше отношение к данному слову
- индивидуально – 1 мин
- групповая- 1
- аудитория-1 мин
- Учение об атомах стало важнейшей областью физики. Мир атома никто не видел, но, тем неменее, он реален. Много проблем ставит перед нами жизнь. Одни решаются очень легко, над другими человечество бьется тысячи лет. А, знаете над каким вопросом: «Как устроен мир?», «Из чего все состоит?»- это те детские вопросы, на которые труднее всего ответить. И мы с вами в течении урока должны ответить на эти вопросы и должны найти факты сложного строения вещества. Поставим задачи пред собой.
Обучающиеся определяют цели самостоятельно.- 2 мин.
познакомиться с историей открытия атома и его сложного строения.
Рассмотреть факты, доказывающие сложное строение атома,
Научиться пользоваться Периодической системой химических элементов Менделеева для определения состава атома;
- Для изучения нового материала Я поделю вас на группы.
Деление обучающихся на команды осуществляется по игре «Бодрячок». – 1 мин.
Преподаватель раздает карты, по номеру в картах объединяются на группы. Каждый обучающийся, работая в микрогруппе, играя определенную роль, выполняя различные задания должен эффективно работать, как часть команды. Обучающимся рекомендуется делать записи по ходу урока. Свобода выбора действий и решений обучающихся допускается на всех этапах занятия. Преподаватель выступает в роли консультанта и контролирует последовательность и правильность выполнения заданий обучающимися. В групповом тренинге преподаватель не несет функцию руководителя в общепринятом значении этого слова, он является полноправным членом группы, несущим функцию фасилитатора, облегчающий включение всех членов группы в процесс самопроявления и самоактуализации.
На каждом этапе занятия обучающимся необходимо осуществлять проверку выполненных заданий членов микрогруппы по критериям оценки. Преподаватель выступает в роли консультанта.
Решение проблемы. Изучение нового материала (итого-25 мин).
Каждой микрогруппе предоставляются все необходимые материалы (учебник, представленный опорный конспект, ватманы, листы бумаги, маркеры). Обучающиеся должны в течении некоторого времени изучить материал, обсудить непонятные вопросы или задать вопрос преподавателю и презентовать по приему «Графический органайзер»
В группе -10 мин.
Ауд- 3 мин.
Опорный конспект
Первые представления об атоме (позиция Демокрита и Аристотеля)
Гипотеза о том, что все вещества состоят из большого числа атомов, зародилась свыше двух тысячелетий тому назад. Сторонники атомистической теории (Демокрит, Левкипп, Анаксагор, Анаксимандр, Эпикур, Лукреций Кар) рассматривали атом как мельчайшую неделимую частицу и считали, что все многообразие мира есть не что иное, как сочетание неизменных частиц — атомов.
Демокрит: существует предел деления атома. Аристотель: делимость вещества бесконечна. Париж, 1626 г.: учение об атоме запрещено под страхом смерти.
Еще в древности люди пытались найти первооснову всего. Так, первые ответы на эти вопросы родились в Древней Греции более 25 веков назад. Представитель одного из философских направлений Фалес Милетский утверждал, что в основе всех вещей лежит вода, на которой покоится Земля и которая дала начало всему, что есть. Другой древний мудрец Анаксимен говорил, что мир построен из воздуха. По мнению же Гераклита, все состоит из огня.
Наблюдая различные явления , Демокрит пришел к убеждению, что тела только кажутся нам сплошными, на самом же деле они состоят из мельчайших частиц. Демокрит назвал такие мельчайшие, не делимые далее частички, из которых состоят все тела, атомами «Нечего не существует, кроме атомов и пустоты» , - говорил он. Причем атомы различных тел, по Демокриту, отличаются друг от друга размерами форм.
Взгляды Демокрита продолжил и развил древнегреческий философ Эпикур (341-270 гг. до н.э.). Основываясь на учении Демокрита, он опроверг веру в Богов и отрицал бессмертия души. Эпикур впервые указал на то, что атомы различаются не только размерами и формой, но и массой. Впоследствии, около 2000 лет назад, в Древнем Риме атомистические воззрения древнегреческих философов были изложены в блестящей поэтические форме. Автором оригинальной поэмы был римский поэт и философов Лукреций Кар (94-55 гг.до н.э.). Звучными стихами в своей замечательной поэме «О природе вещей» Лукреций рассказывал о взглядах на мир древнегреческого философа Демокрита. Замечательная догадка древнегреческих мыслителей позднее была надолго забыта. Более тысячи лет научное естествознание почти не развивалась. В ученом мире на протяжении всего феодпльного средневековья безраздельно господствовало ошибочное учения Аристотеля; науку подменяло богословие.
После открытия в 1897 г. электрона, входящего в состав атома, был сделан вывод о сложном строении атома. Первая достаточно разработанная модель атома была предложена английским физиком Дж. Дж. Томсоном, открывшим электрон. Согласно этой модели вещество в атоме несет положительный заряд и равномерно заполняет весь объем атома. Электроны “вкраплены” в атом. Первая модель атома сыграла положительную роль. Но она требовала доказательств.
В начале века в физике бытовали самые разные и часто фантастические представления о строении атома, которые не нашли четкого обоснования и лишь модель атома, предложенная Джозефом Томсоном на долгие годы закрепилась в науке .Согласно этой модели вещество в атоме несет положительный заряд и равномерно заполняет весь объем атома. Электроны
« вкраплены» в атом, словно изюм в булку. Модель так и назвали «ПУДИНГ С ИЗЮМОМ», но эта модель не была подтверждена опытами.
Сэр Джозеф Джон Томсон –английский физик, открывший электрон, лауреат Нобелевской премии по физике с формулировкой « за исследование прохождения электричества через газы». Родился в 1856 году в Читем-Хилле вблизи Манчестра. Изучал физику, в 1876 году выиграл стипендию на обучение в Кембридже. С 1884 года профессор физики на кафедре экспериментальной физики в Кембридже. В 1911 г. разработал метод парабол для измерения отношения заряда частицы к ее массе. За научные заслуги награжден медалями: Франклина, Фарадея, Копли. Учеником Томсона был Эрнест Резерфорд, который позже занял его пост. Умер Джозеф Томсон в 1940 году..
Планетарная модель атома Резерфорда
Эрнест Резерфорд – английский ученый, известный своими исследованиями строения атома и радиоактивности, один из создателей атомной и ядерной физики.
Родился в 1871 году в Новой Зеландии в семье плотника и учительницы. В 1891 году будучи студентом выступил с докладом «Эволюция элементов», в котором заявил , что все атомы- сложные вещества и построены из одних и тех же составных частей. Тогда все посчитали его лишенным разума ,но спустя годы он доказал свою правоту.
Резерфорд являлся членом Лондонского королевского общества, почетным членом 30 Академий наук, в том числе и Советской Академии наук. В 1908 году удостоен Нобелевской премии за исследование радиоактивности. Его учениками были : Чедвик, Бор, советский физик Петр Капица и другие. Умер Эрнест Резерфорд в 1937 году.
Планетарная модель атома Экспериментом, который внёс решающий вклад в создание современной теории строения атома, стал опыт, проведённый в 1911 г. Э.Резерфордом совместно со своими ассистентами – Г.Гейгером и Э.Марсденом. Основные работы Резерфорда относятся к физике атома и ядра. Результаты эксперимента оказались неожиданными: подавляющая часть  -частиц проходила сквозь фольгу практически без отклонения или с отклонением на малые углы по отношению к направлению своего первоначального полёта, но небольшая часть
-частиц проходила сквозь фольгу практически без отклонения или с отклонением на малые углы по отношению к направлению своего первоначального полёта, но небольшая часть  -частиц отклонялась на значительные углы, достигающие почти 180°. Применив методы теории вероятностей, Резерфорд показал, что такие отклонения не могут быть следствием многократных столкновений
-частиц отклонялась на значительные углы, достигающие почти 180°. Применив методы теории вероятностей, Резерфорд показал, что такие отклонения не могут быть следствием многократных столкновений  -частиц с атомами, поэтому объяснить этот результат на основе модели атома Томсона невозможно.Он решил, что атом устроен наподобие планетной системы: малое по размерам положительно заряженное ядро, в котором сосредоточена почти вся масса атома, и отрицательные электроны, обращающиеся вокруг ядра по замкнутым орбитам. Заряд, отклоняющий
-частиц с атомами, поэтому объяснить этот результат на основе модели атома Томсона невозможно.Он решил, что атом устроен наподобие планетной системы: малое по размерам положительно заряженное ядро, в котором сосредоточена почти вся масса атома, и отрицательные электроны, обращающиеся вокруг ядра по замкнутым орбитам. Заряд, отклоняющий  -частицы на большой угол, не может принадлежать электрону, т.к. масса электрона мала по сравнению с массой
-частицы на большой угол, не может принадлежать электрону, т.к. масса электрона мала по сравнению с массой  -частицы. Очевидно, что
-частицы. Очевидно, что  -частица даже не почувствует электрон-«дробинку». Следовательно, электрон не изменит направление движения
-частица даже не почувствует электрон-«дробинку». Следовательно, электрон не изменит направление движения  -частицы. Это также позволяет сделать вывод, что с положительным зарядом, вызывающим отклонение
-частицы. Это также позволяет сделать вывод, что с положительным зарядом, вызывающим отклонение  -частиц, связана значительная масса.
-частиц, связана значительная масса.
Атомная система может находиться только в особых стационарных квантовых состояниях, каждому из которых соответствует определённая энергия Еn. В стационарном состоянии атом не излучает.
Стационарное состояние наиболее устойчиво – атом может находиться в нём неограниченно долго. Электрон находится на ближайшей к ядру дозволенной орбите. Для каждого атома имеется ряд строго определённых, дискретных, значений энергии, т.е. определённые энергетические уровни.
При переходе атома из стационарного состояния с большей энергией Ек в состояние с меньшей энергией Еn излучается квант энергии: 
Изменение энергии атома может происходить только скачком, дискретно:
скачок «вверх» –поглощение кванта энергии, скачок «вниз» – излучение кванта. В атоме допустимы только те орбиты, которые соответствуют одному из энергетических уровней. В стационарном состоянии атома электрон, двигаясь по круговой орбите, имеет дискретное, квантованное значение момента импульса: 
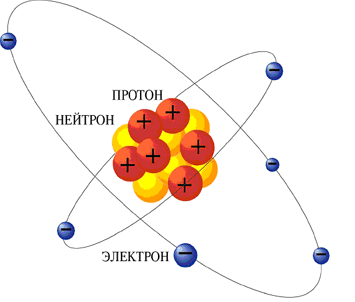
Атом состоит из ядра и электронов. Ядро состоит из протонов и нейтронов. Заряд протона равен по модулю заряду электрона. Нейтрон не имеет заряда. Масса протона приблизительно равна массе нейтрона.
Химические свойства атома определяются зарядом ядра. Атомы отличаются друг от друга числом электронов. Посмотрим на таблицу Менделеева: порядковый номер показывает число протонов в ядре, следовательно, он показывает и число электронов, т.к. атом в целом нейтрален. А число нейтронов, входящих в ядро можно найти таким образом: из массового числа вычесть число протонов. Например: Кислород, порядковый номер – 8 – число протонов 8, число электронов 8, а число нейтронов найдем, если вычтем из 16-8=8
M - Массовое число, масса ядра, число нуклонов
Z - зарядовое число, порядковый номер, число протонов, число электронов, заряд ядра
N - число нейтрон
N = M - Z определение числа нейтронов
Применение решения проблемы. Самостоятельная работа с последующей
самопроверкой ( итого – 21 мин.)
Задание I . Для проверки изученного материала обучающиеся выполняют самостоятельную работу. Заполняют таблицу – итого- 8 мин.
В группе 3 мин
ауд- 1 мин
Задание I.1.
По периодической системе химических элементов найдите число нейтронов, протонов, электронов, атомную массу Al, P, Br, Cl, N, O.
Задание I.2.
По периодической системе химических элементов найдите число нейтронов, протонов, электронов, атомную массу Zn, K, Be, Si, Li, O
Задание I.3
По периодической системе химических элементов найдите число нейтронов, протонов, электронов, атомную массу He Ti S F Ne Br
Задание I.4.
По периодической системе химических элементов найдите число нейтронов, протонов, электронов, атомную массу Zn, Se, Zr, Fe, Ar, Ni
Задание I.5.
По периодической системе химических элементов найдите число нейтронов, протонов, электронов, атомную массу As, Mn, Li, Co, Ne, C
Ответы этих заданий:
Задание 1.1.
| Характеристика атома | Al | P | Br | Cl | N | O |
| Число протонов | 13 | 15 | 35 | 17 | 7 | 8 |
| Число Электронов | 13 | 15 | 35 | 17 | 7 | 8 |
| Число Нейтронов | 14 | 16 | 45 | 18 | 7 | 8 |
| Порядковый номер элемента | 13 | 15 | 35 | 17 | 7 | 8 |
| Атомная масса | 27 | 31 | 80 | 35 | 14 | 16 |
Задание 1.2.
| Характеристика атома | Zn | K | Be | Si | Li | O |
| Число протонов | 30 | 19 | 4 | 14 | 3 | 8 |
| Число Электронов | 30 | 19 | 4 | 14 | 3 | 8 |
| Число Нейтронов | 35 | 20 | 5 | 14 | 4 | 8 |
| Порядковый Номер элемента | 30 | 19 | 4 | 14 | 3 | 8 |
| Атомная масса | 65 | 39 | 9 | 28 | 7 | 16 |
Задание 1.3.
| Характеристика атома | He | Ti | S | F | Ne | Br |
| Число протонов | 2 | 22 | 16 | 9 | 10 | 35 |
| Число Электронов | 2 | 22 | 16 | 9 | 10 | 35 |
| Число Нейтронов | 2 | 26 | 16 | 10 | 10 | 45 |
| Порядковый номер элемента | 2 | 22 | 16 | 9 | 10 | 35 |
| Атомная масса | 4 | 48 | 32 | 19 | 20 | 80 |
Задание 1.4.
| Элементы | Zn | Se | Zr | Fe | Ar | Ni |
| Число протонов | 30 | 34 | 40 | 26 | 18 | 28 |
| Число Электронов | 30 | 34 | 40 | 26 | 18 | 28 |
| Число Нейтронов | 35 | 45 | 51 | 30 | 22 | 31 |
| Порядковый номер элемента | 30 | 34 | 40 | 26 | 18 | 28 |
| Атомная масса | 65 | 79 | 91 | 56 | 40 | 59 |
Задание 1.5.
| Характеристика атома | As | Mn | Li | Co | Ne | C |
| Число протонов | 33 | 25 | 3 | 27 | 10 | 6 |
| Число Электронов | 33 | 25 | 3 | 27 | 10 | 6 |
| Число Нейтронов | 42 | 30 | 4 | 32 | 10 | 6 |
| Порядковый номер элемента | 33 | 25 | 3 | 27 | 10 | 6 |
| Атомная масса | 75 | 55 | 7 | 59 | 20 | 12 |
Задание II. По схеме должны определить ядра каких атомов представлены.
Задание III. Обучающиеся должны продемонстрировать Модели атомов.
Модель атома Гелия
Модель атома Лития
Модель атома Водорода
Модель атома Берилия
Модель атома Бора
Таким образом, знания о строении атома и ядра позволили использовать их в атомной энергетике.Цепная ядерная - реакция деления ядер урана . Служит для преобразования внутренней энергии атомных ядер в электрическую на атомных электростанциях. Управляемая и неуправляемая реакция. Атомная энергетика (управляемая цепная ядерная реакция). Атом приручили и спрятали под толстым слоем бетона и свинца. Сегодня он используется только в мирных целях. Первый ядерный реактор был создан в 1946 году в Советском Союзе под руководством Игоря Васильевича Курчатова. Неуправляемая цепная ядерная реакция. На фотографии изображен страшный гриб из радиоактивных веществ. Это следствие неуправляемой ядерной реакции. Взрыв атомной и водородной бомбы.
Обучающиеся делятся на группы по приему «Бодрячок»
(медики, экологи, биологи, экономисты)- 1 мин.
Делают презентации по темам:
Атомная энергетика и медицина
Атомная энергетика и экология
Атомная энергетика и биология
Атомная энергетика и экономика
В группе- 6 мин
Ауд-3 мин. Итого-21 мин.
Этап рефлексии.- 2 мин
Вернемся к нашему синквейну.
1. Какие частицы входят в состав ядра атома ?
2.Кто предложил ядерную модель строения атома?
3.Как определить количество нейтронов в атомном ядре?
4.Как определить количество протонов в атомном ядре?
5. Недостатки модели Томсона
6. Недостатки модели Резерфорда
7. Какие другие виды источников энергии вы знаете?
Подведение итогов урока: Прием «Листок выхода» (4 мин)
Отметить активность обучающихся, дать анализ полученных оценок.
Объявление домашнего задания: Жданов Л.С., Жданов Г.Л. Физика, Учебник для средних специальных учебных заведений, М: Наука, 1984
Туякбаев С., Насохова Ш., Кронгарт Б., Кем В., Физика, учебник для 11 класса средних школ Алматы. Мектеп, 2007
Мы благодарим вас за урок и те знания, которые вы сегодня показали. И пусть по жизни вас
ведет мудрая русская поговорка: «Не стыдно не знать, стыдно не учить». Урок окончен. До
свидания!
. Анализ и оценка результатов урока.
Процедура оценивания результатов осуществляется внутри группы.
«5» - без ошибок
«4» - 1 ошибка
«3» - 2, 3 ошибки
«2» - 4 и более ошибок
Возможные ошибки
Неточность в устных и письменных ответах
Ошибка в формуле
Ошибка в расчетах
Частичное отображение информации
Низкий уровень организации
Недостаточная активность
Критерии оценки:
« 5 » - Правильность устных и письменных ответов, полное отображение информации, высокий уровень организации, активность, сплоченность, воспитанность учащихся в команде.
« 4 » - Правильность устных ответов, 1 , 2 ошибки в письменных ответах, полное отображение информации, средний уровень организации, активность , сплоченность, воспитанность учащихся в команде.
« 3 » - Неточность в устных ответах, 2, 3-4 ошибки в письменных ответах, разрозненность команды.
« 2 » - Грубые ошибки в устных ответах, 5 и более ошибок в письменных ответах, низкая активность учащихся, невоспитанность, отсутствие сплоченности учащихся в команде.
Пояснительная записка для обучающихся:
Цель
Ваша задача - изучить тему «Электрический заряд. Типы предложений по цели высказывания»
К концу теоретического занятия усвоить теоретический материал и уметь в дальнейшем на практике применять свои знания.
Умения и навыки, которые вы получите:
общение с целью определять и получать информацию, обобщать ключевые моменты, предоставлять информацию другим, эффективно работать, как часть команды
ясно и четко отвечать на вопросы
планирование и применение действий, необходимых для выполнения задачи
работать в коллективе
Как вам предстоит работать?
Принимать активное участие в выполнении заданий:
а) Выполнить эксперимент – 7 минут.
в) Изучить новый материал по теме: обсудить непонятные вопросы или задать вопрос преподавателю, сделать записи в тетради и презентовать свои темы по приему «Графический органайзер» 13мин
в) Составить текст рекламы 10 мин.
На каждом этапе занятия вам необходимо осуществлять проверку выполненных заданий в своей микрогруппе по критериям оценки. Преподаватель выступает в роли консультанта.
Требования к результату вашей работы:
« 5 » - Правильность устных и письменных ответов , полное отображение информации, высокий уровень организации , активность, сплоченность, воспитанность учащихся в команде.
« 4 » - Правильность устных ответов, 1 , 2 ошибки в письменных ответах, полное отображение информации, средний уровень организации, активность , сплоченность, воспитанность учащихся в команде.
« 3 » - Неточность в устных ответах, 2, 3-4 ошибки в письменных ответах, разрозненность команды.
На каждом этапе занятия вам необходимо осуществлять проверку выполненных заданий другой микрогруппы по критериям оценки.


























