Урок 3. Химия 9-А класс дата_____________________________
9-Б класс дата______________________________
Тема: Основы строения электронных оболочек атомов, степень окисления.
Цели:
1. Дать представление о распределении ē в атомах по энергетическим уровням. Дать понятия об электронном облаке, электронной орбитали, энергетические уровни и подуровни. Раскрыть сущность формы орбиталей, взаимосвязи номера уровня и энергии ē, ввести понятие степени окисления.
2. Развивать внимание, память, речь, аналитическое мышление, способность делать выводы.
3. Воспитывать любовь к предмету.
Тип урока: комбинированный
Метод: рассказ с элементами беседы
План урока:
Электронное облако.
Энергетические уровни и подуровни.
Главное квантовое число и его значение.
Ход урока:
I. Орг. момент.
II. Опрос:
Назовите те явления, которые прямо или косвенно доказывают, что атом – сложная частица.
Как развивалась классическая теория строения атома? Какие модели атомов вам известны? В чём их суть?
Приведите примеры явлений, доказывающих двойственную (дуалистическую) природу частиц микромира.
Поясните. каково значение открытия радиоактивности в развитии химической науки? Какие изменения происходят с атомами при яд. реакциях?
Какие элементарные частицы вам известны?
Что такое изотопы? Чем изотопы одного хим.эл-та отличаются друг от друга?
Почему изотопы водорода сильно отличаются друг от друга по св-вам?
III. Изучение нового материала:
Ядро атома любого элемента окружено электронами. ē движется вокруг ядра со скоростью, близкой к скорости света ≈ 300000 км/с. →нельзя указать какую-то определённую точку его местонахождения, можно лишь указать область, где его пребывание наиболее вероятно. область вероятности обнаружения ē не имеет чётких границ. Однако можно выделить пространство, где вероятность нахождения ē будет максимальной.
Совокупность точек в пространстве, где пребывание ē наиболее вероятно называют электронным облаком или атомной орбиталью.
В состоянии ē есть некоторая неопределённость. Для хар-ки этого особого состояния нем. физик В.Гейзенберг ввёл понятие о принципе неопределённости, показав, что невозможно определить одновременно и точно энергию и местоположение ē. Чем точнее определена энергия, тем неопределённее будет его положение, и наоборот.
Важнейшей хар-кой движения ē на определённой орбитали является энергия его связи с ядром. Т.к. ē в атоме различаются своей энергией, то одни из них притягиваются к ядру сильнее, другие – слабее. Главная причина – удаление от ядра атома. Чем ближе к ядру, тем они прочнее связаны с ним, и их труднее вырезать из электронной оболочки, а чем дальше они от ядер, тем легче их оторвать. Зн. по мере удаления от ядра запас энергии ↑.
Электроны, движущиеся вблизи ядра «загораживают» (экранируют) ядро от других ē, которые притягиваются к ядру слабее и движутся на большем удалении от него. Зн. образуются электронные слои или энергетические уровни, состоящие из ē, с близкими значениями энергии. Энергетические уровни нумеруют, начиная от ядра 6 1,2,3,4,5,6 и 7. Значение энергии ē в атомах задаётся главным квантовым числом n ( совпадает с номером периода) и выражается только целым числом.
Целое число n, обозначающее номер энергетического уровня, называют главным квантовым числом.
Оно характеризует энергию ē, занимающих данный энергетич. Уровень. Наименьшей энергией обладают ē первого энерг. Уровня, наиболее близкого к ядру. По сравнению с ē 1-го энерг. уровня ē последующих уровней будут характеризоваться большим запасом энергии. → наименее прочно связаны с ядром ē внешнего уровня.
Число энерг. уровней( электронных слоёв) в атоме равно номеру периода в ПС, к которому принадлежит хим. эл-т: у атомов элементов 1-го периода – один энерг. уровень, второго периода – 2, седьмого периода – 7.
Максимальное число ē на энерг. уровне определяется по формуле:
N = 2n2 , где n – главное квантовое число.
Согласно этой формуле на первом энерг. уровне может находиться не более N = 2*12 =2ē, на втором N =2*22 =8 ē, на третьем N = 2*32=18, на четвёртом N = 2*42 = 32ē.
Начиная со второго энерг. уровня (n=2), каждый из уровней подразделяется на подуровни(подслои)в зависимости от формы облаков, несколько отличающиеся друг от друга энергией связи с ядром.
Число подуровней равно значению главного квантового числа: первый энерг. уровень имеет 1 подуровень, второй – 2, третий – 3, четвёртый – 4 подуровня. Подуровни в свою очередь образованы орбиталями.
Каждому значению n соответствует число орбиталей, равное n2.
| Энерг. уровень (n) | Число подуровней, равное n | Тип орбитали | Число орбиталей | Мах число ē |
| В подуровне | В уровне, n2 | На подуровне | На уровне, 2n2 |
| K ( n=1) | 1 | 1s | 1 | 1 | 2 | 2 |
| L (n=2) | 2 | 2s 2p | 1 3 | 4 | 2 6 | 8 |
|
M (n=3) |
3 | 3s 3p 3d | 1 3 5 |
9 | 2 6 10 |
18 |
|
N (n=4) |
4 | 4s 4p 4d 4f
| 1 3 5 7 |
16 | 2 6 10 14 |
32 |
s-подуровень – первый, ближайший к ядру атома подуровень каждого энерг. уровня, состоит из одной s-орбитали;
p-подуровень – второй поуровень каждого, кроме первого энерг. уровня, состоит из 3-х p-орбиталей;
d-подуровень – третий подуровень каждого, начиная с третьего энерг. уровня, состоит из 5 d-орбиталей;
d-подуровень – каждого, начиная с четвёртого, состоит из 7 f-орбиталей.
Число ē на внеш. энерг. уровне электронной оболочки атома равно номеру группы (хар-но для гл. подгрупп).
Итак, состояние электрона в атоме характеризуется квантовыми числами:
n — главное квантовое число (его характеристика нам уже известна);
l — побочное (орбитальное) квантовое число. Подуровни энергетического уровня характеризуются побочным квантовым числом. Оно зависимо от главного квантового числа и принимает значения от 0 до n - I.
Побочное квантовое число характеризует форму атомной орбитали и уточняет ее энергию по формуле E = n + l.
1. При l = 0 открывается подуровень s с s-орбиталыо, форма которой сферическая.
2. При l = 1 открывается подуровень р с р-орбйталями, форма которых напоминает объемную восьмерку.
3. При l = 2 открывается подуровень d с d-орбиталями, форма которых напоминает объемный лепесток и более сложную объемную восьмерку.
4. При l = 3 открывается подуровень f с f-орбиталями, имеющими более сложную форму.
Номер энергетического уровня соответствует количеству подуровней. При n = 3 — три подуровня; при n = 2 — два подуровня.
Количество орбиталей на подуровне определяется m — магнитным квантовым числом. Магнитное квантовое число определяет распределение орбиталей в магнитном поле ядра, оно зависимо от орбитального квантового числа и принимает значения от 0 до l - 1; m = 2l + 1.
Пример: при l = 0, ml = 0, орбиталь одна; при l = 1, m = -1, 0, +1, три орбитали.
Следует отметить, что все орбитали располагаются симметрично в пространстве:
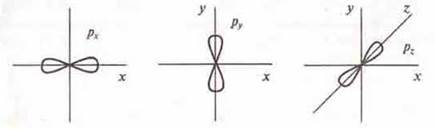
Атомные орбитали можно изображать ячейками или пунктирами:
Ячейкой  или пунктиром
или пунктиром 
s-подуровень:  или
или 
р-подуровень:  или
или 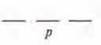
d-подуровень:  или
или 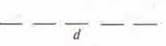
f-подуровень: 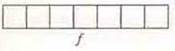 или
или 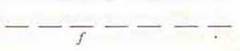
Спиновое квантовое число s — независимое. Это число — квантовое свойство электрона, не имеющее классических аналогов. Спин — это собственный момент импульса электрона, не связанный с движением в пространстве. Для всех электронов абсолютное значение спина 1/2. Проекция спина на ось (магнитное спиновое число ms может иметь лишь два значения: +1/2 или -1/2, т. к. спин электрона — величина постоянная.)
Вывод: Состояние электрона в атоме характеризуется квантовыми числами: n — главное квантовое число, l — побочное квантовое число, ml — магнитное орбитальное квантовое число,ms — магнитное спиновое квантовое число.
Зная квантовые числа у электрона, можно описать энергию, количество орбиталей, их форму и расположение в пространстве.
Заполнение электронами энергетических уровней описывается 3 правилами:
Принцип наименьшей энергии: суммарная энергия всех электронов атома, находящегося в основном состоянии, минимальна.
В любом атоме число АО теоретически бесконечно, а число электронов конечно. Как же электроны "размещаются "в электронной оболочке?
Возьмем (конечно, мысленно) ядро атома с атомным номером Z и Z электронов. Будем последовательно "бросать "по одному электрону в сторону взятого ядра. Электроны будут притягиваться ядром и занимать (заполнять) какие-то орбитали. Какие? В какой последовательности?
Чтобы ответить на эти вопросы, мы должны познакомиться с законами (принципами, правилами) заполнения АО электронами, иными словами, с законами построения электронной оболочки.
Первый закон (принцип наименьшей энергии): электроны в атоме занимают орбитали с наименьшими из возможных значениями энергии. Иными словами, суммарная энергия всех электронов атома должна быть минимальной. (правило Клечковского)
Если это так, то такое состояние атома называется основным или невозбужденным. Это устойчивое состояние атома. Любое другое состояние атома называется возбужденным.
Основное состояние атома – состояние атома с наименьшей энергией.
Используя энергетическую диаграмму атома и символически изображая на ней электроны в виде стрелок, направленных вверх (s = 1/2) или вниз (s = – 1/2), мы можем проиллюстрировать принцип наименьшей энергии:
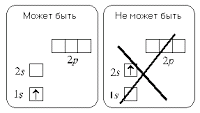
Полная электронная конфигурация атома – распределение всех электронов атома по уровням, подуровням и орбиталям.
У шестого электрона, который есть, например, у атома углерода, "возникает проблема": где ему на 2р-ЭПУ выгоднее разместиться – на свободной АО, или на АО с неспаренным электроном.
На этот вопрос отвечает третий закон, который называется правилом Хунда (немецкий физик Фридрих Хунд сформулировал его в 1927 году).
Вспомним, что электрон – заряженная частица, и, следовательно, электроны друг от друга отталкиваются; а раз так, то им выгоднее находиться на разных орбиталях одного подуровня, так как электронные облака этих орбиталей в пространстве не совпадают.
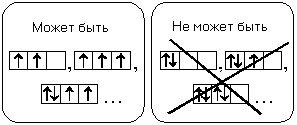
Несколько упрощенно правило Хунда звучит так: в пределах подуровня электроны распределяются по орбиталям таким образом, чтобы модуль суммы их спиновых квантовых чисел был максимальным.
Если шестой электрон сможет попасть на ту же орбиталь, что и предыдущий, то сумма спиновых квантовых чисел этих электронов по принципу Паули обязательно будет равна 1/2 + (–1/2) = 0 (электроны должны быть с разными спинами). А если этот электрон займет другую 2р-АО, то сумма спиновых квантовых чисел окажется равной 1/2 + 1/2 = 1, то есть больше, чем в первом случае. Модуль суммы окажется больше, чем в первом случае, и тогда, когда спиновые квантовые числа обоих электронов будут отрицательными.
Следовательно, электроны занимают орбитали одного подуровня сначала по одному и только потом по два, и шестой электрон попадет на свободную р-орбиталь:
Принцип Паули: в атоме не может быть даже двух электронов со всеми четырьмя одинаковыми квантовыми числами.
Если бы электроны "руководствовались"только принципом наименьшей энергии, то все Z электронов нашего атома оказались бы на 1s-орбитали.
Но этого не происходит, потому что существует второй закон (принцип Паули): в атоме не может быть даже двух электронов со всеми четырьмя одинаковыми квантовыми числами (швейцарский физик Вольфганг Паули сформулировал, в несколько иной форме, этот принцип в 1925 году).
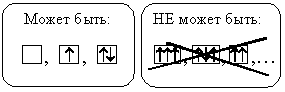
Вспомним, что атомная орбиталь характеризуется тремя квантовыми числами (n, l, m), а спиновое квантовое число (s) может принимать только два значения, следовательно, на одной АО может быть не более двух электронов.
Иными словами, электронное облако может быть образовано только одним или двумя электронами.
Орбиталь без электронов называют свободной орбиталью, орбиталь с одним электроном – орбиталью с неспаренным электроном, орбиталь с двумя электронами – заполненной орбиталью.
План составления схем строения электронных оболочек атомов:
А) определить общее число ē на оболочке по порядковому номеру эл-та;
Б) определить число энерг. уровней в электронной оболочке по номеру периода;
В) определить число ē на каждом энерг.уровне и подуровне.
Составить схемы строения электронных оболочек следующих атомов: Na, K, Ar, Ca, Mg…
Степень окисления- это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения ( ионные и ковалентно- полярные) состоят только из ионов.
Далее объясняю как по формулам химических соединений, рассчитать
степень окисления. Для этого нужно знать несколько правил:
1. В соединениях отрицательное значение с.о. имеют элементы с
большим значением электроотрицательности, а положительное значение с.о.- элементы с меньшим значением электроотрицательности.
2.Есть элементы с постоянной степенью с.о. и с переменной с. о.
Элементы с постоянным значением с. о.:
А) Металлы всегда имеют положительное значение С.О..У металлов главных подгрупп: 1 группы во всех соединениях с.о. равна +1; 2группы-+2; 3 группы-+3
Б) элемент фтор в соединениях всегда имеет с. о. -1
Элементы с переменным значением с.о.:
А) все остальные металлы (кроме перечисленных выше)
Б) Почти все неметаллы
В) Кислород почти всегда имеет с. о. равно-2
Г) В большинстве соединений водород имеет с. о. равна -1.,но в соединениях с металлами заряжен отрицательно, с. о. равна -1.
3. Нулевое значение с.о. окисления имеют атомы в молекулах простых веществ и атомы в свободном состоянии.
4. В соединениях суммарное значение с.о. равно нулю.
5. Для того, чтобы рассчитать с.о. данного элемента в соединении, надо знать с.о. другого элемента
IV. Закрепление:
Что такое электронное облако?
Чем отличается 1s-орбиталь от 2s-орбитали?
Что такое главное квантовое число? Как оно соотносится с номером периода?
Что такое подуровень и как это понятие соотносится с номером периода?
Работа с ПС по распределению ē по энерг. уровням и подуровням.
V. Д/з: записи в тетради
7








 или
или  или
или